APRI、GPR和FIB-4预测抗病毒诱导的乙型肝炎肝硬化肝脏病理学回归的性能评价
2019-09-02陆伟刘丹萍张占卿王雁冰丁荣蓉周新兰黄丹李秀芬杨可芷
陆伟 刘丹萍 张占卿 王雁冰 丁荣蓉 周新兰 黄丹 李秀芬 杨可芷
近10余年来,肝纤维化的无创预测取得了许多进展[1-3]。其中,肝脏弹性成像技术如瞬时弹性超声(transient elastography, TE)、声辐射力脉冲成像(acoustic radiation force impulse imaging, ARFI)和超声剪切波成像(supersonic shear imaging, SSI),以及无创数学模型如天冬氨酸转氨酶/血小板比值指数(aspartate aminotransferase to platelet ratio index, APRI)和基于四因子的纤维化指数(fibrosis index based on the four factors, FIB-4)等,已经被推广应用[4-6]。最近,Lemoine等[11]开发了一个新的比例模型,γ-谷氨酰转肽酶/血小板比值(gamma-glutamyl transpeptidase to platelet ratio, GPR),也能有效预测慢性乙型肝炎(chronic hepatitis B, CHB)肝纤维化水平[8-10]。
但是,迄今为止,关于肝纤维化无创预测的研究,绝大多数聚焦在对肝纤维化进展的预测[1-3, 7-10],极少数涉及到对肝纤维化回归的预测[11-17]。因此,目前尚不清楚对肝纤维化进展有预测价值的无创指标是否对肝纤维化回归也有预测效应。本研究的目的,初步探讨APRI、GPR和FIB-4及其构件预测长期抗病毒治疗期间乙型肝炎肝硬化纤维化回归和与其相关的肝脏坏死炎症回归的性能。
资料与方法
一、 研究对象
2009年1月—2015年12月在上海市公共卫生临床中心住院的首次肝脏病理学评估(随访起点)为肝硬化的75例HBeAg阳性CHB患者入选本研究;入选患者在接受长期抗病毒治疗12~57月(中位值30月,四分位距19~36月)后,于2017年6月前接受了再次肝脏病理学评估(随访终点)。75例患者中,2例、3例、18例和3例分别接受了拉米夫定、替比夫定、恩替卡韦和阿德福韦酯的单一抗病毒治疗;14例、33例、2例分别接受了拉米夫定、替比夫定、恩替卡韦联合阿德福韦酯的优化抗病毒治疗。所有患者在抗病毒治疗3个月内接受每月1次随访;如3月后血清HBV DNA仍超过检测下限(<500 IU/mL),采用联合抗病毒方案并继续接受每月1次随访;血清HBV DNA连续两次低于检测下限后,接受每3~6月1次随访。从随访起点后6月到随访终点的每次随访,所有患者血清HBV DNA均保持不可检测。
随访起点前6月内曾接受干扰素类和核苷(酸)类抗病毒治疗的患者被排除;随访起点或随访终点有遗传性肝病、脂肪性肝病、慢性胃肠道疾病的患者被排除;从随访起点到随访终点,所有患者均无其他病毒性肝炎、药物性肝损害、显著饮酒(>20 g/d)以及接受干扰素类、甘草酸类、苦参碱/苦参素和传统中医治疗的记录。本研究得到了上海市公共卫生临床中心伦理委员会的批准;所有患者在随访起点和随访终点接受肝活检前均常规签署知情同意书,研究过程遵循2013版Helsinki宣言。
二、病理学评估
肝脏活检采用1秒钟经皮肝穿刺法。标本采集后立即置塑料标本管内冰冻送检。活检标本的质量评价和肝脏病理学评估由1名有经验的病理学医师独立完成。肝脏病理学评估采用Scheuer评分系统[18]。本研究将随访起点肝脏病理学分期=S4定义为肝硬化;随访终点肝脏病理学分级≤G2和分期≤S3分别定义为显著坏死炎症回归(significant necro-inflammation regression, SINIR)和显著纤维化回归(significant fibrosis regression, SIFR),病理学分级≤G1和分期≤S1分别定义为广泛坏死炎症回归(extensive necro-inflammation regression, EXNIR)和广泛纤维化回归(extensive fibrosis regression, EXFR)。
三、实验室检查
血清HBsAg和HBeAg采用Abbott Architect I 2 000全自动化学发光免疫系统及其配套试剂检测;其中,HBsAg线性检测范围为(0.05~250)IU/mL,如超过检测上限,血清稀释500倍重新检测,HBeAg检测下限为1.0 S/CO。血清HBV DNA采用Bio-Rad Icycler PCR系统检测,试剂购自深圳Qiagen生物工程有限公司;线性检测范围为(500~5×107)IU/mL。
血清丙氨酸转氨酶(alanine transferase, ALT)、天冬氨酸转氨酶(aspartate transferase,AST)和γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)采用Hitachi 7 600全自动生化分析仪及其配套试剂检测;正常参考值分别为(9~50)IU/L、(15~40)IU/L和(10~60)IU/L。外周血血小板(platelet, PLT) 采用Sysmex-XT 4 000i全自动血细胞分析仪检测,正常参考值(125~350)×109/L。
(四) 统计学方法
数据分析和图形制作采用Medcalc 15.8软件。随访终点与随访起点患者APRI、GPR和FIB-4及其构件之间的差异比较采用两配对样本Wilcoxon检验。随访终点有SINIR与无SINIR、有EXNIR与无EXNIR、有SIFR与无SIFR和有EXFR与无EXFR患者APRI、GPR和FIB-4及其构件之间的差异比较采用两独立样本Mann-WhitneyU检验。随访终点与随访起点患者肝脏病理学分级和分期构成之间的差异比较采用Pearsonχ2检验。随访终点有SINIR与无SINIR和有EXNIR与无EXNIR患者肝脏病理学分期构成之间、有SIFR与无SIFR和有EXFR与无EXFR患者肝脏病理学分级构成之间的差异比较采用Pearsonχ2检验。随访终点患者肝脏病理学分级与分期之间,APRI、GPR和FIB-4及其构件与肝脏病理学分级和分期之间的相关性采用Spearman相关分析;随访终点患者肝脏病理学分级和分期,APRI、GPR和FIB-4及其构件与抗病毒治疗持续时间之间的相关性采用Spearman相关分析。APRI、GPR和FIB-4及其构件预测SINIR、EXNIR和SIFR、EXFR的性能评价采用ROC曲线法,最佳截断值的确定参照最大的Youden指数。P<0.05为差异有统计学意义。
结 果
一、抗病毒治疗期间血清HBsAg、HBeAg和HBV DNA的变化
从随访起点到随访终点,所有患者HBsAg 均保持阳性,随访终点与随访起点患者中位HBsAg水平之间的差异无统计学意义(P>0.05);随访终点患者HBeAg 消失率和转换率均显著高于随访起点患者(P均<0.0001);随访终点患者HBV DNA 不可检测率显著高于随访起点患者(P<0.0001);见表1。
二、抗病毒治疗期间肝脏坏死炎症和纤维化的变化
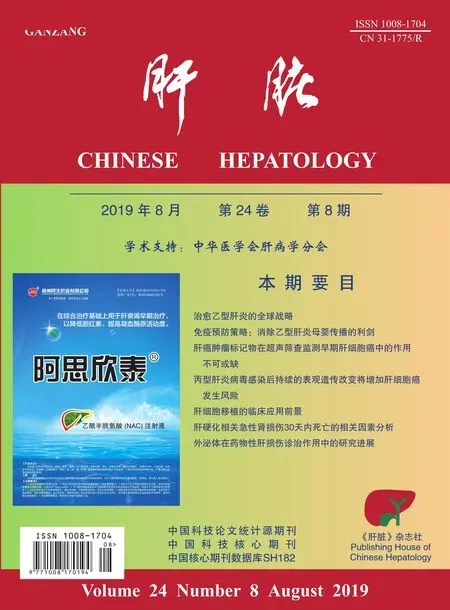
随访终点与随访起点患者肝脏不同病理学分级和分期构成之间的差异均有统计学意义(P均<0.0001),见表1和图1A~1B。
随访终点患者病理学分级与分期呈显著正相关(rs=0.606,P<0.0001)。随访终点患者病理学分级和分期与抗病毒治疗时间均无显著相关性(rs=-0.185,P=0.1122和rs=-0.168,P=0.1500)。
随访终点有SINIR与无SINIR、有EXNIR与无EXNIR患者病理学分期构成之间的差异均有统计学意义(P均<0.05);有SINIR的患者中,有SIFR的比例(83.6%, 61/73)与无SIFR的比例(16.4%, 12/73)之间的差异有统计学意义(χ2=4.295,P=0.0382),有EXFR的比例(23.3%, 17/73)与无EXFR的比例(76.7%, 56/73)之间的差异无统计学意义(χ2=0.006,P=0.9363);有EXNIR的患者中,有SIFR的比例(93.4%, 57/61)与无SIFR的比例(6.6%, 4/61)之间的差异有统计学意义(χ2=27.434,P< 0.0001),有EXFR的比例(27.9%, 17/61)与无EXFR的比例(72.1%, 44/61)之间的差异无统计学意义(χ2=3.581,P=0.0585);见图1C~1D。
随访终点有SIFR与无SIFR患者病理学分级构成之间的差异有统计学意义(P<0.0001),有EXFR与无EXFR患者病理学分级构成之间的差异无统计学意义(P>0.05);有SIFR的患者中,有SINIR的比例(100.0%, 61/61)和无SINIR的比例(0.0%, 0/61)之间的差异有统计学意义(χ2=4.295,P=0.0382),有EXNIR的比例(93.4%, 57/61)和无EXNIR的比例(6.6%, 4/61)之间的差异有统计学意义(χ2=27.434,P< 0.0001);有EXFR的患者中,有SINIR的比例(100.0%, 17/17)和无SINIR的比例(0.0%, 0/17)之间的差异无统计学意义(χ2=0.006,P=0.9363),有EXNIR的比例(100.0%, 17/17)和无EXNIR的比例(0.0%, 0/17)之间的差异无统计学意义(χ2=3.581,P=0.0585);见图1E~1F。
三、抗病毒治疗期间ALT、AST、GGT和PLT的变化
随访终点与随访起点患者中位ALT、AST、GGT和PLT之间的差异均有统计学意义(P均<0.0001),见表1。

表1 研究对象的临床、实验室和病理学特征
M:中位值;IQR:四分位距;Rang:全距;LLD:检测下限;a:Pearsonχ2检验;b:两配对样本Wilcoxon检验。
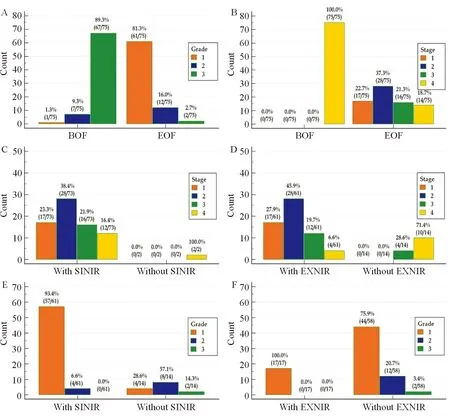
图1随访起点(BOF)和随访终点(EOF)肝脏不同病理学分级(Grade)和分期(Stage)的频数分布 SINIR:显著坏死炎症回归;EXNIR:广泛坏死炎症回归;SIFR:显著纤维化回归;EXFR:广泛纤维化回归。
随访终点患者ALT、AST和GGT与病理学分级均无显著相关性(rs=0.119,P=0.3086,rs=0.179,P=0.1248 和rs=0.138,P=0.2368),与病理学分期均无显著相关性(rs=0.080,P=0.4947,rs=0.130,P=0.2676和rs=0.055,P=0.6367);PLT与病理学分级和分期均呈显著负相关(rs=-0.342,P=0.0027和rs=-0.265,P=0.0216)。随访终点患者ALT、AST、GGT和PLT与抗病毒治疗时间均无显著相关性(rs=0.044,P=0.7077,rs=0.101,P=0.3892,rs=-0.109,P=0.3518和rs=-0.119,P=0.3077)。
随访终点有SINIR与无SINIR患者中位ALT、AST、GGT和PLT之间的差异均无统计学意义(P均>0.05);有EXNIR与无EXNIR患者中位ALT、AST和GGT之间的差异均无统计学意义(P均>0.05),中位PLT之间的差异有统计学意义(P<0.005);见表2。
随访终点有SIFR与无SIFR患者中位ALT、AST和GGT之间的差异均无统计学意义(P均>0.05),中位PLT之间的差异有统计学意义(P<0.01);随访终点有EXFR与无EXFR患者中位ALT、AST、GGT和PLT之间的差异均无统计学意义(P均>0.05);见表3。
四、抗病毒治疗期间APRI、GPR和FIB-4的变化
随访终点与随访起点患者中位APRI、GPR和FIB-4之间的差异均有统计学意义(P均<0.0001),见表1。
随访终点患者APRI、GPR和FIB-4与病理学分级均呈显著正相关(rs=0.310,P=0.0069,rs=0.319,P=0.0053 和rs=0.375, 0.0009);APRI和FIB-4与病理学分期均呈显著正相关(rs=0.236,P=0.0414和rs=0.232, 0.0456),GPR与病理学分期无显著相关性(rs=0.191,P=0.1014)。随访终点患者APRI、GPR和FIB-4与抗病毒治疗时间均无显著相关性(rs=0.174,P=0.1350,rs=0.010,P=0.9330和rs=0.215,P=0.0638)。
随访终点有SINIR与无SINIR患者中位APRI、GPR和FIB-4之间的差异均无统计学意义(P均>0.05),有EXNIR与无EXNIR患者中位APRI、GPR和FIB-4之间的差异均有统计学意义(P均<0.01);见表2。
随访终点有SIFR与无SIFR患者中位APRI、GPR和FIB-4之间的差异均有统计学意义(P均<0.01),有EXFR与无EXFR患者中位APRI、GPR和FIB-4之间的差异均无统计学意义(P均>0.05);见表3。

表2 随访终点有显著和广泛坏死炎症回归与无显著和广泛坏死炎症回归患者APRI、GPR和FIB-4及其构件之间的差异比较
M:中位值;IQR:四分位距;Rang:全距;ND:不确定;a:Pearsonχ2检验;b:两独立样本Mann-WhitneyU检验。

表3 随访终点有显著和广泛纤维化回归与无显著和广泛纤维化回归患者APRI、GPR和FIB-4及其构件之间的差异比较
M:中位值;IQR:四分位距;Rang:全距;a:Pearsonχ2检验;b:两独立样本Mann-WhitneyU检验。
五、APRI、GPR、FIB-4和PLT预测肝脏病理学回归的性能
APRI、GPR、FIB-4及其共享构件PLT预测EXNIR和SIFR的ROC曲线下面积均显著大于对角参考线下面积(P均≤0.01),见表4和图2。
APRI、GPR、FIB-4和PLT预测SINIR的ROC曲线下面积(95%CI)分别为0.582(0.000~1.000)、0.705(0.283~1.000)、0.647(0.112~1.000)和0.507(0.000~1.000),与对角参考线下面积之间的差异均无统计学意义(Z=0.210,P=0.8336,Z=0.953,P=0.3406,Z=0.540,P=0.5895和Z=0.019,P=0.9850),见图2A;预测EXFR的ROC曲线下面积(95%CI)分别为0.598(0.438~0.758)、0.529(0.385~0.674)、0.570(0.417~0.723)和0.595(0.438~0.753),与对角参考线下面积之间的差异均无统计学意义(Z=1.200,P=0.2301,Z=0.400,P=0.6895,Z=0.895,P=0.3710和Z=1.189,P=0.2345);见图2D。
参照本研究资料确定的最佳截断值和Liu等[14]建议的预测肝纤维化进展的实用截断值,APRI、GPR和FIB-4预测EXNIR和SIFR的灵敏度相对高于特异度;以本研究资料确定的最佳截断值为标准,PLT预测EXNIR和SIFR的特异度相对高于灵敏度;见表4。
讨 论
Manne等[20]的系统综述认为,经皮肝活检观察到的肝硬化逆转与CHB显著的临床结局改善有关;12~60月的长期抗病毒治疗可以使33%~80%(中位值70%)的肝硬化获得逆转。但是,肝硬化逆转的概念一致存在争议。事实上,肝硬化回转到正常肝脏难以证明;而且目前采用的所有肝脏病理学评分系统是否可用于肝硬化逆转的评估尚未被证实[21]。因此,本研究采用一个新的术语,即肝脏病理学回归,包括坏死炎症回归和纤维化回归,来代替肝硬化逆转或回归的概念。
图2APRI、GPR、FIB-4和PLT预测显著和广泛坏死炎症及纤维化回归的ROC曲线 A:预测显著坏死炎症回归;B:预测广泛坏死炎症回归;C:预测显著纤维化回归;D:预测广泛纤维化回归
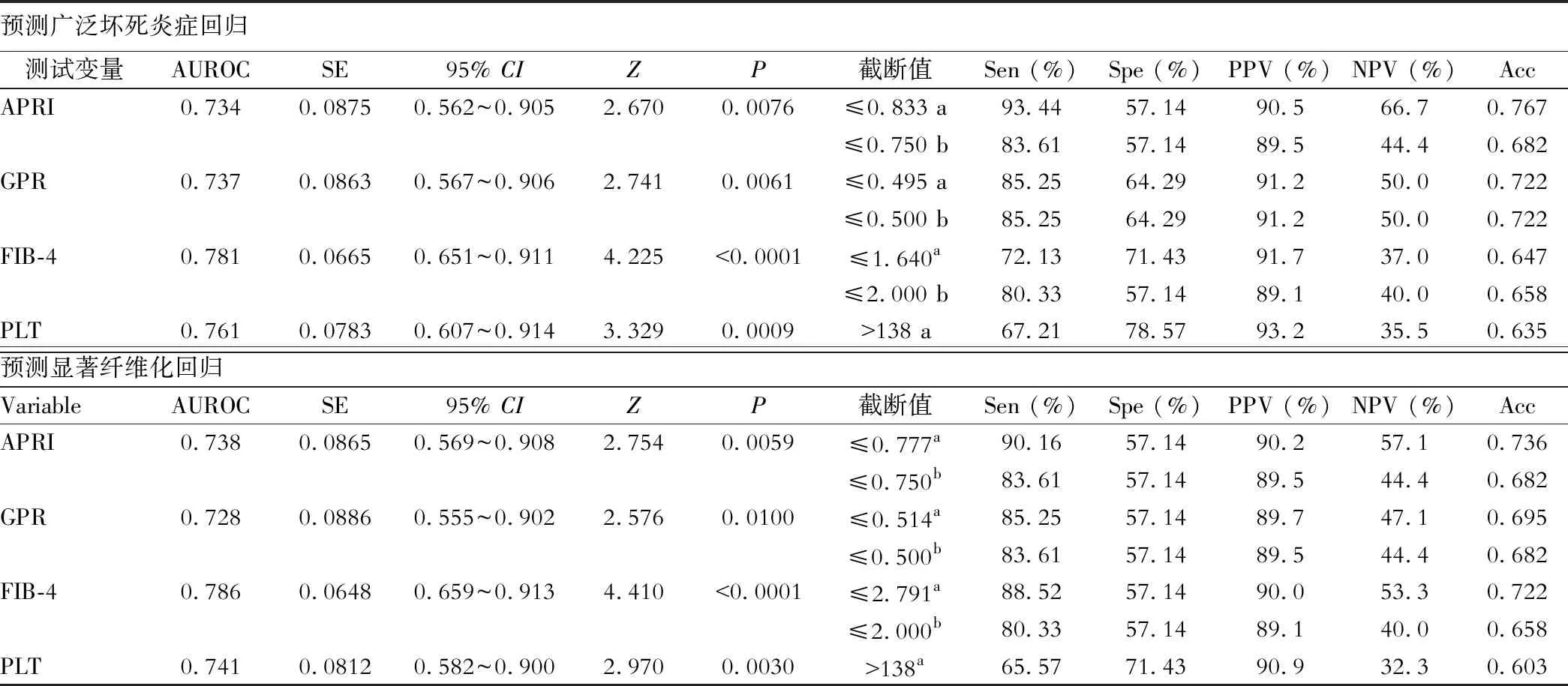
表4 APRI、GPR、FIB-4和PLT预测广泛坏死炎症回归和显著纤维化回归的性能
AUROC:ROC曲线下面积;Sen:灵敏度;Spe:特异度;PPV:阳性预测值;NPV:阴性预测值;Acc:准确度。a:根据本文资料确定的截断值;b:根据Liu等[14]的研究预设的截断值。
根据本文资料,HBeAg阳性的乙型肝炎肝硬化,在经历12~57月(中位值30月)的长期抗病毒治疗后,分别有97.3%和81.3%的患者获得了SINIR和EXNIR,同时分别有81.3%和22.7%的患者获得了SIFR和EXFR。本文结果显示,随访终点患者肝脏病理学分级与分期呈显著正相关;有SINIR和有EXNIR的患者中,有SIFR的比例均显著高于无SIFR的比例,但是,有EXFR的比例与无EXFR的比例之间无统计学差异;有SIFR的患者中,有SINIR和有EXNIR的比例分别显著高于无SINIR和无EXNIR的比例;但是,有EXFR的患者中,有SINIR和有EXNIR的比例分别与无SINIR和无EXNIR的比例之间无统计学差异。提示抗病毒诱导的肝脏坏死炎症回归是导致肝硬化SIFR的一个前提条件[20],但不是实现EXFR的充分决定因素。促成EXFR还需要肝细胞再生和肝小叶重建机制的共同参与[21]。
近年来,有少数研究描绘了涵盖小比例肝硬化的CHB患者在长期抗病毒治疗期间的动态变化或抗病毒治疗前后一些无创指标如肝脏硬度(liver stiffness measurement, LSM)、APRI和FIB-4的变化[11-16]。这些研究展示了相似的结果,即LSM、APRI和FIB-4在抗病毒治疗期间逐步下降或抗病毒治疗后显著下降;也存在共同的限制,即缺少抗病毒治疗后的再次病理学评估[11-15]或仅少数患者进行了再次病理学评估[16]。最近,Liang等[17]根据一个164例CHB患者队列,展现了LSM在抗病毒治疗开始后的先快后慢下降模式;提示CHB患者在抗病毒治疗开始后的肝脏病理学回归表现为先坏死炎症回归、后纤维化回归的过程。Wang等[22]根据一个131例CHB患者队列,发现了几丁质酶-3样1不仅在抗病毒治疗后显著下降,而且在抗病毒治疗前后均与CPA呈显著正相关;提示几丁质酶-3样1不仅可用于预测抗病毒治疗前的纤维化进展,而且可用于预测抗病毒治疗后的纤维化回归。但是,迄今为止,CHB患者在长期抗病毒治疗期间肝纤维化回归的所有无创预测研究,均未涉及到相关的无创指标预测乙型肝炎肝硬化肝纤维化回归的性能评价。
本文结果显示,APRI、GPR和FIB-4的非共享构件ALT、AST和GGT与随访终点患者肝脏病理学分级和分期均无显著相关性,中位ALT、AST和GGT在有SINIR与无SINIR、有EXNIR与无EXNIR之间和有SIFR与无SIFR、有EXFR与无EXFR之间的差异均无统计学意义。但是,APRI、GPR和FIB-4及其共享构件PLT与随访终点患者肝脏病理学分级均有显著相关性,APRI、FIB-4和PLT与随访终点患者肝脏病理学分期有显著相关性;中位APRI、GPR、FIB-4和PLT在有EXNIR与无EXNIR之间和SIFR与无SIFR之间的差异均有统计学意义,但在有SINIR与无SINIR之间和有EXFR与无EXFR之间的差异均无统计学意义。提示APRI、GPR和FIB-4及其共享构件PLT对长期抗病毒治疗期间EXNIR和SIFR有潜在的预测价值。
本文的ROC曲线分析进一步证实了APRI、GPR、FIB-4和PLT对EXNIR和SIFR有显著的预测意义。巧合的是,本文根据小样本确定的APRI和GPR预测HBeAg阳性肝硬化EXNIR和SIFR的最佳截断值与我们最近发表的根据大样本确定的APRI和GPR预测HBeAg阴性CHB纤维化进展的实用截断值非常接近[10];采用本文确定的最佳截断值和我们最近确定的实用截断值,APRI、GPR、FIB-4预测肝硬化EXNIR和SIFR的特异度和灵敏度也基本一致。所不同的是,以我们最近确定的实用截断值为标准,APRI、GPR、FIB-4预测抗病毒诱导的肝硬化EXNIR和SIFR的灵敏度超过80%,但肝硬化被误诊为EXNIR和SIFR的几率不低于40%;APRI、GPR、FIB-4预测抗病毒初治的肝硬化的特异度超过65%,且肝硬化被漏诊为非肝硬化的几率低于25%。相反,以本文确定的最佳截断值为标准,PLT预测EXNIR和SIFR的灵敏度超过65%,但肝硬化被误诊为EXNIR和SIFR的几率低于30%。
综上,本文初步探讨了长期抗病毒治疗期间APRI、GPR和FIB-4及其构件预测乙型肝炎肝硬化肝脏病理学回归的性能。APRI、GPR和FIB-4的非共享构件ALT、AST和GGT对肝硬化病理学回归无预测意义;APRI、GPR和FIB-4及其共享构件PLT对肝硬化EXNIR和SIFR有显著的预测价值。