生命早期抗生素干预对小鼠肠道菌群及脑部功能基因表达的影响
2019-09-02张瑜杰蒲芳芳程如越郭佳汶王世杰蒋与刚李鸣何方
张瑜杰 蒲芳芳 程如越 郭佳汶 王世杰 蒋与刚 李鸣 何方,*
(1 四川大学华西公共卫生学院 营养与食品卫生及毒理学系, 成都 610041;2 河北科技大学生物科学与工程学院,石家庄,050018;3 军事科学院军事医学研究院环境医学与作业医学研究所,天津 300041)
肠道中存在着种类丰富、数量众多的微生物,其中仅细菌就有厚壁菌门,拟杆菌门和变形菌门等1000多种[1],它们共同构成了一个复杂的生态环境,即肠道菌群。肠道菌群可通过与宿主之间在物质及能量等方面的相互作用,直接或者间接地影响机体正常生理功能及宿主对于疾病的易感性[2],且肠道菌群对肠道以外的器官也存在调节作用。人体肠道菌群在围产期和婴幼儿时期内迅速建立。同时,围产期和婴幼儿期也是中枢神经系统发育的关键时期,该时期的内外环境因素将对大脑及行为产生长期影响[3-4]。有研究认为“微生物-肠-脑轴”可通过神经、免疫、内分泌以及“下丘脑-垂体-肾上腺”轴(hypothalamus-pituitary-aderenal axis,HPA axis)等多种方式双向调节,但具体机制尚未明确[5]。
抗生素目前广泛应用于临床治疗中,使用不当有可能导致肠道菌群紊乱。目前已有研究表明生命早期使用抗生素与过敏,肥胖等疾病的发生有关[4]。此外,还发现抗生素引起的肠道菌群失调与认知功能障碍的发生有关[6]。
本次实验选择在生命早期对小鼠进行抗生素干预,造成肠道菌群紊乱。进而检测小鼠的肠道菌群变化,肠道病理改变和海马及前额皮质区域的神经化学物质mRNA表达情况。旨在探讨生命早期抗生素干预对肠道菌群及脑部功能基因表达的影响。
1 实验方法
1.1 材料和仪器
8只SPF级孕期15d左右的昆明孕鼠,购于四川省医学科学院实验动物研究所(生产许可证号为SCXK(川)2013-15),随机分为两组。给予自由饮水、膳食,温度(22±1)℃,湿度(55±5)%,昼夜节律12h。每日早晚两次观察孕鼠,以新生小鼠作为研究对象,随机分为对照组和抗生素组(n=10/组)。
氨苄西林钠、盐酸万古霉素、硫酸新霉素、杆菌肽、亚胺培南/西司他丁钠、水溶性两性霉素B(大连美仑生物技术有限公司),小鼠ELISA试剂盒(R&D Systems中国公司),Geneout™TRIzol总RNA提取试剂盒(成都兰博生物科技有限公司),iScript™ gDNA Clear cDNA Synthesis Kit[伯乐生命医学产品(上海)有限公司],TIANamp stool DNA Kit[天根生化科技(北京)有限公司],Qubit™ dsDNA HS Assay Kit[赛默飞世尔科技(中国)有限公司],Illumina PhiX Control v3[Illumina贸易(上海)有限公司]。
酶标仪[赛默飞世尔科技(中国)有限公司],实时荧光定量PCR仪[伯乐生命医学产品(上海)有限公司],Illumin™ miseq测序仪,正置光学显微镜[尼康仪器(上海)有限公司]。
1.2 抗生素投用方法
两组小鼠自出生开始分别投用混合抗生素和灭菌水直至处死,共21d。混合抗生素由氨苄西林(100mg/kg)+新霉素(100mg/kg)+杆菌肽(100mg/kg)+万古霉素(50mg/kg)+亚胺培南/西司他丁钠(50mg/kg)+两性霉素B(1mg/kg)组成,溶于无菌水中。小鼠每日投用液体体积:出生10d内为10μL,出生10~21d为100μL。对照组每日投用相同体积灭菌水。绝对剂量根据小鼠体重和混合抗生素组合方案计算得到。为保证药效,抗生素溶液均现配现用。
因出生10d内小鼠胃容量较小,故使用10μL移液器将液体缓慢注入小鼠口咽部,观察未反流则为灌胃成功;出生10d后则使用灌胃针投用液体。
1.3 取材
处死前称重、眼球采血,室温静置2 h,2000×g,离心15min,血清保存于-80℃备用。颈椎脱臼处死小鼠,冰上操作取出海马及前额皮质,保存于-80℃备用。收集小鼠脾、肾上腺、胸腺并称重。收集小肠,结肠组织,浸泡于10%中性福尔马林溶液中进行后续病理检测。收集结肠内容物保存于-80℃备用。
1.4 血清中细胞因子及皮质酮检测
采用ELISA法检测白介素-6(Interleukin-6,IL-6),肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和皮质酮,严格按照R&D小鼠ELISA试剂盒说明书操作。
1.5 脑部功能基因mRNA表达水平检测
采用RT-PCR检测海马和前额皮质中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF),γ-氨基丁酸A型受体α1亚型(γ-aminobutyric acid type A receptor α1,GABAAα1),γ-氨基丁酸B型受体1亚型((γ-aminobutyric acid type B receptor 1,GABAb1),神经生长因子(nerve growth factor,NGF)和5-羟色胺受体1A(5-hydroxytryptamine receptor 1A,5-HT1A)mRNA表达水平采用GENEOUT™TRIzol总RNA提取试剂盒说明书提取小鼠海马和前额皮质总RNA,iScript™gDNA Clear cDNA Synthesis Kit进行逆转录。
以β-actin作为内参基因,各目的基因引物序列见表1,引物均由生工生物工程(上海)股份有限公司合成。反应体系为SsoFast EvaGreen supermix 5μL,正向引物0.3μL,反向引物0.3μL,RNase/DNase-free H2O 3.4μL,cDNA 1μL。反应条件为95℃ 30s;95℃ 5s,Tm℃ 5s,共40个循环;读取65~95℃的溶解曲线。使用2-△△Ct相对定量法计算目的基因的相对表达量。
1.6 病理学观察
将肠道组织从固定液中取出,脱水、包埋、切片,HE染色。每组内每张切片随机挑选至少3个100倍视野进行拍照,应用Image-Pro Plus 6.0软件以100倍标尺为标准,每张切片选取5根完整的绒毛,分别测量小肠的绒毛长度和隐窝深度,结肠的隐窝深度。
1.7 肠道菌群分析
严格按照TIANamp Stool DNA Kit试剂盒说明书提取粪便样品中的DNA。
对DNA的16S rDNA V3-V4区进行PCR扩增。扩增引物为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTA AT-3')。反应体系为Phusion®Hot Start Flex 2X Master Mix12.5μL,Forward Primer 2.5μL,Reverse Primer 2.5μL,DNA模板50ng,ddH2O补充至25μL。扩增程序为98℃ 30s;98℃ 10s,54℃ 30s,72℃ 45s,35个循环;72℃ 10min。

表1 Real time-PCR引物Tab.1 Real time-PCR primers
PCR产物经AMPure XT磁珠纯化后,用Qubit试剂盒定量。Agilent 2100生物芯片分析系统检测扩增文库大小,用Library Quantification Kit for Illumina试剂盒定量文库。Illumina PhiX Control v3文库与扩增文库按30%比例混合后上机测序(MiSeq PE300)。采用Qiime(v1.9.1)对序列进行进一步分析,对优质序列按照97%的相似度聚类得到操作分类单元(OUT),并与Greengene数据库比对生成OTU表。用PyNAST(v0.1)软件对代表性序列进行比对,用FastTree(v2.1.7)构建进化树。基于OTU和物种注释结果,与Greengene数据库比较后得到结果。
1.8 统计学分析
使用SPSS 22.0对数据进行统计学分析。数据使用±s表示。如满足正态,方差齐则使用t检验进行比较;如非正态或方差不齐,使用曼-惠特尼U检验。P<0.05差异有统计学意义。
2 结果
2.1 体重及脏器指数
小鼠体重在0~21d内持续增长,但0、7、14和21d两组体重均无统计学差异,见表2。两组小鼠的肾上腺体比和脾体比均无统计学差异,抗生素组胸腺体比低于对照组(P<0.05),见表3。
2.2 血清中细胞因子及皮质酮
抗生素组小鼠血清IL-6水平高于对照组(P<0.05),TNF-α水平差异无统计学意义,皮质酮水平低于对照组(P<0.05),见表4。

表2 小鼠体重变化情况Tab.2 Changes in body weight of mice
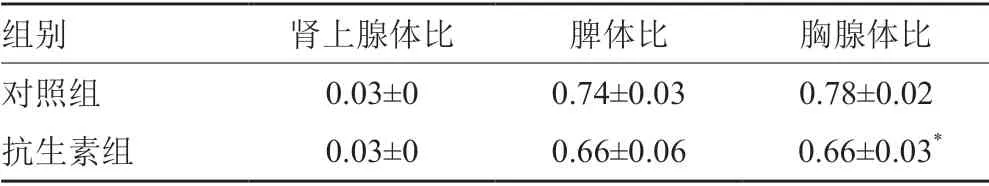
表3 小鼠脏器指数变化情况Tab.3 Changes of organ index
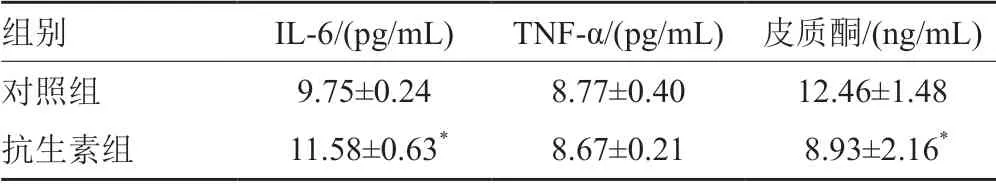
表4 小鼠血清细胞因子及皮质酮变化情况Tab.4 Changes of serum cytokines and corticosterone
2.3 小肠和结肠病理观察
两组小肠绒毛长度和隐窝深度均无统计学差异,抗生素组结肠隐窝深度低于对照组(P<0.05)(表5)。
2.4 脑部神经化学物质mRNA表达情况
2.4.1 海马
抗生素组GABAAα1高于对照组(P<0.05)。两组BDNF、GABAb1、NGF和5-HT1A均无统计学差异。但抗生素组BDNF、GABAb1和NGF均有上升趋势,而5-HT1A有下降趋势(表6)。
2.4.2 前额皮质
抗生素组与对照组相比,BDNF、GABAAα1、GABAb1和NGF虽无统计学差异但均有上升趋势(表7)。
2.5 肠道菌群分析
2.5.1 Alpha多样性检测
本研究中ACE和Chao1均无统计学差异,说明两组群落丰富度无差异。抗生素组Shannon和Simpson低于对照组(P<0.01,P<0.05),说明抗生素组的群落多样性低于对照组。PD whole tree无统计学差异,说明在考虑种群进化的基础上生物群落的多样性无差异(表8)。
2.5.2 菌群相对丰度比较
相较于对照组,抗生素组在门水平和属水平上的菌群丰度都显著减少。同时粪便菌群的构成也出现明显差异。在抗生素组,正常粪便菌群中常见的拟杆菌门和后壁菌门比例显著降低,而变形菌门比例显著增高,见图1。同时奈瑟菌属,颗粒链菌属和欧文菌属等机会致病菌比例显著增多,见图2。
门水平上,与对照组相比抗生素组变形菌门显著增高(P<0.001),拟杆菌门和厚壁菌门降低(P<0.05)。属水平上,抗生素组副杆菌属显著降低(P<0.001),奈瑟菌属显著增高(P<0.01)。此外,颗粒链菌属,欧文菌属,梭杆菌属,链球菌属和克雷伯菌属均出现增高(P<0.05),肠道菌群平均相对丰度比较结果见表9~10。
3 讨论
3.1 生命早期使用抗生素对于机体免疫及内分泌功能的影响
生命早期个体处于生长发育的第一高峰时期,该阶段的生理代谢异常会对个体健康产生深远的影响。已有研究表明生命早期使用抗生素会对个体健康产生持续影响,同时指出肠道菌群改变是两者产生联系的关键环节[7-8]。但早期使用抗生素对机体的免疫及内分泌功能影响的研究还少有报告。
胸腺是重要的免疫器官,通过胸腺体比可以初步了解机体免疫系统发育情况。本研究中,抗生素组的受试小鼠胸腺体比明显低于对照组,且与对照组相比抗生素组的IL-6升高。提示生命早期使用抗生素有可能影响机体免疫系统正常发育,引起机体异常的炎症反应。

表6 小鼠海马神经化学物质mRNA表达情况 Tab.6 Expression of neurochemical mRNA in hippocampus

表7 小鼠前额皮质神经化学物质mRNA表达情况Tab.7 Expression of neurochemical mRNA in prefrontal cortex

表8 小鼠肠道菌群的Alpha多样性Tab.8 Alpha diversity of intestinal flora

图1 门水平小鼠粪便菌群构成图Fig.1 The structure of intestinal flora at phylum level
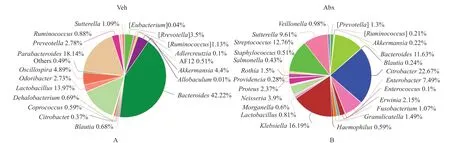
图2 属水平小鼠粪便菌群构成Fig.2 the structure of intestinal flora at genus level

表9 门水平不同菌群的平均相对丰度Tab.9 Mean relative abundance of different taxa at phylum level
皮质酮是一种重要的肾上腺皮质激素,具有多种生理代谢调节作用,皮质酮的改变将通过HPA轴对脑部功能产生一定的影响,本研究发现抗生素组受试小鼠血清中的皮质酮显著低于对照组。提示生命早期使用抗生素还可能会引起机体皮质酮减少等内分泌功能的失调或者紊乱。

表10 属水平不同菌群的平均相对丰度Tab.10 Mean relative abundance of different taxa at genus level
3.2 生命早期使用抗生素对肠道上皮组织形态的影响
肠道作为消化系统的重要组成部分,具有吸收、代谢以及内分泌等功能,与机体的健康有着密切联系。抗生素组小鼠结肠隐窝深度变浅,说明抗生素对小鼠的肠道结构有一定的损伤作用。有研究表明使用抗生素可能会增加小鼠患结肠炎的风险[9],而结肠隐窝变浅可能是其早期病理改变。
3.3 生命早期使用抗生素对肠道菌群及脑部功能基因表达的影响
肠道菌群对机体的免疫、内分泌、代谢等多种功能具有调节作用。近年也有研究指出肠道菌群可以调节脑部功能,肠道菌群紊乱与某些脑部功能的异常改变有关[3,10-11]。但是肠道菌群与脑部功能的特异关系及作用机理仍有待更深入地研究。
本次研究中,联合使用多种抗生素诱导小鼠肠道菌群发生紊乱。选择抗生素主要有两方面考虑:一方面,本研究关注肠道菌群与脑部功能基因之间的关系,故选择肠道吸收较差的抗生素,使抗生素的作用尽量局限在肠道而对肠外组织无直接作用;另一方面,由于本实验是初步性探索,希望不仅能引起优势菌群的改变,也能同时能作用于非优势的微小菌群,以尽可能诱导肠道菌群在种群结构上发生质和量的紊乱。综上,在结合文献报道[12-15]以及相应抗生素的抗菌谱后确定了包括对革兰阳性菌和革兰阴性菌作用在内的6种抗生素种类与其作用剂量。在后续研究中,将逐步减少抗生素种类,以探索菌群种属与脑部功能基因表达改变之间更加详细的特异关系。
本次研究发现,使用抗生素后两组的肠道菌群在门水平和属水平上均有明显差异。相较于对照组,抗生素组变形菌门显著增多,而拟杆菌门和厚壁菌门显著减少;抗生素组副杆菌属显著降低,而致病菌奈瑟菌属,颗粒链菌属,欧文菌属等均显著增高。提示生命早期使用抗生素可导致肠道菌群紊乱,以及变形菌为代表的有害致病菌比例增高。
目前,有研究表明肠道菌群与脑部认知功能之间存着双向信息交流[16]。本次研究发现,与脑部认知记忆有关的海马区以及前额皮质中的部分神经化学物质分泌异常。GABA作为一种抑制性神经递质,其具有调节紧张、焦虑行为以及心血管功能的作用。有研究表明肠道菌群中的短乳酸杆菌和齿双歧杆菌能够产生GABA[17]。抗生素组海马的GABAAα1mRNA表达明显增加,GABAb1mRNA在海马和前额皮质也均呈上升趋势。其他神经化学物质也都表现出了各自不同的变化趋势。同时发现不同脑部区域的同一种神经化学物质变化情况并不完全一致。提示肠道菌群紊乱可导致神经化学物质的异常分泌,这种异常改变可能与脑功能的分区有一定的联系。
综上所述,本研究发现在小鼠生命早期使用抗生素能够造成肠道菌群紊乱、免疫功能的改变,破坏小鼠正常肠道结构。同时,抗生素引起的肠道菌群紊乱导致海马与前额皮质中部分神经化学物质的异常分泌,提示生命早期使用抗生素引起肠道菌群紊乱可能导致小鼠脑部功能发生异常改变。生命早期使用抗生素引起机体的异常改变均可能与肠道菌群对脑部功能产生影响的机制密切相关,但具体机制还需在今后进行更深入地研究。该实验为进一步研究肠道菌群与脑部功能间的关系奠定了基础。
