受体相互作用蛋白1、3在直肠癌中的表达及临床意义*
2019-09-02邓文宏邱振东项明伟何小波王卫星
邓文宏 易 斌 邱振东 项明伟 何小波 王卫星
我国是结直肠癌高发国家,其发病率占我国恶性肿瘤第五位[1],其中直肠癌占比可达70%[2]。尽管目前对直肠癌已展开多个层面的研究,但直肠癌具体的发病机制仍待进一步明确。受体相互作用蛋白(Receptor Interacting Protein,RIP)是细胞增殖、死亡和机体固有免疫等过程的关键调节因子。目前有研究表明,RIP与乳腺癌、黑色素瘤等多种肿瘤的发生、发展相关,在多个肿瘤组织中均存在表达异常[3,4],但是RIP与直肠癌的关系尚不十分明确。本研究检测分析RIP1、RIP3在直肠癌组织中的表达情况,并初步评估其临床意义。
1 资料与方法
1.1 研究对象和分组
随机收集武汉大学人民医院普外科2015-01—2017-01间行直肠癌根治性切除术、病理检查证实为直肠癌且病理及临床资料齐备的患者40例,手术切除标本后取少许病灶中心组织(直肠癌组),所有病例术前均未接受放疗或化疗,其中男29例、女11例,中位年龄54岁(45-76岁)。肿瘤的原发灶大小、浸润深度、淋巴结转移及远处转移情况由患者病理学检查结果及临床资料确定,根据2017年NCCN制定的TNM分期标准进行临床分期。TNM分期Ⅰ-Ⅱ期18例,Ⅲ-Ⅳ期 22例;发生淋巴结转移22例,未发生淋巴结转移18例;组织分化程度:高、中分化24例,低、未分化16例;肿瘤直径≥5cm 14例,<5cm 26例;脉管侵犯9例;神经侵犯11例。另取手术切除非直肠癌患者正常黏膜20例作为对照组,其中男13例,女7例,中位年龄53岁(42-64岁)。 两组性别、年龄比较差异无统计学意义(P>0.05)。
1.2 主要试剂
兔抗人RIP1、RIP3多克隆抗体购自Abcom公司(批号:ab72139、ab56164),鼠抗兔二抗购自武汉博士德生物技术公司(批号:BA1058),SP免疫组化试剂盒和DAB显色试剂盒购自Sigma公司(批号:D4418)。
1.3 组织样本处理以及RIPI和RIP3蛋白测定
切除的新鲜直肠癌标本立即予以4%中性甲醛固定,行石蜡包埋备用,其余大体标本立即置10%福尔马林固定送入病理科,常规石蜡包埋、切片、HE染色,由病理学专业医师行病理学诊断。石蜡包埋样本予以连续切片,每张切片厚约4μm,使用免疫组化SP法检测,常规脱蜡,温箱抗原修复,3%的H2O2复灭活内源性蛋白酶10min,然后依次滴加一抗(1∶200稀释)、二抗(1∶500稀释)、链霉素抗生物素蛋白-过氧化物酶液,DAB显色,苏木精复染,脱水,透明,中性树胶封片,于光学显微镜下观察,PBS代替一抗作阴性对照。
1.4 结果判定
1.4.1定性结果:组织切片用高倍镜(×400) 检测,以胞浆或胞膜出现棕黄色颗粒为阳性细胞。按染色强度计分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。在镜下对每张切片随机选取5个高倍镜视野,每个视野100个细胞,共500个,按阳性细胞所占百分比计分:阴性为0分,阳性细胞<10%为1分,阳性细胞10%-50%为2分,阳性细胞>50%为3分。染色强度计分与阳性细胞百分比计分之和≥4分为免疫组化阳性,否则记免疫组化阴性。
1.4.2定量结果:运用ImagePro Plus 6.0软件对免疫组化后图片进行分析,测量平均光密度值,其值越大,蛋白表达越多。
1.5 统计学处理
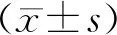
2 结 果
2.1 直肠癌组织及正常组织中RIP1和RIP3的表达情况
RIP1在癌组织及正常组织均表达,RIP1存在于胞质及胞膜中,在间质不表达,为不均匀的棕黄色颗粒,呈无规律的散在分布。在癌组织中的表达弱于正常组织;RIP3阳性染色无规律地散在分布于胞质、胞核及胞膜中,在间质中也有表达,其在癌组织中的表达低于正常组织。典型的表达情况如图1、2所示。在直肠癌组织中,RIP1的阳性表达率为65.00%(26/40), RIP3阳性表达率为60.00%(24/40),而在正常组织中RIP1的阳性表达率为70.00% (14/20),RIP3阳性表达率为60.00%(12/20),直肠癌组织与正常组织RIP1、RIP3的阳性表达率均无统计学差异(χ2=0.228、0.053,P>0.05)。

图1 RIP1在直肠癌组织及正常组织中的表达(SP,×400)
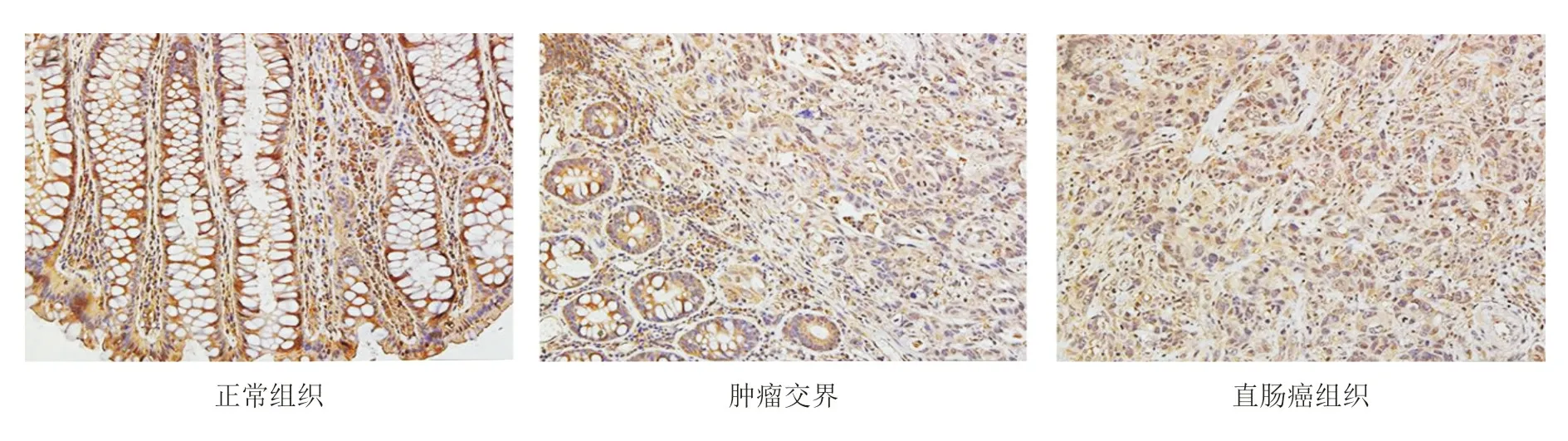
图2 RIP3在直肠癌组织及正常组织中的表达(SP,×400)
2.2 RIP1、RIP3在直肠癌中的表达与临床病理参数的关系
低+未分化、Ⅲ-Ⅳ期、有淋巴结转移、脉管侵犯及神经侵犯的直肠癌患者癌组织RIP1和RIP3的阳性表达率高于高+中分化、Ⅰ-Ⅱ期、无淋巴结转移、无脉管侵犯及无神经侵犯患者(P<0.05), RIP1和RIP3阳性表达率在不同大小肿瘤中差异无统计学意义(P>0.05),见表1。
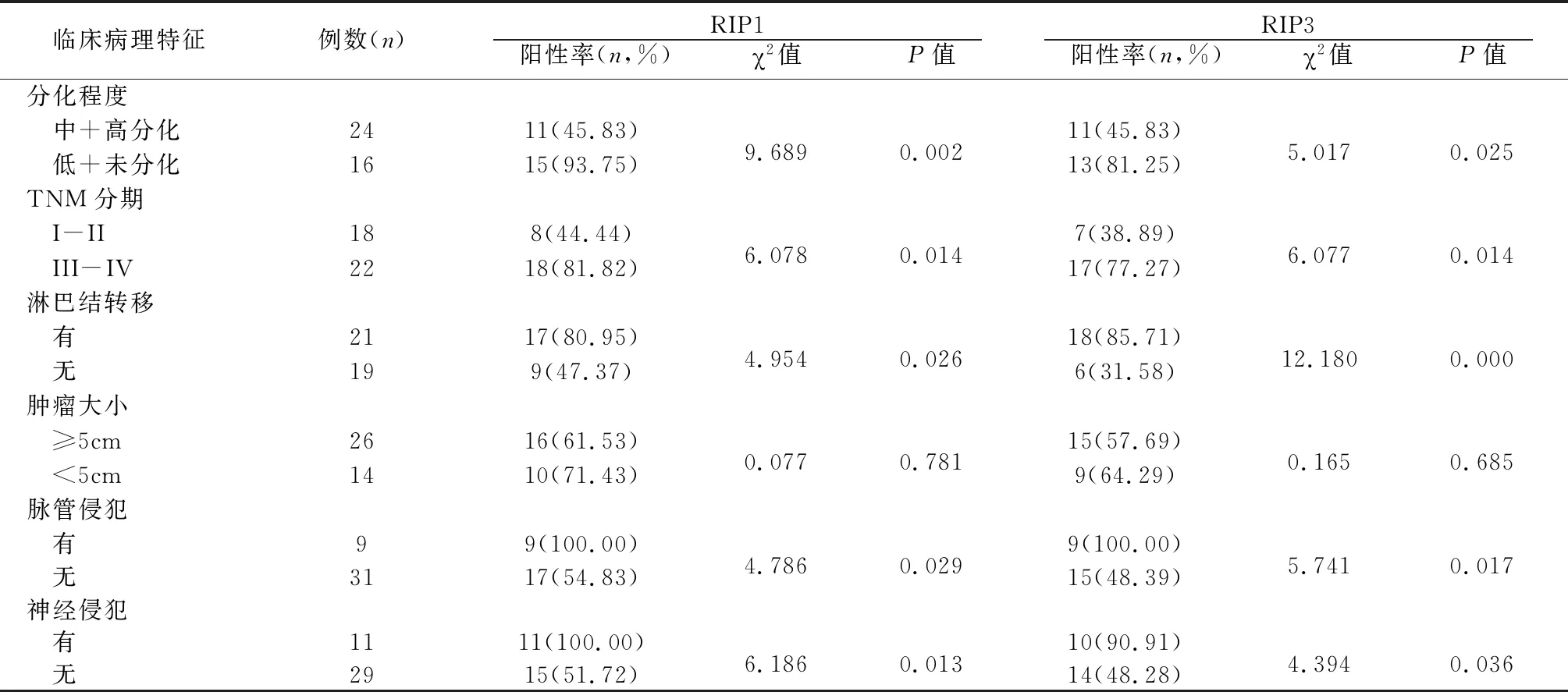
表1 直肠癌组织中RIP1和RIP3表达与临床病理指标的关系
2.3 RIP1、RIP3在直肠癌组织和正常组织中表达量的比较
RIP1在直肠癌组织中的平均光密度值为0.211±0.282,低于正常组织中的平均光密度值(0.324±0.062),差异有统计学意义(t=4.586,P<0.05)。RIP3在直肠癌组织中的平均光密度值为0.197±0.039,亦低于正常组织中的平均光密度值(0.288±0.042),差异有统计学意义(t=5.458,P<0.05)。
3 讨 论
正常细胞可以通过多种机制介导死亡,包括程序性坏死。细胞表面死亡受体(Fas)、肿瘤坏死因子受体(TNFR)、肿瘤坏死因子相关调亡诱导配体(TRAIL)及I、II型干扰素(IFN)在内的死亡受体激活后,信号通路下游形成RIP1和RIP3等蛋白构成的坏死复合体,进而诱导细胞凋亡、坏死或细胞增殖。RIP1和RIP3均具有丝氨酸/苏氨酸激酶活性,具有很强的同源性,可通过与各自分子内的同型相互作用基序(RIP Homotypic Interaction Motif, RHIM)结构域相结合,形成β-淀粉样的丝状结构,进而相互磷酸化并参与坏死性凋亡、凋亡或NF-κB的激活[5]。
在血液恶性肿瘤和实体瘤的研究中已经证实了坏死性通路在癌症生物学中的重要性。癌细胞类型和肿瘤微环境不同,程序性坏死对肿瘤进展也会具有不同的影响。在部分急性髓性白血病的亚型中,RIP3的表达减少。一项临床前研究显示,RIP3可促进转化后祖细胞的死亡,死亡细胞释放IL-1β,激活炎性小体,进而促进白血病起始细胞的分化,最终抑制急性髓性白血病中的恶性骨髓增生[6]。慢性胰腺炎是胰腺癌发展的最普遍的危险因素,肿瘤发生总是伴随着胰周炎性改变[7]。在人和小鼠胰腺癌细胞中,RIP1和RIP3表达均上调,在体外,阻断坏死小体可促进癌细胞增殖并诱导侵袭性致癌表型,相反,小鼠体内RIP3缺失或RIP1受抑制则可防止肿瘤进展[8],提示胰腺癌的进展受肿瘤细胞自身和RIP1/RIP3相关的炎性环境影响[9]。此外,在黑色素瘤中RIP1表达通过NF-κB依赖性途径促进肿瘤细胞增殖[10]。
本研究显示, RIP1在直肠癌组织中呈低表达,其表达情况与患者的性别、年龄无关,与其临床分期、病理分级、淋巴结转移等有关,而RIP3在直肠癌组织中呈低表达,其表达情况与患者的性别、年龄无关,与其临床分期、病理分级、淋巴结转移等有关,提示RIP1/RIP3在直肠癌的发展过程中发挥了一定作用。鉴于RIP1广泛参与了细胞的存活、死亡及炎症反应过程[11],RIP1/RIP3在直肠癌组织中的低表达可能有利于肿瘤的生长及逃避机体的免疫监控。RIP1/RIP3的表达情况可能是判断直肠癌患者预后的一个潜在参考指标。
在本研究中,RIP1/RIP3在直肠正常组织腺泡中的表达高于癌组织,但RIP1在间质中无明显表达, RIP3在组织间质中存在表达,并见于间质的淋巴细胞中,与RIP1形成明显对比,提示RIP3与直肠癌的免疫反应可能有关。其原因可能是正常组织中的RIP1和RIP3具有引起细胞程序性坏死的功能,而肿瘤细胞具有无限增殖的特性,会抑制RIP分子的表达。研究显示,在胰腺癌中,程序性坏死通过CXC趋化因子配体1(Chemokine Ligand-1,CXCL1)的表达与免疫抑制和肿瘤发生相关。RIP3缺失可导致先天性和适应性炎性介质的免疫原性重编程,如肿瘤内CD8+T细胞和Th1极化CD4+T细胞的增加,以及骨髓衍生抑制细胞(Myeloid Derived Suppressor Cells, MDSC)和肿瘤相关巨噬细胞的减少。此外,在RIP3缺失的情况下,抑制性巨噬细胞(促进肿瘤发生)失去其免疫抑制效应,转而产生具有强大抗肿瘤特性的免疫原性T细胞[8]。
综上所述,RIP1和RIP3蛋白在直肠癌组织中均低表达,但RIP1/RIP3如何参与直肠癌的发生发展及其对免疫反应的影响的具体机制仍需要进一步的研究。
