沉默信息调节因子1对缺氧心肌细胞凋亡和自噬的影响
2019-09-02沈丹凤刘克坚
沈丹凤 刘克坚 王 燕 蒋 华
心肌缺血是心血管系统疾病发生的常见的重要原因,心肌持续缺氧缺血导致心肌坏死、心脏衰竭等是影响人类生活质量的关键[1]。缺氧能够诱导心肌细胞凋亡,而过量的心肌细胞凋亡导致心肌组织损伤,进而引起的心肌功能障碍,是心肌缺血损伤发生的机制之一[2]。细胞自噬被认为是机体自我保护的一种方式,其在缺氧缺血程度较轻时可以通过降解功能异常的细胞器维持正常的细胞活动,长时间的缺氧能够降低心肌细胞自噬水平,促进细胞损伤[3,4]。沉默信息调节因子1(Silence Information Regulator 1,Sirt1)是一个与细胞程序性死亡有关的蛋白酶,其可以调控细胞的新陈代谢、生长、凋亡及自噬。有研究发现在动脉粥样硬化、神经系统疾病等过程中Sirt1表达下调,并且具有诱导细胞自噬和减少细胞凋亡的作用[5,6]。目前关于Sirt1在缺氧条件下对心肌细胞凋亡和自噬中的作用尚不明确,本研究以心肌H9c2细胞为对象,通过细胞转染调节Sirt1表达水平,评估Sirt1对缺氧心肌细胞自噬和凋亡的作用,为研究Sirt1在心肌缺血损伤中的作用提供参考资料。
1 材料与方法
1.1 细胞、试剂和仪器
心肌H9c2细胞购自上海斯信生物科技有限公司;Sirt1真核表达载体(pIRES2-EGFP-Sirt1)由汉恒生物科技(上海)有限公司构建;ab2302 Cleaved Caspase-3抗体、ab32503 Bax抗体、ab207612 Beclin-1抗体购自美国Abcam公司;14600-1-AP LC3抗体购自美国Proteintech Group;MA0220 Annexin V-FITC/PI细胞凋亡检测试剂盒购自大连美仑生物技术有限公司;M2128 MTT购自美国Sigma公司;6210A反转录试剂盒、RR820A SYBR荧光定量PCR试剂盒均购自大连Takara公司;11668-027 Lipfectamine 2000购自美国invitrogen公司;SPECTRAMAX 340PC384酶标仪购自美国Molecular Devices公司;FACSCalibur流式细胞仪购自美国BD公司。
1.2 H9c2细胞分组及处理
H9c2细胞于实验前12h,用不含血清的细胞培养液同步化处理后种植到6孔板中,每孔中添加106个细胞(用于细胞存活率检测时每孔细胞密度为5×104/ml),置于94% N2、1%O2和5%CO2培养箱中缺氧处理24h,记为Hypoxia组。H9c2细胞在5%CO2的培养箱中培养记为Control组,每组设3个复孔。常规培养的H9c2细胞,其密度为80%时用Lipfectamine 2000进行细胞转染,细胞转染步骤同转染试剂说明书。将转染pIRES2-EGFP-Sirt1和阴性对照24h后的细胞用荧光显微镜观察荧光表达情况,以800μg/ml G418筛选阳性克隆。转染pIRES2-EGFP-Sirt1和阴性对照后的细胞经过上述缺氧处理24h后分别记为Sirt1+Hypoxia组和NC+Hypoxia组,每组设3个复孔。用qRT-PCR和Western blot检测Hypoxia、Sirt1+Hypoxia、NC+Hypoxia组细胞中Sirt1 mRNA和蛋白表达变化。
1.3 qRT-PCR检测Sirt1 mRNA水平
取出细胞,在细胞中添加Trizol溶液,置于冰上反复吹打,按照Trizol说明书提取细胞总RNA,根据A260/A280的比值确定RNA的纯度。用反转录试剂盒进行进行cDNA合成。根据SYBR荧光定量PCR试剂盒进行扩增,内参设置为GAPDH。收集荧光信号,采用2-△△Ct法计算Sirt1 mRNA的相对表达水平。GAPDH forward 5’-CCA CCC ATG GCA AAT TCC-3’,reverse 5’-TGG GAT TTC CAT TGA TGA CAA G-3’; Sirt1 forward 5’-TAG GCG GCT TGA TGG TAA T-3’,reverse 5’-ATG GGT TCT TCT AAA CTT GGA CT-3’。
1.4 Western blot检测Sirt1蛋白水平
取出细胞,用蛋白提取试剂提取细胞中的总蛋白,采用BCA法定量。分别配制10%的分离胶和5%的浓缩胶,在每个上样孔中添加40μg的蛋白样品。在浓缩胶中使用80V的电压电泳,在分离胶中使用120V的电压电泳。2h后,观察蛋白进入到电泳槽的底部以后,取出凝胶。取大小合适的PVDF膜,设置160mA恒流转膜60min。将PVDF膜置于TBST溶液中,摇床孵育2h。按照1∶400配制Sirt1抗体孵育液,将PVDF膜置于其中在4℃过夜后,转移到二抗反应液中,二抗以1∶4 000稀释,GAPDH为内参照。经ECL化学发光以后,在凝胶成像仪中拍照曝光。用Image J软件分析蛋白条带灰度值,计算蛋白表达量。Sirt1蛋白相对表达水平=Sirt1蛋白灰度值÷GAPDH蛋白灰度值。
1.5 MTT检测心肌细胞存活率
在分组处理24h的各组细胞中每孔添加20μl MTT溶液,孵育4h以后,倒掉孔内液体,添加150μl二甲基亚砜溶液,再孵育10min后,测定470nm波长处每孔的A值,经过不含细胞的孔调零以后,常规方法分析细胞存活率变化。各组细胞存活率为该组细胞A值与Control组细胞A值的比值×100%。
1.6 流式细胞术检测心肌细胞凋亡率
用Annexin V-FITC/PI试剂盒流式细胞术测定细胞凋亡,取Control、Hypoxia、NC+Hypoxia和Sirt1+Hypoxia组细胞,用预冷的PBS洗涤2次,再用结合缓冲液将细胞悬浮,添加Annexin V-FITC和PI染液混合孵育15min,用流式细胞仪检测细胞总凋亡率。
1.7 Western blot检测心肌细胞中Bax、Cleaved Caspase-3、LC3、Beclin-1蛋白水平
Bax、Cleaved Caspase-3、LC3、Beclin-1抗体分别以1∶400、 1∶200、 1∶400、 1∶600稀释。其余操作步骤同1.4。目标蛋白相对表达水平=目标蛋白灰度值÷GAPDH蛋白灰度值。
1.8 统计学处理
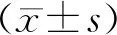
2 结 果
2.1 Sirt1真核表达载体对缺氧条件下心肌细胞中Sirt1表达影响
各组心肌细胞Sirt1 mRNA和蛋白表达水平差异均有统计学意义(P<0.01)。Hypoxia组心肌细胞中Sirt1 mRNA和蛋白表达水平均低于Control组(t=8.323、4.359,P<0.05)。Sirt1+Hypoxia组心肌细胞中Sirt1 mRNA和蛋白表达水平明显高于NC+Hypoxia组(t=7.657、5.277,P<0.05)。见图1和表1。

表1 各组心肌细胞中Sirt1 mRNA和蛋白水平比较均=3)
注:与Control组比较,1)P<0.05;与NC+Hypoxia组比较,2)P<0.05
2.2 过表达Sirt1提高缺氧条件下心肌细胞存活率
各组心肌细胞存活率差异有统计学意义(P<0.01)。Hypoxia组心肌细胞存活率低于Control组(t=6.126,P<0.05)。Sirt1+Hypoxia组心肌细胞存活率高于NC+Hypoxia组(t=3.449,P<0.05)。见表2。

表2 各组心肌细胞存活率和凋亡率比较均=3)
注:与Control组比较,1)P<0.05;与NC+Hypoxia组比较,2)P<0.05
2.3 过表达Sirt1抑制缺氧条件下心肌细胞凋亡率
各组心肌细胞凋亡率差异有统计学意义(P<0.01)。Hypoxia组心肌细胞凋亡率高于Control组(t=15.925,P<0.05)。Sirt1+Hypoxia组心肌细胞凋亡率低于NC+Hypoxia组(t=5.617,P<0.05)。见图2和表2。
2.4 过表达Sirt1减少缺氧条件下心肌细胞中Bax、Cleaved Caspase-3、LC3-Ⅱ/Ⅰ、Beclin-1蛋白水平
各组心肌细胞Bax、Cleaved Caspase-3、LC3-Ⅱ/Ⅰ和Beclin-1蛋白水平差异有统计学意义(P<0.01)。Hypoxia组心肌细胞中Bax、Cleaved Caspase-3蛋白表达水平高于Control组(t=11.385、5.025,P<0.05)。Sirt1+Hypoxia组心肌细胞中Bax、Cleaved Caspase-3蛋白表达水平低于NC+Hypoxia组(t=5.481、1.954,P<0.05)。Hypoxia组心肌细胞中LC3-Ⅱ/Ⅰ、Beclin-1水平低于Control组(t=8.221、8.726,P<0.05)。Sirt1+Hypoxia组心肌细胞中LC3-Ⅱ/Ⅰ、Beclin-1水平高于NC+Hypoxia组(t=5.265、5.410,P<0.05)。见图3和表3。

图2 流式细胞术检测心肌细胞凋亡变化
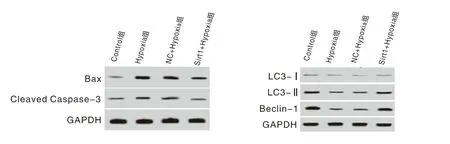
图3 Western blot检测各组心肌细胞中Bax、Cleaved Caspase-3、LC3-Ⅱ/Ⅰ和Beclin-1蛋白水平

组 别BaxCleavedCaspase-3LC3-Ⅱ/ⅠBeclin-1Control组0.15±0.060.22±0.034.25±0.360.89±0.10Hypoxia组0.69±0.071)0.40±0.041)2.47±0.201)0.39±0.051)NC+Hypoxia组0.68±0.050.39±0.062.51±0.260.40±0.06Sirt1+Hypoxia组0.42±0.052)0.32±0.042)3.65±0.212)0.71±0.062)F值58.2210.7432.8836.60
注:与Control组比较,1)P<0.05;与NC+Hypoxia组比较,2)P<0.05
3 讨 论
细胞凋亡是细胞特有的生物学特性,参与疾病的发生[7]。细胞凋亡受到细胞内多种蛋白的调控作用,Bcl-2蛋白家族和Caspase蛋白家族是目前发现的与细胞凋亡关系最为密切的调控因子;Bax是Bcl-2蛋白家族成员,可以诱导细胞凋亡发生;Caspase-3是细胞Caspase凋亡反应的执行因子,只有活化后才可以诱导细胞凋亡发生[8-11]。细胞自噬是除细胞凋亡外的细胞程序性死亡方式,是细胞的自我保护方式之一[12-14]。缺氧条件下心肌细胞凋亡和自噬异常是心肌损伤发生的主要原因,LC3和Beclin-1是细胞自噬的标志蛋白[13]。研究表明,长时间的缺氧处理可以诱导心肌细胞自噬水平下降[3,4]。本次实验表明,缺氧处理后心肌细胞活性降低,凋亡率升高,细胞中Bax、Cleaved Caspase-3蛋白水平升高,细胞自噬标志蛋白LC3-Ⅱ/Ⅰ、Beclin-1水平降低,说明缺氧诱导心肌细胞凋亡并减少细胞自噬,成功构建了缺氧心肌细胞损伤模型。
Sirt1被认为是机体自我保护分子,调控细胞凋亡、生长、衰老,Sirt1可以通过调控动物细胞中p53、叉头框转录因子、成肌分化蛋白、组蛋白、核因子κB等的活性发挥作用[15-18]。Sirt1与心血管系统疾病有关,参与心肌肥大、心肌衰老等病理过程[19]。白藜芦醇可以提高心肌细胞自噬程度的同时能够提高Sirt1表达水平,Sirt1可能在缺氧心肌细胞损伤中发挥保护作用[20-22]。本研究发现Sirt1在缺氧心肌细胞中表达下调,而过表达Sirt1减少缺氧心肌细胞凋亡并诱导自噬蛋白LC3-Ⅱ/Ⅰ、Beclin-1的表达,说明Sirt1可抑制缺氧诱导的心肌细胞凋亡并促进自噬,具有抗缺氧心肌细胞损伤的作用,本文结果与上述研究结果相符,证实了Sirt1在缺氧心肌细胞中发挥保护作用。
总之,本实验表明Sirt1在体外缺氧心肌细胞凋亡和自噬中的作用,通过诱导心肌细胞自噬和减少细胞凋亡发挥保护作用,这为研究Sirt1在心肌损伤中的作用提供了依据。目前对于Sirt1在心肌损伤保护中的作用机制尚不明确,在后续实验中会继续探讨。
