真空贴体包装对鲟鱼片冷藏过程中品质变化的影响
2019-08-30张源珊李平兰
刘 义,张源珊,周 幸,田 颖,李平兰,*
(1.北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083;2.北京北水食品工业有限公司,北京 101149)
鲟鱼是一种营养价值、经济价值和科学研究价值较高的中大型淡水鱼[1],目前我国鲟鱼养殖量已占世界鲟鱼养殖总量的80%[2]。鲟鱼肉具有低脂肪、低能量、高蛋白和多不饱和脂肪酸含量丰富的特点[3],但因营养丰富、水分含量高等特点而极易腐[4];因此常需要采用一些贮藏保鲜技术来延长鲟鱼肉贮藏期,从而最大限度地保留肉品营养价值[5]。国内外延长水产品货架期的保鲜技术手段主要包括低温保藏、添加化学和生物活性物质及采用不同包装等[6]。气调包装和真空包装(vacuum packaging,VP)是目前应用较广的肉类保鲜技术[7-8]。
真空贴体包装(vacuum skin packaging,VSP)是VP形式的一种,是在产品上覆盖一层热封的塑料膜,以抽真空产生的负压,将塑料膜紧密贴附在产品上并基本不产生褶皱,实现贴体效果;VSP是针对传统VP和气调包装弊端进行改良的包装方式,具有保鲜、护色、保护食品液相、增加物料展示直观性的特点[9-10]。VSP在保持品质、延长货架期、增加包装美观性等方面具有一定优势。作为一种新型的包装方式,同普通VP相比,VSP可延长肉品贮藏期、减缓微生物生长[11]。Li Xin等[12]通过对比VSP、普通VP和气调包装对牛肉贮藏过程中品质的影响发现,VSP在牛肉贮藏过程中对色泽的稳定性优于普通VP,可与气调包装达到的效果相似。有研究认为因为VSP基本无褶皱,减少了因毛细血管效应导致的牛肉血水析出和汁液损耗,保鲜效果优于传统VP[13]。
目前国内外对VSP的研究较少,尤其是将VSP应用于水产品上的研究基本空白。因此,本研究对生鲜鲟鱼片进行VSP,并以普通VP及托盘包装(tray packaging,TP)对比,探究VSP鲟鱼片在4 ℃冷藏过程中的品质变化规律,为VSP在水产品贮藏上的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活鲟鱼(每尾质量为13~15 kg),购自北京利康万茂养殖有限公司。
平板计数琼脂(plate count agar,PCA) 青岛海博生物技术有限公司;ATP及其关联物标准品、生物胺标准品 美国Sigma公司;三氯乙酸 天津市鑫源化工有限公;乙腈 美国Fisher Science公司;硫代巴比妥酸(thibarbituric acid,TBA)、硼酸、盐酸、高氯酸、丹磺酰氯、丙酮、氢氧化钾 北京化工厂。
1.2 仪器与设备
LSB35L-I型立式压力灭菌锅 江阴滨江医疗设备有限公司;LRH-250型生化培养箱 上海一恒科技有限公司;TY-CJ-2ND型超净工作台 北京亚泰科隆仪器技术公司;UV-1800PC紫外分光光度计 北京博翔兴旺科技有限公司;CR-400型色彩色差计 日本Konica-Minolta公司;Satroris PB-10型pH计 赛多利斯科学仪器公司(北京);CXTH-300型高效液相色谱仪 北京创新通恒科技有限公司;KDY-9830型凯氏定氮仪 北京通润源机电仪器设备公司;FW2000型分散均质机 上海弗鲁克公司;600型VP机 上海盟申机械设备有限公司;R105MF型VSP机 德国Multivac公司。
1.3 方法
1.3.1 鱼肉处理
鲟鱼经击晕、去头、去内脏后取鱼片,用冰水清洗后,以低温无菌水进一步清洗沥干,单片鲟鱼片装入并进行VSP、普通VP、普通TP;然后置于(4±1)℃下保鲜贮藏,每隔3 d取样测定指标,感官不可接受后终止贮藏。
1.3.2 微生物菌落总数
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[14]测定菌落总数,以lg(CFU/g)为单位。
1.3.3 硫代巴比妥酸反应产物值的测定
硫代巴比妥酸反应产物(thibarbituric acid reactive substances,TBARS)值的测定参照Katikou等[15]的方法,取5.00 g样品研碎,加入50 mL 7.5 g/100 mL氯乙酸(含1 g/L乙二胺四乙酸),振荡25 min,离心,取上清液5 mL,加入5 mL 0.02 mol/L的TBA溶液,90 ℃保温30 min,冷却1 h后,离心取上清液加入5 mL氯仿,摇匀,静置分层后,取上清液分别在532 nm和600 nm波长处测定吸光度,同时以7.5 g/mL氯乙酸(含1 g/L乙二胺四乙酸)作空白。采用式(1)计算TBARS值。

式中:m表示样品质量/g。
1.3.4 挥发性盐基氮含量的测定
挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量的测定参照GB/T 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[16]。
1.3.5 生物胺含量的测定
生物胺的提取、衍生和含量测定参考Eerola[17]、Shi Ce[18]等的方法并进行部分修改。分别测定色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺8 种生物胺的含量,各生物胺含量之和为总生物胺含量。液相色谱条件:色谱柱为COSMOSIL 5C18-PAQ(保护柱4.6 mm I.D.×250 mm,5 μm),流动相A为0.1 mol/L乙酸铵,流动相B为乙腈,柱温为30 ℃,进样量为50 μL,检测波长为254 nm。
1.3.6 ATP及其关联物含量与K值的测定
ATP及其关联物含量的测定采用高效液相色谱法,参照Huang Zhan等[19]的方法测定。以上实验均在低温条件下进行,防止温度过高造成ATP等物质的分解。
液相色谱检测条件:色谱柱为COSMOSIL 5C18-PAQ反相色谱柱,流动相为0.05 mol/L Na2HPO4-NaH2PO4缓冲液(pH 6.8),流速1 mL/min,进样量50 μL,检测波长254 nm,柱温25 ℃。测定的ATP关联物包括:肌苷酸(inosine monphosphate,IMP)、ATP、二磷酸腺苷(adenosine diphosphate,ADP)、腺苷酸(adenosine monophosphate,AMP)、次黄嘌呤(hypoxanthine,Hx)、次黄嘌呤腺苷(hypoxanthine ribotide,HxR)。K值计算见公式(2)。
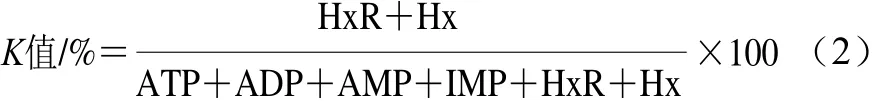
式中:HxR、Hx、ATP、ADP、AMP、IMP分别代表相应物质的含量/(μmol/g)。
1.3.7 pH值的测定
参照GB 5009.237—2016《食品安全国家标准 食品中pH值的测定》[20]测定样品pH值。
1.3.8 感官评价
感官评价参考Hong Hui等[21]的方法并进行适当调整,生鲜鱼片评价指标包括色泽、气味、组织形态和肌肉弹性。评定人员由10 位经过培训的专业人员组成,具体评分标准见表1。
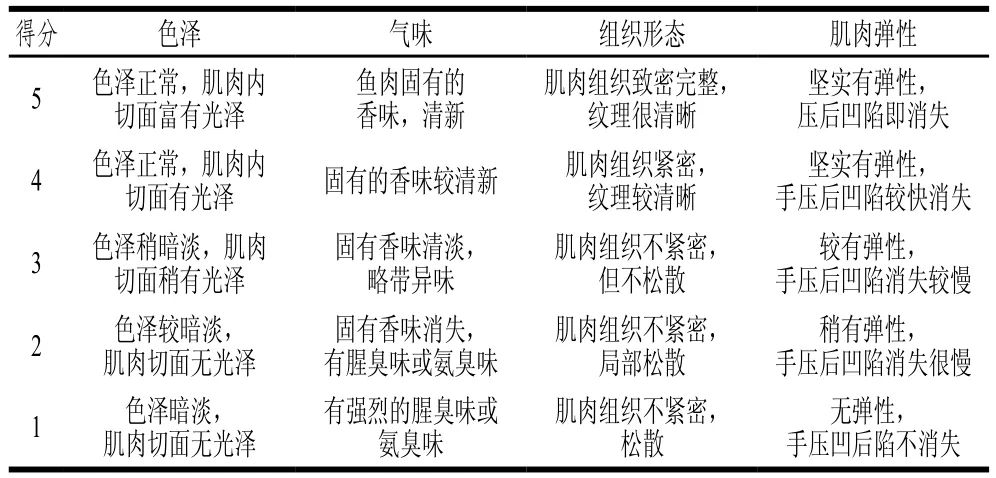
表1 鲟鱼片感官评定评分标准Table 1 Criteria for sensory evaluation of sturgeon fillets
1.3.9 色泽测定
采用CR-400色彩色差计测定色泽,以白板校正,于自然灯光下测定样品的L*(亮度)、a*(红绿度)、b*(黄蓝度)值,每组样品测定6 个平行样品。
1.3.10 质构测定
取鲟鱼背部靠近脊骨位置的鲟鱼肉,将鲟鱼切肉成1.5 cm×1.5 cm×1.0 cm的立方体。采用质构仪测定硬度、弹性、凝聚力、咀嚼性,测试间隔5 s,测试2 次,压缩率30%,选取P35圆柱形探针以1.0 mm/s恒速运动。每组样品测定6 个平行样品。
1.4 数据处理与分析
除特殊说明外,所有实验设置3 个平行,结果以平均值±标准差表示。数据统计分析采用SPSS 20.0软件,采用方差分析进行差异显著性分析,P<0.05表示差异显著。采用Origin Pro 9.1软件作图。
2 结果与分析
2.1 不同包装鲟鱼片贮藏过程中菌落总数的变化
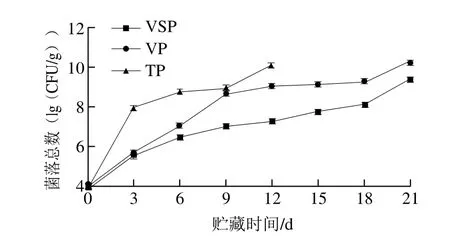
图1 4 ℃贮藏条件下不同包装鲟鱼片菌落总数的变化Fig. 1 Changes in total viable count of sturgeon fillets during storage using different packaging methods at 4 ℃
微生物是引起水产品腐烂变质的主要原因之一[15]。由图1可知,初始菌落总数为3.76(lg(CFU/g)),鲟鱼片初始微生物卫生状况较好(菌落总数低于4.00(lg(CFU/g))时鱼片品质好[22])。各组鲟鱼片菌落总数均随时间延长而增加。
VP组鲟鱼片在第12天的菌落总数为9.09(lg(CFU/g)),与焦维桢等[23]所得数据接近,低于T P组的10.09(lg(CFU/g)),高于VSP组的7.23(lg(CFU/g))。国际食品微生物规范委员会(International Committee on Microbiological Specifications for Foods,ICMSF)规定,消费者对食品中微生物菌落总数的可接受界限值7.00(lg(CFU/g))[24];VSP、VP、TP 3 种包装组鲟鱼片分别在第9、6、3天超过7.00(lg(CFU/g));因此,依据微生物菌落总数,与VP、TP相比,VSP可将鲟鱼片的货架期分别延长3 d和6 d。VSP可减缓微生物生长,可能是由于VSP较普通VP对鱼片的包装更紧密贴合,降低了包装内的残余氧含量,从而减缓了微生物的生长速度,这与Vázquez等[11]的研究结果一致。
2.2 不同包装鲟鱼片贮藏过程中的化学变化
2.2.1 TBARS值与TVB-N含量

表2 4 ℃贮藏条件下不同包装鲟鱼片TBARS值与TVB-N含量的变化Table 2 Changes in TBARS value and TVB-N content of sturgeon fillets during storage using different packaging methods at 4 ℃
鲟鱼贮藏过程中易发生氧化腐败,产生的酮、醛等具有不愉快气味,其中丙二醛可与TBA结合,因此TBARS值可反映脂肪氧化程度[25]。如表2所示,在整个贮藏过程中3 种包装的鲟鱼片TBARS值均呈增长趋势,其中VSP组从12 d后开始显著上升(P<0.05);VSP组鲟鱼片TBARS值低于VP与TP组,可见VSP相对于VP及TP而言,可减缓鲟鱼片脂肪氧化速度。鲜肉的TBARS值超过0.50 mg/kg时开始变质[26],VSP、VP、TP的TBARS值分别在12~15、9~12、6~9 d时超过0.5 mg/kg。
TVB-N是指在肉品贮藏过程中,微生物及相关酶的作用使肉品蛋白质分解产生的含氮物质,如具有挥发性的低级碱性化合物氨、伯胺、仲胺及叔胺[27];TVB-N含量作为衡量肉品鲜度的重要指标,随着贮藏时间延长而增加。如表2所示,TVB-N含量的初始值为7.81 mg/100 g,这与李军等[2]报道的鲟鱼片TVB-N含量初始值一致。12 d时,VSP组与VP组的TVB-N含量分别为9.94、11.36 mg/100 g,显著高于TP组的22.01 mg/100 g(P<0.05)。VSP组与VP组的TVB-N含量在贮藏初期无显著性差异,从第6天开始具有显著性差异(P<0.05)。
2.2.2 生物胺含量
水产品中微生物产生的脱羧酶作用于相应游离氨基酸时会产生生物胺,在食用水产品时,生物胺含量过多会使得人体代谢产生负荷,无法及时将生物胺代谢分解时将会对机体造成毒性[28],生物胺不仅是水产品中常见生物毒素,其含量也是检验鱼肉腐败的重要指标之一[29]。
本研究共测定了8 种生物胺的含量变化,如图2所示,色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺及精胺初始含量分别为4.23、3.07、11.03、7.94、6.61、0、1.78、8.11 mg/kg,随时间延长总生物胺含量明显增加,贮藏末期,TP(12 d)、VP(21 d)、VSP(21 d)组总生物胺分别为178.3、339.46、123.65 mg/kg。贮藏过程中,TP组总生物胺含量由高到低分别为:TP组>VP组>VSP组,可见VSP可以减缓游离生物胺的降解。

图2 4 ℃贮藏条件下不同包装鲟鱼片的生物胺含量变化Fig. 2 Changes in total biogenic amine content of sturgeon fillets during storage using different packaging methods at 4 ℃
贮藏第12天的鲟鱼片与第0天相比,腐胺、组胺、酪胺含量均增加,占总生物胺的比例最大,这一结果与Gui Meng等[30]对VSP鲟鱼生物胺变化规律的研究结果一致,但与包玉龙等[31]得出的可将色胺作为鲫鱼品质变化主要参考指标这一结论不同,可能是不同鱼种生物胺形成变化、养殖贮藏环境、微生物不同等原因所致。有报道指出腐胺的形成与鸟氨酸脱羧酶的活性紧密相关[32],不同包装对腐胺含量的影响较大,可能是因为不同包装环境影响了鸟氨酸脱羧酶活性以及产腐胺微生物的新陈代谢。
2.2.3 ATP及其关联物含量、K值
鱼死后ATP合成受阻并在相关的ATP酶作用下被快速降解,ATP只能在新鲜鱼肉中可检出。IMP是鱼体鲜味物质,随着IMP含量的下降,Hx与HxR的含量上升,从而导致鱼体鲜度的下降,标志着鱼体开始遭受细菌腐败[33]。ATP降解产物HxR、Hx含量之和与ATP关联物总含量的百分比(K值)可反映鱼类鲜度[34]。


图3 4 ℃贮藏条件下不同包装鲟鱼片的K值及ATP关联物质含量的变化Fig. 3 Changes in K value and ATP-related compound content of sturgeon fillets during storage using different packaging methods at 4 ℃
如图3A~D所示,鲟鱼片初始ATP、IMP、Hx含量及K值分别为0.21、2.75、0.35 μmol/g和15.34%。其中ATP含量快速下降,贮藏第3天,VSP、VP与TP组鲟鱼片的ATP含量分别下降至0.04、0.01、0 μmol/g(图3B)。IMP含量在贮藏过程中先上升后下降,与Huang Zhan等[19]的研究结果一致。在贮藏第3天,VSP、VP与TP组的IMP含量上升到4.09、4.15、3.85 μmol/g,各组差异不明显;在9~15 d,3 种包装的IMP含量差异明显,且各组IMP含量从高到低依次为:VSP组>VP组>TP组(图3A)。随着贮藏时间延长,3 种包装的Hx含量增加;VSP组的Hx含量增加最缓慢(图3C),这可能是因为Hx含量受微生物影响较大,而VSP组的菌落总数增长比VP、TP组慢。K值小于20%表示非常新鲜,50%为中度鲜度水平,60%为初期腐败[35];TP、VP、VSP组分别在6、9、15 d到达初期腐败不再新鲜(图3D)。可见,相比于VP及TP,VSP可减缓鲟鱼片IMP含量下降及Hx生成的速度,保持鲜味物质含量,延长货架期。
2.3 VSP鲟鱼片贮藏过程中的物理变化
2.3.1 pH值
由于鱼类自身的水分含量较高,pH值偏中性[36],如图4所示,鲟鱼肉在贮藏过程中的总体pH值在6.1~6.8之间,TP组鲟鱼片在贮藏过程中的pH值先下降后上升,而VSP、VP组呈下降-上升-下降的趋势。VSP、VP、TP组分别在第9、9、3天的pH值下降至6.44、6.28、6.20;鱼肉pH值逐渐下降是由于鱼肉中糖原酵解产生的乳酸、二氧化碳溶于鱼肉组织以及ATP等物质分解产生磷酸等酸性物质所导致[37]。随后pH值上升,是由于随着贮藏时间的延长,鱼肉表面细菌的作用使鱼肉中蛋白质分解,进入自溶腐败阶段产生碱性物质,使鱼肉的pH值逐渐升高[38],而VSP与VP鲟鱼片的pH值在后期又下降,可能是环丝菌等腐败菌利用糖类产生乙酸、乳酸等酸性物质,以及乳酸菌等兼性厌氧菌的生长所致。

图4 4 ℃贮藏条件下不同包装鲟鱼片贮藏过程中的pH值变化情况Fig. 4 Changes in pH of sturgeon fillets during storage using different packaging methods at 4 ℃
2.3.2 感官分析

图5 4 ℃贮藏条件下不同包装鲟鱼片在贮藏过程中的感官得分变化Fig. 5 Sensory scores of sturgeon fillets during storage using different packaging methods at 4 ℃
感官评价在肉品评估中占有重要地位,是判断肉品品质的重要方法[39]。生鲜鲟鱼片评价包括色泽、气味、组织形态和肌肉弹性4 个方面;20 分代表鱼片处于完全新鲜的状态,以9 分作为感官可接受的临界值。如图5所示,3 种包装的鲟鱼片感官得分随贮藏时间延长明显下降,说明鲟鱼片逐渐腐败;VSP、VP和TP组的鲟鱼片分别在12~15、12、3~6 d到达感官评价临界值。
2.3.3 色泽
肉色对于消费者来说是评价肉质好坏的重要指标之一。在4 ℃贮藏条件下不同包装鲟鱼肉的颜色变化如图6所示。各组鲟鱼片在贮藏过程中L*值均呈先上升后降低的趋势,L*值主要与肉表面水分渗出的多少及肉小片化的程度等有关。各组鲟鱼片在贮藏过程中L*值均呈先上升后降低的趋势,初期阶段上升可能是由于鲟鱼肉表面水分渗出,停留在肉表面影响了光的反射,增加了亮度;随着贮藏时间的延长,肉的小片化指数增大,对光的吸收增强,使L*值下降。VSP、VP与TP组鲟鱼片的a*值在0上下波动,可能是由于鲟鱼肉偏白,在贮藏过程中较稳定。各组鲟鱼片b*值总体均呈升高趋势,VSP、VP、TP 3种包装的b*值在贮藏过程中从4.14分别上升至8.49、9.09、8.32。b*值受到pH值与氧化程度的影响,可能原因是蛋白质及脂肪的氧化产生的一些氧化产物影响了光的反射。
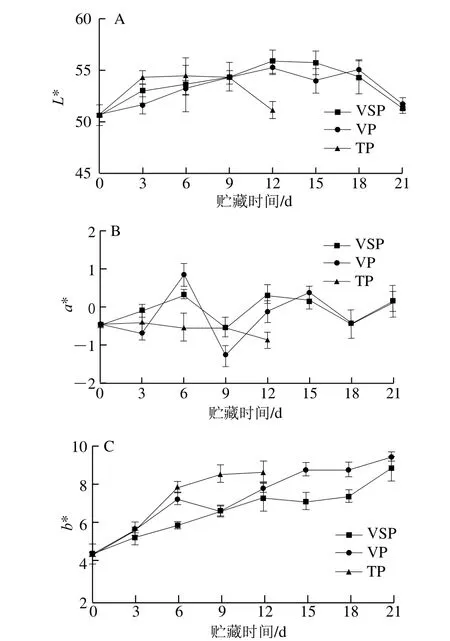
图6 4 ℃贮藏条件下不同包装鲟鱼片在贮藏过程中的L*(A)、a*(B)、b*(C)值变化Fig. 6 Changes in L* (A), a* (B) and b* (C) values of sturgeon fillets during storage using different packaging methods at 4 ℃
2.3.4 质构
质构作为衡量食品组织特性的重要指标之一,同食品的风味、外观以及营养构成了食品的四大品质要素。在质构测试中,硬度是指在第一次压缩时的最大峰值,多数样品的硬度为最大变形处的值。如表3所示,3 种包装的鲟鱼片在贮藏过程中硬度均呈下降趋势,到贮藏末期,VSP、VP、TP的硬度分别下降到新鲜鲟鱼片的41.1%、34.9%、25.4%。弹性可以反映鱼肉在受外力作用变形、去外力后恢复的程度;3 种包装组鲟鱼肉的弹性从0 d的2.97 mm开始逐渐下降。胶着性用于描述半固态食品在一定力的作用下流动性的参数,可作为质地的综合评价参数。3 种包装组的胶着性随贮藏时间延长而显著下降(P<0.05);贮藏初期胶着性为587 g;贮藏末期TP、VP、VSP胶着性分别为186、172、172 g。咀嚼性作为质地综合评价指标之一,可以模拟鱼肉咀嚼成吞咽稳定状态时所需的能量。与贮藏初期相比,贮藏末期VSP、VP、TP组咀嚼性分别下降了77.8%、77.8%、55.0%。可能是随着贮藏时间延长,肌肉蛋白在内源酶及微生物产物作用下,蛋白质降解引起肌肉硬度下降,肌细胞间结合力下降造成肌肉细胞间凝聚力降低,同时引起的鱼肉组织崩解导致肌肉弹性下降[40]。尽管VSP、VP组的咀嚼性、胶着性差别不大,但前者的弹性与硬度更高。因此,从质构分析结果来看,VSP鲟鱼片的品质更好。
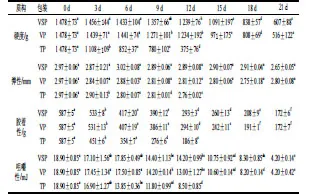
表3 4 ℃贮藏条件下不同包装鲟鱼片贮藏过程中的质构变化Table 3 Changes in texture of sturgeon fillets during storage using different packaging methods at 4 ℃
3 结 论
VSP组鲟鱼片菌落总数在第9天到达可接受界限值7.00(lg(CFU/g)),感官得分、TBARS值在第12~15天之间到达可接受的临界值,而K值则在第15天到达初期腐败。因此通过各指标综合判定出VSP组的鲟鱼片在4 ℃冷藏条件下货架期为9 d,比VP与TP组鲟鱼片货架期分别长3 d与6 d。VSP组鲟鱼片的pH值、L*值、a*值、咀嚼性、胶着性的变化趋势与VP组相同;但VSP可有效抑制TBARS值、TVB-N含量、生物胺含量、Hx含量等反映鱼肉腐败指标的增加速度;还可减缓鲜味物质IMP含量的下降速度。因此,VSP与普通VP、TP对比,可降低蛋白质与脂肪的氧化速度,稳定色泽,减缓微生物造成的腐败,从而达到延长货架期的目的。
