异甘草素抑制α-葡萄糖苷酶的分子机制
2019-08-30韩芬霞范新景娄文娟梁桂兆刘本国
韩芬霞,范新景,耿 升,娄文娟,梁桂兆,刘本国,*
(1.河南科技学院动物科技学院,河南 新乡 453003;2.河南科技学院食品学院,河南 新乡 453003;3.重庆大学生物工程学院,生物流变科学与技术教育部重点实验室,重庆 400044)
α-葡萄糖苷酶(EC 3.2.1.20)又名α-D-葡萄糖苷水解酶,具有水解和转糖苷双重作用,被广泛应用于乙醇发酵、低聚糖生产、淀粉水解、食品成分分析、代谢机理研究和生物诊断等领域[1-3]。α-葡萄糖苷酶参与生物体的糖代谢,对维持人体的正常生理功能起着重要作用,其在小肠内可以催化多糖分解为葡萄糖,由此会引发餐后高血糖,而控制餐后高血糖是控制糖尿病患者发病的重要手段。采用α-葡萄糖苷酶抑制剂,可有效控制α-葡萄糖苷酶的活性,降低II型糖尿病及并发症的发生率[4-5]。目前,临床上已有一些通过抑制α-葡萄糖苷酶活性来治疗糖尿病的药物,其中研究最为成熟的是阿卡波糖、伏格列波糖、米格列醇,这些药物虽然可以有效降低餐后血糖水平和减少糖尿病并发症的发生,但毒副作用较大[6-7]。近来的研究表明,来源于植物的类黄酮具有较强的α-葡萄糖苷酶抑制活性和较低的生物毒性[8-10]。刘杰等采用聚酰胺柱制备青钱柳总黄酮,发现其α-葡萄糖苷酶抑制活性高于阿卡波糖,可显著改善小鼠糖耐量,降低餐后血糖浓度[11]。芶琳等发现富含黄酮的老鹰茶乙醇提取物对α-葡萄糖苷酶有较强的抑制作用(半抑制浓度(half maximal inhibitory concentration,IC50)为0.12 mg/mL),其抑制机制为可逆混合型[12]。

图1 异甘草素的化学结构Fig. 1 Chemical structure of isoliquiritigenin
异甘草素(图1)属于查耳酮类物质,是甘草等药食两用植物的重要活性成分,具有抗氧化、抗炎、抗肿瘤、维护心脑血管等多种生物活性[13-15]。余颖等发现甘草酸提取废液的乙酸乙酯萃取物具有良好的α-葡萄糖苷酶抑制活性,推测与其富含甘草素、异甘草素及其糖苷有关[16]。但至今鲜有对于异甘草素抑制α-葡萄糖苷酶的系统研究。鉴于此,本研究拟通过酶抑制动力学、荧光猝灭等实验手段考察异甘草素的酶抑制及互作情况,运用Surflex-Dock分子对接法研究异甘草素与酶的结合模式,将实验和模拟手段相结合,以揭示异甘草素抑制α-葡萄糖苷酶的分子机制。本研究对推动异甘草素在食品领域的应用、开发新型的降糖保健品具有一定的参考意义。
1 材料与方法
1.1 材料与试剂
异甘草素、阿卡波糖、对硝基苯酚 上海阿拉丁生化科技股份有限公司;α-葡萄糖苷酶(来自酿酒酵母)、对硝基苯-α-D-吡喃葡糖苷 美国Sigma-Aldrich公司;其他试剂皆为国产分析纯。
1.2 仪器与设备
Cary Eclipse荧光分光光度计 美国Agilent公司;TU-1810PC紫外-可见分光光度计 北京普析通用仪器有限公司;GenPure UF/UV纯水超纯水系统 美国Thermo Scientific公司;ME104电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 α-葡萄糖苷酶抑制效果测定
对硝基苯-α-D-吡喃葡糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG)作为底物时可被α-葡萄糖苷酶水解为黄色且在405 nm波长处有最大吸收的对硝基苯酚。参照文献[17]的方法,分别取1 mL α-葡萄糖苷酶溶液(0.2 U/mL)与1 mL的10、20、30、40、50 μg/mL异甘草素溶液在试管中振荡使混匀,对照管用1.0 mL磷酸盐缓冲液(0.1 mol/L,pH 6.8)代替样品,在37 ℃水浴中反应10 min,而后向试管中加入1 mL底物PNPG(1 mmol/L)溶液,反应20 min,最后迅速加入1 mL无水乙醇使酶失活,终止反应,测定405 nm波长处的吸光度。空白管为1 mL样品与1 mL酶混合,加入1 mL缓冲液,最后加入1 mL无水乙醇使酶失活。每次实验3 组平行。样品的抑制率效果用IC50进行比较,抑制率按公式(1)计算。

1.3.2 α-葡萄糖苷酶的抑制类型判断
设定5 个PNPG浓度(0.2、0.4、0.6、0.8、1.0 mmol/L),固定异甘草素(0、20、50 μg/mL)和α-葡萄糖苷酶含量(0.2 U/mL),测定反应速率,以酶促反应速率(1/v)对PNPG浓度的倒数(1/[S])作图,得Lineweaver-Burk双倒数曲线图,以判断抑制类型。
1.3.3 荧光光谱测定
参照文献[18]的方法,将1 mL不同质量浓度的样品溶液分别与4 mL酶液均匀混合,分别在25、30、37 ℃下反应10 min,之后对其进行荧光光谱扫描。激发波长为295 nm,扫描范围是320~380 nm,激发和发射的狭缝宽度均为10 nm。
1.3.4 分子对接实验
运用SYBYL 8.1软件中Surf l ex-Dock对接模块研究异甘草素与α-葡萄糖苷酶的结合模式。异甘草素的三维结构预先用Gaussian 09软件通过密度泛函方法(B3LYP/6-31g+)进行优化。α-葡萄糖苷酶的晶体结构下载自RCSB PDB数据库(http://www.rcsb.org/,PDB编号4J5T),删除水分子和非必需子结构,通过末端处理、加氢、分配原子类型、加电荷等步骤完成受体结构的准备,采用Surf l ex-Dock高精度对接法,原型分子生成阈值设为0.5,其余参数默认。对接后,选取Total score最大且Cscore也较大的构象作为研究对象[19]。
1.4 数据处理与分析
每个处理质量浓度测定3 次,使用SPSS软件的Duncan's法对结果的方差显著性进行分析。
2 结果与分析
2.1 α-葡萄糖苷酶抑制效果

图2 异甘草素(A)和阿卡波糖(B)对α-葡萄糖苷酶的抑制效果Fig. 2 α-Glucosidase inhibitory activities of isoliquiritigenin (A)and acarbose (B)
由图2可知,随着质量浓度的上升,异甘草素和阿卡波糖对α-葡萄糖苷酶的抑制率均逐渐上升,当异甘草素质量浓度为50 μg/mL时对α-葡萄糖苷酶的抑制率为74.72%,而阿卡波糖在3.0 mg/mL时,对α-葡萄糖苷酶的抑制才达到73.45%,通过曲线拟合计算可确定异甘草素和阿卡波糖对α-葡萄糖苷酶的IC50分别为(26.44±2.19)μg/mL和(1.22±0.05)mg/mL,异甘草素对α-葡萄糖苷酶的抑制能力显著优于阿卡波糖,表明其是一种食源性α-葡萄糖苷酶抑制剂,在功能性食品和医药领域具有潜在的应用前景。
为了研究异甘草素对α-葡萄糖苷酶的抑制类型,考察了不同质量浓度异甘草素存在的测试体系中,酶催化不同浓度PNPG水解的反应速率,经Lineweaver-Burk双倒数作图,得到1/[S]对1/v的线性回归关系(图3)。随着抑制剂异甘草素质量浓度的上升,异甘草素的米氏常数Km逐渐增加,最大反应速度vm逐渐减小,表明异甘草素采用竞争性与非竞争性相混合的方式抑制α-葡萄糖苷酶。Geng Sheng等在研究二氢杨梅素与α-葡萄糖苷酶的互作时也发现了相同的抑制行为[20]。阿卡波糖与寡糖结构相似,可通过竞争性结合α-葡萄糖苷酶上的碳水化合物结合位点发挥抑制作用[21]。而异甘草素不仅可与酶的活性部位相结合,还可与酶的非活性部位相结合,阻止产物生成,发挥抑制作用,因而在酶抑制实验中展现了更好的抑制效果。
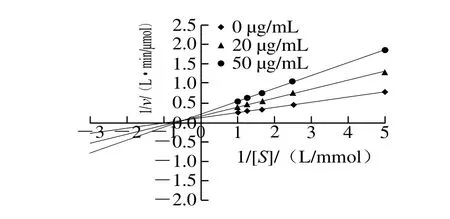
图3 异甘草素对α-葡萄糖苷酶抑制作用的Lineweaver-Burk图Fig. 3 Lineweaver-Burk plot for the inhibition of α-glucosidase by isoliquiritigenin
2.2 荧光光谱分析
荧光光谱法是在接近生理环境下研究活性小分子与酶间相互作用应用最广泛的方法,其基于小分子引起的酶蛋白内源荧光光谱的变化来获得二者的结合常数、结合位点数及热力学参数等信息[22-23]。由图4可知,随着异甘草素质量浓度的增加,α-葡萄糖苷酶的荧光强度呈规律性降低,表明二者发生了相互作用。采用Stern-Volmer方程(公式(2))分析不同温度下的荧光数据,获得相应的猝灭常数(表1)。不同温度下的猝灭常数(Kq)均远大于生物大分子动态荧光猝灭的最大常数2×1010L/(mol·s),表明异甘草素通过与α-葡萄糖苷酶结合成复合物,引发了酶蛋白的静态荧光猝灭。

式中:F0为无猝灭剂时反应体系的荧光强度(au);F为有猝灭剂时反应体系的荧光强度(au);τ0为无猝灭剂时荧光分子寿命/s;[Q]为猝灭剂浓度/(mol/mL)。
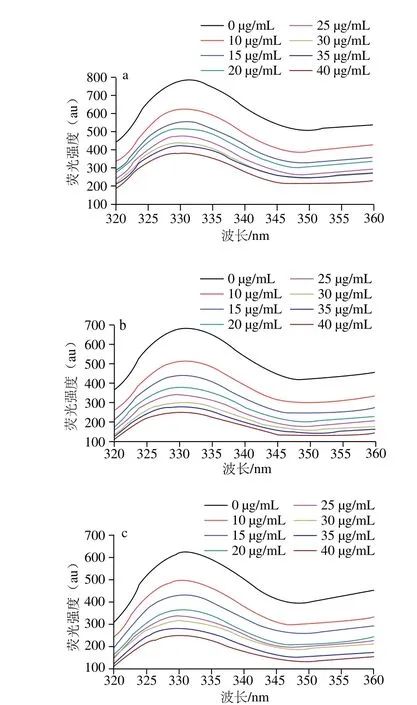
图4 异甘草素在25(a)、30(b)、37 ℃(c)时对α-葡萄糖苷酶荧光光谱的影响Fig. 4 Effect of isoliquiritigenin on fluorescence spectra of α-glucosidase at 25 (a), 30 (b) and 37 ℃ (c)
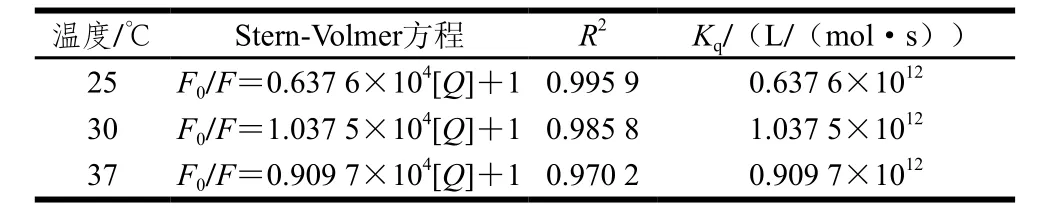
表1 异甘草素与α-葡萄糖苷酶间的荧光猝灭常数Table 1 Stern-Volmer quenching constants between isoliquiritigenin and α-glucosidase
对于静态荧光猝灭过程,可以使用双对数方程(公式(3))计算异甘草素与α-葡萄糖苷酶互作过程的结合常数(Ka)和结合位点数(n),相关结果见表2。
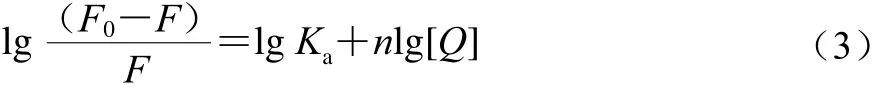
式中:F0为无猝灭剂时反应体系的荧光强度(au);F为有猝灭剂时反应体系的荧光强度(au);Ka为反应的结合常数/(L/mol);n为结合位点数;[Q]为猝灭剂浓度/(mol/mL)。

表2 异甘草素与α-葡萄糖苷酶间的结合参数Table 2 Binding parameters between isoliquiritigenin and α-glucosidase
由表2可知,随着温度的升高,异甘草素与α-葡萄糖苷酶的结合常数显著上升,而其结合位点数则略有增加,都稳定在1附近,推测适当升温不仅可以加速二者在溶液中的运动速率,提高结合效果,还可令α-葡萄糖苷酶结构更加伸展,暴露更多的结合位点。
为了理解异甘草素与α-葡萄糖苷酶的结合过程,利用Van't Hoff方程(公式(4))和吉布斯自由能方程(公式(5))获得了二者互作的热力学常数(表3)。

式中:Ka为反应的结合常数/(L/m o l);ΔH为反应的焓变/(k J/m o l);ΔS为反应的熵变/(J/(mol·K));ΔG为反应的吉布斯自由能变/(kJ/mol);R为气体摩尔常数(8.314 J/(mol·K));T为热力学温度/K。

表3 异甘草素与α-葡萄糖苷酶间的热力学参数Table 3 Thermodynamic parameters between isoliquiritigenin and α-glucosidase
异甘草素与α-葡萄糖苷酶互作的自由能变(ΔG)为负值,表明异甘草素与α-葡萄糖苷酶的结合是一个自发的过程,而焓变(ΔH)和熵变(ΔS)为正值,根据前人总结的热力学规律[24],二者的结合过程是一个以熵驱动为主的自发进行的过程,受疏水作用力驱动,这可能由于异甘草素在结构上具有两个疏水性的苯环,因而在与酶的疏水口袋结合过程中,疏水力发挥了主要作用。
2.3 分子对接分析
多酚与酶的互作涉及复杂的结构改变,其中酶可能发生有序的高级结构重组,并伴随能量转移、信号分子传递等新的变化[25]。目前,多种实验手段可用于此类研究,如光谱法(包括紫外光谱、荧光光谱、红外光谱、拉曼光谱、圆二色光谱等)、平衡透析、电泳及色谱等方法,还有新出现的等温滴定量热、核磁共振、表面等离子共振等方法[26-27]。但复杂的条件参数给研究带来了极大困难,近年来,分子模拟方法成为互作研究的重要工具[28]。近期迅速发展的ONIOM计算、分子动力学、分子对接已被用于研究多酚与酶蛋白的结合机制[29]。为了验证前述的实验结果,本研究运用Surflex-Dock分子对接法考察了异甘草素与α-葡萄糖苷酶的作用模式。Surflex-Dock对接法是一种半柔性分子对接方法,采用经验打分函数和分子相似性搜索引擎考察活性小分子与蛋白间几何匹配和能量匹配的识别过程,确定二者的复合物构象[30]。异甘草素与α-葡萄糖苷酶的分子对接结果如图5所示,异甘草素仅与酶蛋白的Asp202和Arg400残基发生了氢键作用,而与周围众多的疏水残基(Phe147、Phe166、Gly228、Glu271、Phe297、Asp333、Tyr389、Phe397)存在疏水作用,这与荧光猝灭实验结果一致。根据分子对接结果可推测,异甘草素的酶抑制机制包括:1)与α-葡萄糖苷酶的活性口袋结合后,阻碍了底物的进入;2)改变了α-葡萄糖苷酶活性中心的构象,降低了酶活力。

图5 异甘草素与α-葡萄糖苷酶的分子对接结果Fig. 5 Docking results between isoliquiritigenin and α-glucosidase
3 结 论
本实验采用酶抑制、荧光猝灭以及分子模拟对接等方法,系统研究了异甘草素抑制α-葡萄糖苷酶的分子机制。结果表明异甘草素以竞争性与非竞争性抑制相混合的方式抑制α-葡萄糖苷酶,其抑制效果明显优于阿卡波糖。荧光猝灭分析表明在疏水作用力驱动下异甘草素可与α-葡萄糖苷酶结合生成复合物,结合位点数为1。分子对接结果进一步表明,异甘草素位于酶的疏水口袋中,与残基Asp202和Arg400以氢键结合,并与周围众多的疏水残基存在疏水作用,共同维持该复合物结构。本研究对于开发新型的食源性α-葡萄糖苷酶抑制剂,推动异甘草素在功能性食品领域的应用具有一定的参考价值。
