老年2型糖尿病病人肌少症的发生情况及影响因素研究
2019-08-30
肌少症(sarcopenia)是老年人常见的综合性退行性疾病,主要表现为肌力减退及肌肉质量下降。2型糖尿病(type 2 diabetes mellitus,T2DM)病人由于体内代谢的改变、营养摄入减少等原因,是肌少症发生的高危人群。肌少症不但会对老年T2DM病人的日常活动产生影响,同时也降低了病人的生活质量,促进糖尿病的进展。本研究旨在分析老年T2DM病人肌少症的发生情况及其相关危险因素,现报道如下。
1 资料与方法
1.1 对象选择 选取2015年12月至2017年12月在我院内分泌科及老年医学科住院的老年T2DM病人280例(T2DM组)。入组标准:(1)有自主活动能力,一般情况良好;(2)符合中国2型糖尿病防治指南的诊断标准[9];(3)年龄60~80岁。排除标准:(1)存在甲状腺功能异常、药物性肝炎、慢性病毒性肝炎和其他疾病所致的肝病等病人;(2)继发性糖尿病、1型糖尿病、糖尿病伴酮症酸中毒、糖尿病乳酸性酸中毒、糖尿病高糖高渗性昏迷,有低血糖等急性并发症病史;(3)合并严重心、肝、肾功能损害或存在神经系统、免疫系统、肿瘤、严重感染等疾病者;(4)近期曾行手术或受过严重外伤者;(5)无自主活动能力,合并精神疾病者;(6)服用维生素D、性激素、糖皮质激素、抗癫痫药物、抗凝药物及影响骨代谢的药物者。同时选取258例在我院体检的正常健康老年人为对照组。本研究经本院伦理委员会批准,并取得所有被试者的知情同意。
1.2 实验室检查 所有病人入院后均采用化学法检测血生化指标(总胆固醇、低密度脂蛋白胆固醇、尿酸、尿素氮、CA199等),采用色谱法测定糖化血红蛋白(HbA1c),采用化学发光法测定血清25-羟维生素D[25(OH)D]的水平。
1.3 步速及握力测定 所有被试者先进行步速及握力测定。在长度>6 m的诊室内由统一培训的医务人员使用秒表测量被试者以平日速度行走完6 m所需要的时间,步速<0.8 m/s 为步速降低。握力测量:采用JAMAR 握力器检测受试人群握力,根据美国手治疗协会标准化握力测量指南体位,分别记录左右臂握力值,取二者平均值计算握力。男性握力<26 kg,女性握力<18 kg为肌力降低。
1.4 肌肉质量测定 采用生物电阻抗测试法(bio impedance analysis,BIA)测量体表面积、骨骼肌质量、内脏脂肪含量等各项指标。四肢骨骼肌质量指数(skeletal muscle mass index,ASMI)=四肢骨骼肌质量(kg)/身高(m)2。按照亚洲肌少症工作组共识报告,将男性ASMI<7.0 kg/m2,女性ASMI<5.7 kg/m2定义为肌肉质量降低[10]。
1.5 肌少症的诊断标准 本研究按照亚洲肌少症工作组共识报告诊断肌少症[10]。

2 结果
2.1 2组受试者临床资料的比较 老年T2DM病人与正常对照组相比,年龄、性别、体质量指数(body mass index,BMI)、总胆固醇、低密度脂蛋白胆固醇、尿酸、尿素氮、CA199差异无统计学意义。2组左上肢握力、右上肢握力、步速、ASMI、血清25(OH)D水平差异均有统计学意义,见表1。
2.2 2组肌少症发生情况的比较 老年T2DM病人肌少症总发病率显著高于对照组,差异有统计学意义(P<0.05),其中男性T2DM病人和女性T2DM病人的肌少症发病率均显著高于各自对照组,差异有统计学意义(P<0.05)。见表2。

表1 2组临床资料的比较
注:与T2DM组比较,**P<0.01

表2 2组肌少症发生情况的比较(n,%)
注:与T2DM组比较,**P<0.01
2.3 老年T2DM肌少症组与非肌少症组临床资料的比较 2组年龄、性别差异无统计学意义(P>0.05),病程、BMI、左上肢握力、右上肢握力、步速、HbA1c、血清25(OH)D水平差异有统计学意义。见表3。

表3 老年T2DM肌少症组与非肌少症组临床资料的比较
注:与肌少症组比较,*P<0.05,**P<0.01
2.4 不同维生素D水平下T2DM组与对照组ASMI的比较 根据血清25(OH)D水平分为维生素D充足组(≥30 ng/mL)、维生素D不足组[20 ng/mL≤25(OH)D<30 ng/mL)、维生素D缺乏组(10 ng/mL≤25(OH)D<20 ng/mL)和维生素D严重缺乏组(<10 ng/mL)。维生素D充足组中,老年T2DM病人与对照组相比,ASMI差异无统计学意义(P>0.05)。维生素D不足组、缺乏组、严重缺乏组中,老年T2DM病人与对照组相比,ASMI显著下降,差异有统计学意义(P均<0.01)。见表4。

表4 不同维生素D水平下2组ASMI比较
注:与T2DM组比较,**P<0.01
2.5 T2DM病人肌肉质量指标与临床因素的相关分析 Pearson相关分析发现,老年T2DM病人ASMI与年龄、HbA1c、病程呈负相关,与血清25(OH)D水平呈正相关;左上肢握力与年龄呈负相关,与BMI、25(OH)D水平呈正相关;右上肢握力与年龄呈负相关,与BMI、25(OH)D水平呈正相关;步速与年龄呈显著负相关,与25(OH)D水平呈显著正相关。见表5。
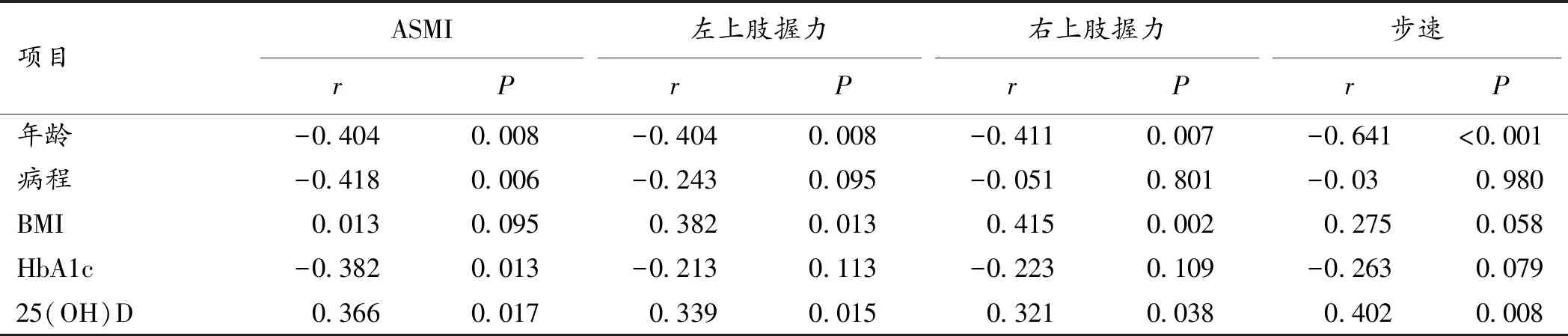
表5 老年T2DM病人的肌肉质量相关指标与各影响因素之间相关性分析
2.6 T2DM病人肌少症的危险因素分析 Logistic回归分析显示,病人的年龄(OR=1.208,P=0.006)、HbA1c水平(OR=1.851,P=0.015)、病程(OR=1.482,P<0.001)、血清25(OH)D缺乏(OR=2.853,P<0.001)是肌少症发生的危险因素。
3 讨论
肌少症是一种增龄性疾病,诊断包括肌肉质量的减少,肌肉力量的降低以及肌肉功能的下降[1]。有研究表明,在大于60岁的老年人群中,肌肉质量平均下降5%~13%,而大于80岁的超高龄老人中更是高达50%[2]。本研究显示,老年T2DM组与对照组中肌少症的病人年龄均大于未患肌少症者,提示年龄的增加是肌少症的危险因素。很多原因导致了这种增龄引起的肌肉减少,如胰岛素抵抗[3]、糖尿病[4]、各类激素水平降低、甲状腺功能异常、线粒体细胞凋亡、神经退行性病变、废用性制动、营养不良、恶病质等。
近年来,Lee 等[3]研究发现,糖尿病与老年人群肌肉质量减少相关,健康 ABC 研究报道,与非糖尿病人群相比,老年 T2DM 病人骨骼肌质量下降更加明显[5],并且T2DM病程越长,HbA1c越高,肌肉减少越明显[6]。本研究发现,在老年T2DM组中,肌少症病人平均HbA1c与病程均高于非肌少症组,差异有统计学意义。老年T2DM病人肌肉流失速度变快的原因尚不清楚,可能由于 T2DM 的代谢异常对肌肉质量产生影响。Tawa等[7]研究认为,T2DM 病人蛋白质代谢的净平衡可能减少,导致蛋白质分解大于合成,另外 T2DM 由于胰岛素抵抗可能引起肌肉蛋白质合成的减少[8]。随着糖尿病病程的增加,胰岛素抵抗增加,最终导致肌肉蛋白质合成减少。
维生素D是葡萄糖依赖的正常胰岛素分泌和维持葡萄糖耐量的必需物质[9],维生素D缺乏和不良代谢风险相关。低水平的维生素D可能影响血糖和胰岛素的体内平衡以及心血管系统,从而导致胰岛素抵抗、高血糖、高血压、心脏病和认知功能减退[9]。而维生素D作为一种营养素,不仅调节钙平衡和骨代谢,可能在骨骼肌的质量、力量及功能方面发挥作用[10]。25(OH)D作为维生素D的中间代谢物,在血液中的浓度相对稳定,因此已被广泛用于反映体内的维生素D营养状况。
本研究结果发现,老年T2DM病人血清25(OH)D水平较对照组显著下降,与既往研究结果一致[11]。按照维生素D水平进行分层分析发现,维生素D不足组、缺乏组、严重缺乏组中,老年T2DM病人与对照组相比,ASMI显著降低,提示老年T2DM病人合并肌少症与维生素D水平下降有关。
本研究通过相关及回归分析发现,血清25(OH)D水平对老年T2DM病人的ASMI、上肢握力以及步速都存在重要影响,这与Leenders等[12]的研究一致,年龄、病程及HbA1c水平亦对老年T2DM病人的上述肌肉质量指标存在一定程度的影响,冯筱等[13]的研究也证明了这一观点。
综上所述,在老年T2DM病人中,年龄、病程、HbA1c、25(OH)D缺乏为肌少症发病的危险因素。25(OH)D水平越低,肌少症发病率越高。因此,老年T2DM病人应及时进行肌少症的早期筛查。特别是年龄大、病程长、血糖控制不理想的病人,早期筛查、及时干预尤为重要。老年T2DM病人控制血糖,及早补充维生素D或许能够降低肌少症的发病率,改善预后。
