野生猕猴桃酒苹果酸-乳酸发酵优良乳酸菌的筛选与耐受性研究
2019-08-30李建芳王荣荣
李建芳,周 枫*,王 爽,王荣荣,朱 静
(1.信阳农林学院 食品学院,河南 信阳 464000;2.中国海洋大学 食品学院,山东 青岛 266000)
我国作为猕猴桃的原产国,野生资源丰富,拥有62个种,已有2 000多年的文字记载历史[1]。野生猕猴桃具有较高的营养价值和功能作用,是酿造果酒的优质资源,但因其含有较高的有机酸,造成酒体粗糙,酸味过重,通常还会伴随着酒体失光、浑浊等不良现象[2]。
苹果酸-乳酸发酵(malolactic fermentation,MLF)是乳酸菌以L-苹果酸为底物,在苹果酸乳酸酶(malolactic enzyme,MLE)的催化作用下,转变成L-乳酸和CO2的过程[3-4]。其被认为是一个二次发酵过程,在大多数果酒的生产中发挥着不可或缺的作用。MLF可适当地降低酒体中的有机酸含量[5-6],改善葡萄酒的稳定性[7],降低果酒中某些有害成分[8],是提高果酒柔和度和稳定性的重要工序,已在葡萄酒或苹果酒中广泛应用。
在传统的果酒发酵过程中,MLF是在酒精发酵刚刚完成之后进行的,可以是自然发酵,也可以是接种发酵剂发酵。然而,在复杂的酒体中,并非所有的细菌都容易生长,如低pH值(<3.5)、高SO2(>50mg/L)、高酒精度(>4%vol)以及中链脂肪酸、酚类化合物(如酚酸、单宁)和酵母发酵副产物抑制蛋白质等均可以抑制乳酸菌的生长[9]。因此,筛选苹果酸-乳酸发酵的优良菌株,最基本的要求是具有良好的适应性和酿酒特性,并具有较强的苹果酸降解能力。目前,国内外猕猴桃酒优良MLF乳酸菌相关研究较少。以果酒为原料分离筛选优良MLF乳酸菌是MLF乳酸菌选育的主要手段之一[10]。
因此,本研究通过形态观察、生理生化试验从自然发酵的野生猕猴桃酒中分离筛选出能够进行MLF的乳酸菌,以商业用菌为对照菌株,对分离菌株的SO2、酒精、pH耐受能力进行研究,从而获得综合耐受能力较强的优良菌株。旨在为猕猴桃酒的工业生产提供MLF高耐受性优良菌株,同时为提高猕猴桃酒的质量和稳定性提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
野生猕猴桃果实:于2017年9月采摘自豫南大别山区,成熟度为八成。
1.1.2 菌株
果酒专用酵母:安琪酵母股份有限公司;商业乳酸菌(SY)(Leuconostoconos.b.V.D):法国LALLEMANDS.A.公司。
1.1.3 化学试剂
过氧化氢、D-L苹果酸、乳酸、溴酚蓝、体积分数50%冰乙酸、正丁醇:国药集团化学试剂有限公司。所用试剂均为分析纯。
1.1.4 培养基
改良MRS培养基、改良番茄汁琼脂(tomato juice agar,TJA)培养基:北京奥博星生物技术有限责任公司;酸性番茄(acid tomato juice,ATB)培养基:招远拓普生物工程有限公司;糖发酵培养基:杭州微生物试剂有限公司;石蕊牛奶培养基:北青岛高科园海博生物技术有限公司。
1.2 仪器与设备
JC303型生化培养箱:南通嘉程仪器有限公司;SW-CJ-2F型双人双面净化工作台:杭州博大净化设备有限公司;JC101型电热鼓风干燥箱:西安安森智能仪器股份有限公司;WYT-J型手持糖度计:上海沪粤明科学仪器有限公司;LDZX-50FA型立式压力蒸汽灭菌器:上海申安医疗器械厂;TP310型pH计:北京时代新维测控设备有限公司。
1.3 方法
1.3.1 猕猴桃酒的发酵
选取新鲜、成熟的猕猴桃果实,破碎,打浆后加入0.2g/L活化果酒专用酵母启动酒精发酵。调节总SO2质量浓度为60mg/L,分装至2 L发酵罐中,在25℃条件下进行酒精发酵,待酒精发酵结束后去渣倒罐,利用猕猴桃酒体中的乳酸菌自然启动MLF。
1.3.2 苹果酸-乳酸发酵的监测
以1.5%乳酸标准液为对照,采用纸层析法[11]测定乳酸含量,进而对苹果酸-乳酸发酵进行监测。
1.3.3 苹果酸-乳酸发酵乳酸菌的分离
参照何志刚等[12]的方法,略作改动。在无菌条件下,取自然启动MLF的酒样,适当稀释后,吸取0.1m L酒样均匀涂布于ATB培养基,在28℃条件下培养5~6 d,挑取圆形且稍扁平的单菌落在MRS培养基上进行分离纯化,获得纯菌株进行编号。
1.3.4 形态观察
参照周安玲[13]的方法,略作改动。将适当稀释度的分离菌悬液分别涂布于TJA培养基,于25℃条件下恒温培养2~3 d,逐一观察菌落的形状、大小、边缘、表面、隆起形状、透明度、颜色等特点,并分别进行革兰氏染色,在油镜下观察细胞形态。
1.3.5 生理生化试验
对分离菌株进行乳糖发酵试验、触酶试验和石蕊牛奶试验,参照《伯杰细菌鉴定手册》[14]、《葡萄酒酿造微生物学-实验技术与规程》[15]及《乳酸细菌基础、技术和应用》[16]对试验结果进行分析,筛选出具有MLF能力的乳酸菌。
1.3.6 耐受性试验
一般情况下,乳酸菌代谢糖类的适宜温度为22~25℃,且MLF速度较快,挥发酸较多;在15~20℃条件下,MLF速度稍慢,酒体成分也会发生相应变化;10℃以下,乳酸菌的生长会受到抑制。因此,本试验选择在25℃条件下,参照段浩云等[17]的方法(略作改动)研究筛选菌株的耐受性。具体方法:挑取适量保存于TJA斜面的菌株分别接种于10mLATB液体培养基中,25℃条件下活化24~48h。取1m L种子液(107CFU/m L)分别接种于9m L不同SO2质量浓度(40mg/L、60mg/L、80mg/L、100mg/L、120mg/L)、酒精度(8%vol、10%vol、12%vol、14%vol、16%vol)、pH值(2.8、3.0、3.2、3.4、3.6)的MRS液体培养基中,25 ℃条件下静置培养2 d,在显微镜下用血细胞计数板对活菌进行计数,筛选出综合耐受性能较好的乳酸菌。
2 结果与分析
2.1 乳酸菌的分离筛选
对自然启动MLF的野生猕猴桃酒样中的乳酸菌进行分离、纯化,得到6株疑似乳酸菌,均呈革兰氏阳性,分别编号为R6、R7、R11、R14、R15、R18,6株疑似乳酸菌的菌落形态及细胞形态详细描述见表1。
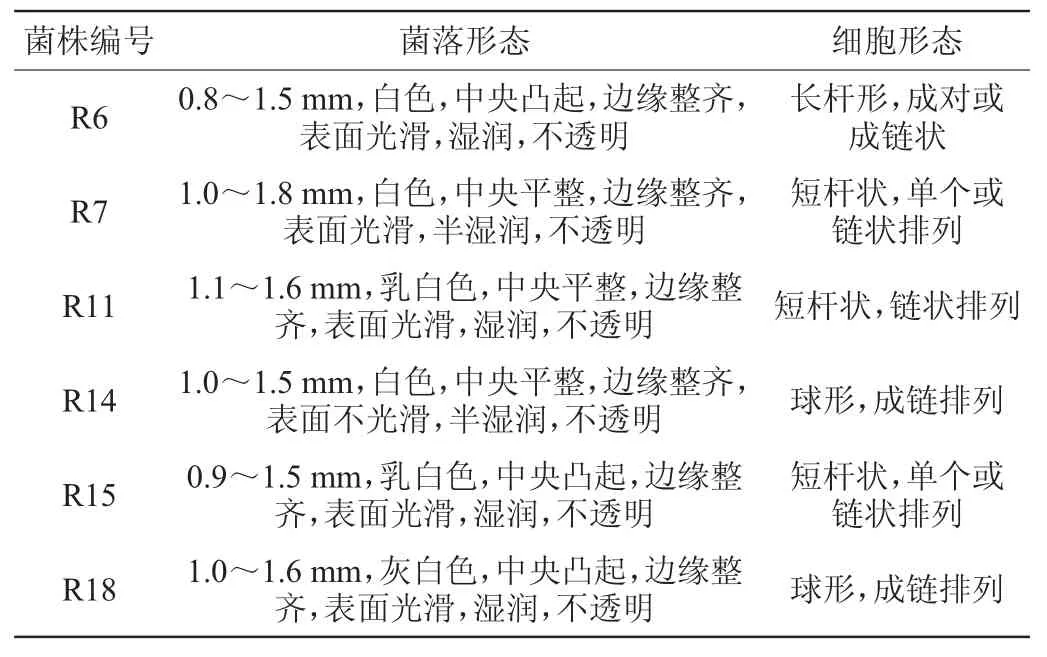
表1 分离菌株的菌落和细胞形态结果Table 1 Colonialand cellmorphology of isolated strains
由表1可知,分离得到的6株疑似乳酸菌菌落较小,菌落直径在0.8~1.8mm,圆形,白色、乳白色或灰白色,均不透明。其中菌株R6、R11、R15、R18菌落表面光滑、湿润;菌株R7和R14菌落表面半湿润;菌株R14菌落表面不光滑;菌株R6、R15、R18菌落中央凸起,菌株R7、R11、R14菌落中央平整。菌株R14和R18细胞呈球形,成链排列;其他菌株细胞形态为短杆状或长杆状,单个或成对或链状排列。
对6株分离菌株分别进行乳糖发酵试验、触酶试验、石蕊牛奶试验,结果表明,6株分离菌株触酶试验均为阴性,牛奶石蕊试验和乳糖发酵试验均为阳性。结合菌落形态和细胞形态初步鉴定6株菌均为乳酸菌。
2.2 分离菌株耐受性研究
2.2.1 SO2耐受能力
SO2是果酒酿造中广为使用的添加剂,其主要作用是防止酒体褐变和避免杂菌的污染。但是乳酸菌的生长对SO2较为敏感,在已报道的菌株中,大多菌株的SO2耐受能力<60mg/L[18],为防止酒体氧化褐变和杂菌大量繁殖而导致挥发酸含量升高,寻找具有耐受高SO2能力的乳酸菌株成为MLF进程中的关键。因此,以商业乳酸菌SY为对照,对分离得到的6株乳酸菌的SO2耐受性进行测定,结果见表2。
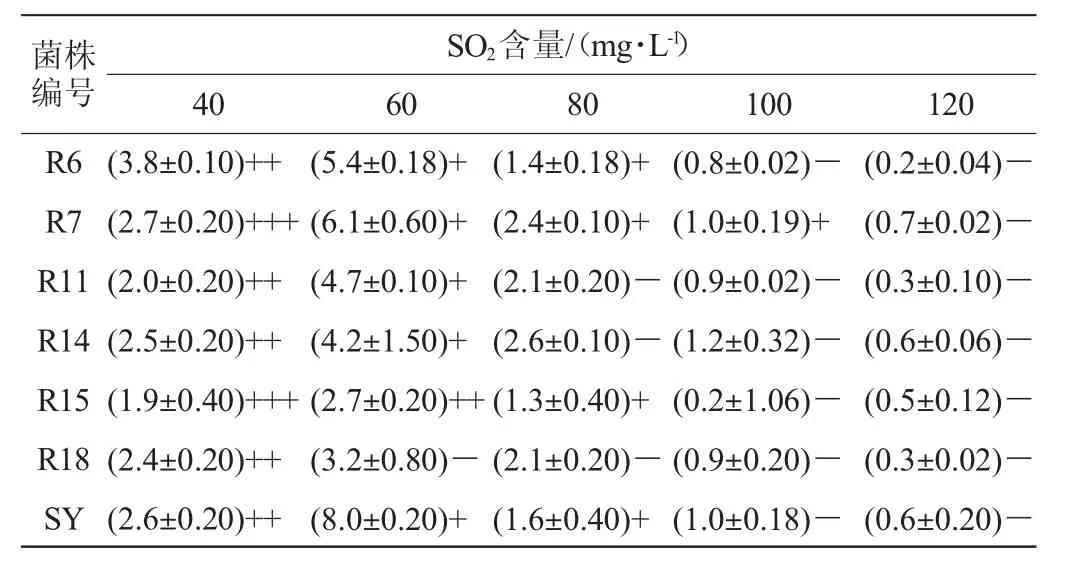
表2 分离菌株的SO2耐受性Table 2 SO2 tolerance of isolated strains
由表2可知,当SO2含量为40mg/L时,所有菌株活菌数>107CFU/m L,最高可达108CFU/m L;当SO2含量为60mg/L时,除菌株R18外,其他菌株均表现出较强的SO2耐受能力,活菌数均>106CFU/m L;当SO2含量为80mg/L时,菌株R6、R7、R15表现出较强的SO2耐受能力,活菌数均>106CFU/m L;当SO2含量为100mg/L时,菌株R6、R11、R15、R18均呈现负增长趋势,且处于不生长状态,菌株R7仍表现出较好的耐受能力,菌株R14未出现负增长,但处于不生长状态;当SO2含量为120mg/L时,6株分离菌均呈现负增长趋势,且处于不生长状态。从杆菌与球菌之间来看,整体上杆菌对SO2的耐受能力高于球菌。以SO2质量浓度为80mg/L时,商业乳酸菌SY的增殖量为标准,可筛选确定SO2耐受能力较强的菌株为R6、R7和R15,其中,菌株R7的SO2耐受能力最强。
2.2.2 酒精耐受能力
在猕猴桃酒发酵过程中,酵母菌代谢的主要产物是乙醇,随着发酵的进行,猕猴桃酒中酒精度越来越高,一般可达10%vol~14%vol。酒精度是抑制乳酸菌生长的重要因素,过高的酒精度可影响乳酸菌的新陈代谢活动,抑制其生长。因此,以商业乳酸菌SY为对照,对分离得到的6株乳酸菌的酒精耐受性进行测定,结果见表3。
由表3可知,酒精度对分离乳酸菌的生长均表现出一定程度的抑制作用,随着培养基中酒精度由8%vol逐渐增大,对乳酸菌的抑制作用逐渐增强,两者呈显著正相关(P<0.05)。当酒精度为8%vol时,6株菌株的活菌数均>107CFU/mL,生长状况良好;当酒精度为10%vol时,菌株R11、R15、R18的活菌数下降一个级别,而菌株R6、R7的活菌数依然为108CFU/m L;当酒精度增至12%vol时,所有分离菌株的活菌数均下降一个级别,其中菌株R18降至105CFU/m L以下或不生长;当酒精度为14%vol时,6株分离菌株酒精耐受能力继续下降,大部分菌株不生长,而筛选菌株R6和R7的活菌数仍为106CFU/m L,表现出较强的酒精度耐受力,但均低于商业乳酸菌SY;当酒精度增至16%vol时,分离菌的活菌数均降至105CFU/m L以下或不生长。参照菌株SY在酒精度12%vol的活菌数,确定酒精度耐受性较强的菌株为R7,整体上杆菌对酒精的耐受能力高于球菌。
2.2.3 pH值耐受能力
不同乳酸菌对pH值的适应能力不同,大部分的乳酸菌最适生长pH接近中性[19],也有一些种属如酒球菌属(Oenococcus)和乳杆菌(Lactobacillus)是嗜酸的[20]。猕猴桃酒体的pH值一般在2.8~3.6范围内变化,因此,以商业乳酸菌SY为对照,对分离得到的6株乳酸菌的pH值耐受性进行测定,结果见表4。
由表4可知,pH值对分离乳酸菌的生长均表现出一定程度的抑制作用,随着培养基中pH由3.6逐渐降低,对乳酸菌的抑制作用逐渐增强,两者呈显著负相关(P<0.05)。当pH值为3.6时,6株乳酸菌活菌数均>107CFU/m L,总体生长较好,其中菌株R6、R15和R18的活菌数达到108CFU/m L;当pH值下降到3.4时,除菌株R11、R18外,其他菌株活菌数均下降一个级别,活菌数开始显著下降;当pH值下降到3.2时,活菌数继续显著下降,其中,菌株R14下降到105CFU/m L以下或不生长;当pH值下降到3.0时,活菌数继续显著下降,但菌株R15仍表现出较好的pH值耐受能力;当pH值下降到2.8时,分离菌株及商业乳酸菌SY的活菌数均不增长。整体上杆菌对pH的耐受能力高于球菌。参照商业乳酸菌SY,菌株R15的pH耐受性较好。
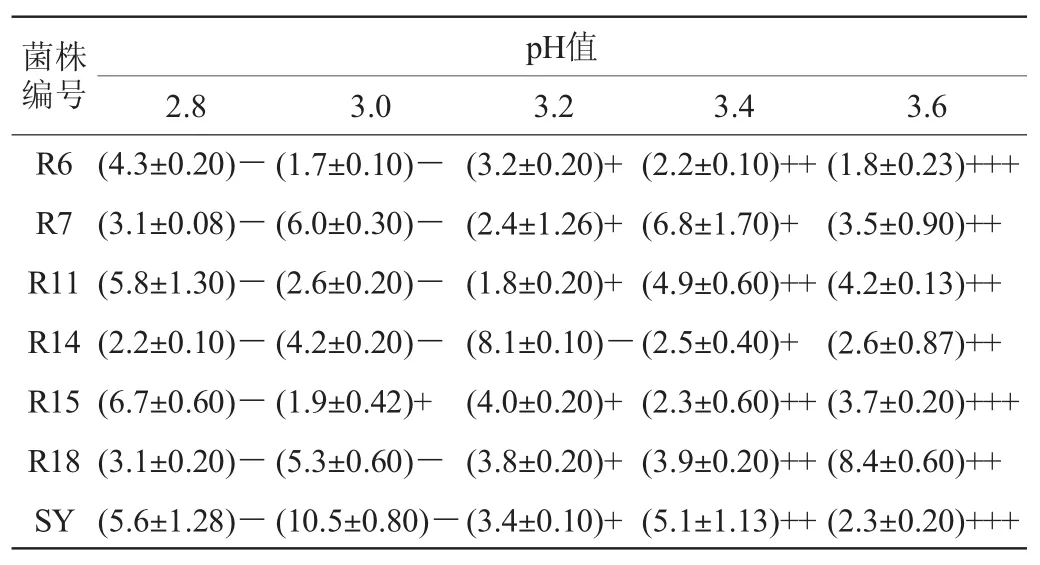
表4 分离菌株的pH值耐受性Table 4 pH tolerance of isolated strains
综上,可以初步认为在从自然启动MLF的野生猕猴桃酒中分离得到的6株乳酸菌中,菌株R6、R7和R15的SO2、酒精及pH耐受性较好,可以作为猕猴桃酒的生物降酸优良菌株,对果酒生物降酸技术的提升及果酒质量的提高有着重要意义。
3 结论
采用ATB培养基,通过形态观察及生理生化试验从自然启动MLF野生猕猴桃酒中初筛得到6株乳酸菌,分别为R6、R7、R11、R14、R15、R18。通过对6株乳酸菌的SO2、酒精及pH耐受性的研究发现,分离菌株中乳酸杆菌的耐受能力高于球菌。其中,3株乳酸菌(R6、R7、R15)具有较强的SO2、酒精及pH耐受能力,菌株R6、R15在SO280mg/L及菌株R7在SO2100mg/L可维持生长;菌株R6、R7在酒精度14%vol及菌株R15在酒精度12%vol可维持生长;菌株R6、R7在pH值3.2及菌株R15在pH 3.0时可维持生长。结果表明,菌株R6、R7、R15可以作为MLF优良乳酸菌进一步开发与应用的研究对象。
