金银花醇提物对水溶性红曲色素的护色作用研究
2019-08-28邱华振杨昳津王光强熊智强艾连中夏永军
邱华振,杨昳津,胡 健,王光强,熊智强,张 汇,艾连中,夏永军,*
(1.上海理工大学医疗器械与食品学院,上海食品微生物工程技术研究中心,上海 200093;2.上海金枫酒业股份有限公司,上海 200120)
福建红曲米产品全国出名,具有成熟的生产工艺和典型的代表性[1]。红曲色素作为食品添加剂应用于酒类、饮料以及熟食等食品中[2]。然而红曲色素光不稳定特性制约了红曲色素广泛的应用。研究发现红曲色素褪色主要机制是光降解[3],在光照条件下红曲色素吸收光子后被激化,由于光的吸收、自由基的产生、发色团的破坏,导致变色和褪色[4]。
1 材料与方法
1.1 材料与仪器
新鲜的金银花 山东临沂沂蒙山;水溶性红曲红色素、水溶性红曲黄色素 山东中惠生物科技股份有限公司;维生素C、芦丁、槲皮素、醋酸铵 分析纯,上海源叶生物科技有限公司;绿原酸 分析纯,上海生工生物工程股份有限公司;冰醋酸 分析纯,上海泰坦科技股份有限公司;三乙胺、盐酸 分析纯,国药集团化学试剂有限公司;甲醇、乙腈(分析纯)、400度富尔马肼(Formazine)浊度标准液 上海安谱实验科技股份有限公司。
IKA研磨机 IKA集团有限公司;PB-10普及型pH计 德国Sartorius公司;2468-2414型液相色谱仪 Waters公司;SpectraMax i3x酶标仪 Molecular Devices;HWS-26型水浴锅 上海一恒科学仪器有限公司;UV2600型紫外分光光度计 尤尼柯仪器有限公司;RE-2000A型旋转蒸发器、SHZ-III型循环水真空泵 上海亚荣生化仪器厂;KQ-600B型超声波清洗器 昆山舒美超声仪器有限公司。
1.2 实验方法
1.2.1 金银花醇提物的制备 准确称取制备好的金银花粉末2.0 g于100 mL的容量瓶中加入60 mL 55%的乙醇进行超声提取,超声时间为30 min、温度60 ℃[11]。趁热过滤,滤渣采用相同的方法进行浸提,重复2次。将所有过滤后的滤液合并,于圆底烧瓶中55 ℃旋转蒸发浓缩,然后进行真空干燥制得金银花醇提物干粉,于干燥皿中4 ℃避光保存备用。
1.2.2 红曲色素水溶液及金银花醇提物色素溶液的制备 分别称取红色素和黄色素0.1 g溶于1000 mL的去离子水中,配制成红色素水溶液和黄色素水溶液,取100 mL上述色素溶液分别添加0.05 g金银花醇提物,配制成0.5 mg/mL金银花醇提物色素水溶液,充分溶解并4 ℃遮光保存备用。
1.2.3 红曲色素溶液及添加金银花醇提物色素溶液的紫外吸收波长扫描 将配制好的水溶性红曲红色素(下文称“红色素”)溶液和水溶性红曲黄色素(下文称“黄色素”)溶液以及分别添加金银花醇提物的色素溶液用紫外-可见光分光光度计进行250~550 nm全波长扫描,确定其最大吸收峰的吸光值(Amax),以及添加金银花醇提物后是否影响其最大吸收峰。
1.2.4 红曲色素溶液的紫外降解动力学分析 本实验通过紫外照射加快色素光降解,控制紫外光源距离来控制紫外强度[12]。准确量取50 mL红色素和黄色素溶液分别置于四个Φ=8 cm透紫外石英平皿中,依次距离40 W、250 nm紫外灯光源4、8、12、16 cm下进行紫外照射实验[13]。每隔15 min取一次样,用分光光度计测定其Amax并计算色素保存率。
1.2.5 金银花醇提物添加量的确定 分别用红色素、黄色素水溶液配成0、0.1、0.3、0.5、0.7、0.9 mg/mL的金银花醇提物溶液,分别取50 mL置于Φ=8 cm透紫外石英平皿中进行紫外照射每隔30 min取样一次,分光光度计测定其Amax并计算其色素保存率;同时测定不同浓度下的金银花醇提物色素水溶液的浊度(NTU),观察其添加量对色素水溶液浊度的影响。
1.2.6 酸性条件下金银花醇提物对色素光稳定性的影响 分别取100 mL两种色素水溶液用1 mol/L盐酸调成pH4、pH7,各取50 mL配成浓度为0.5 mg/mL金银花醇提物色素水溶液,以不添加金银花醇提物的色素溶液为空白对照组,然后进行紫外照射每隔30 min取样一次,测其Amax并计算色素保存率。
1.2.7 金银花醇提物HPLC分析
1.2.7.1 标准品溶液和供试品溶液的制备 精密的称取标准样品绿原酸3.95 mg、芦丁4.90 mg、槲皮素2.12 mg于25.00 mL的容量瓶中,甲醇溶解,摇匀,定容制成0.158 mg/mL绿原酸、0.196 mg/mL芦丁、0.085 mg/mL槲皮素的混合对照品溶液。分别取1.00、2.00、4.00、6.00、8.00 mL至10 mL的容量瓶中,甲醇溶解并摇匀,定容。用0.25 μm微孔滤膜过滤,得到一系列不同质量浓度的标准混合液。准确称取实验室制得的金银花醇提物粉末0.003 g,甲醇溶解,摇匀,定容于25 mL容量瓶中,充分溶解,用0.22 μm微孔滤膜过滤,得到供试品溶液。
1.2.7.2 色谱条件 色谱柱为Sepax HP-C18色谱柱(4.6 mm×250 mm,5 μm)柱;流动相:乙腈(A);0.01 mol/L醋酸铵溶液(每100 mL中0.2 mL三乙胺,乙酸调pH至4.8)(B),采用梯度洗脱,梯度洗脱程序:0~30 min,A∶B 8∶92~30∶70 (V/V),流速:1.00 mL/min,检测波长350 nm[14]。
1.2.7.3 标准曲线的绘制 在上述的条件下对上述的样品进行HPLC检测分析,以绿原酸、芦丁、槲皮素测定峰面积值(y)为纵坐标;以其相应的一系列浓度(x)为横坐标,绘制标准曲线,并计算回归方程:绿原酸:y=12258x-92.325,R2=0.9999;槲皮素:y=34736x-94.721,R2=0.9999;芦丁:y=16565x-44.851,R2=1.0000。
1.2.8 绿原酸对红曲色素的护色效果分析 各取0.05 g绿原酸、金银花醇提物、VC,分别用红色素水溶液和黄色素水溶液配制成0.5 mg/mL绿原酸色素溶液、0.5 mg/mL金银花醇提物色素溶液、0.5 mg/mL VC色素溶液,分别取50 mL置于Φ=8 cm透紫外石英平皿中距离紫外灯16 cm进行照射,每隔30 min取样一次测其Amax并计算其色素保存率。
1.2.9 色素保存率的计算 以A(%)对时间作图来表示红曲色素随光降解浓度随时间的变化关系,并按下式来计算色素保存率。
保存率:A(%)=Ax/A0×100
式中:A0为色素的起始Amax值;Ax为处理后色素Amax值。
1.2.10 红曲色素水溶液浊度的测定 运用WGZ-1A散射光浊度仪对红曲色素水溶液浊度进行测定。分别将零度水和富尔马肼倒入样品瓶中,液体凹液面与其刻度线齐平,然后拧紧瓶盖并擦拭干净瓶上的指印和水迹,然后置入样品座内盖上遮光盖,分别进行调零和校准。调零校准后同样方法对样品进行浊度测试,待数值稳定后即可记下红曲色素溶液的浊度值。
1.3 数据处理
应用Excel 2016软件进行数据统计、方程拟合和方差分析,采用Origin 8.5软件作图。
2 结果与分析
2.1 色素溶液以及添加金银花醇提物色素溶液的紫外吸收波长扫描图分析
图1中a红色素在486 nm处有最大吸收峰,与文献中所测最大吸收峰一样[15]。图c黄色素在466 nm处有最大吸收峰,与文献中的最大吸收峰相近[16]。图b、d与原始红曲色素溶液相比,添加了金银花醇提物后的色素溶液吸收特征在可见光部分没有显著变化,即金银花醇提物对红曲色素的吸收峰没有影响,根据Fuleki所做实验的结论,在没有其他介质干扰的情况下可以用最大吸收峰的吸光度值(Amax)来表示色素的含量[17]。
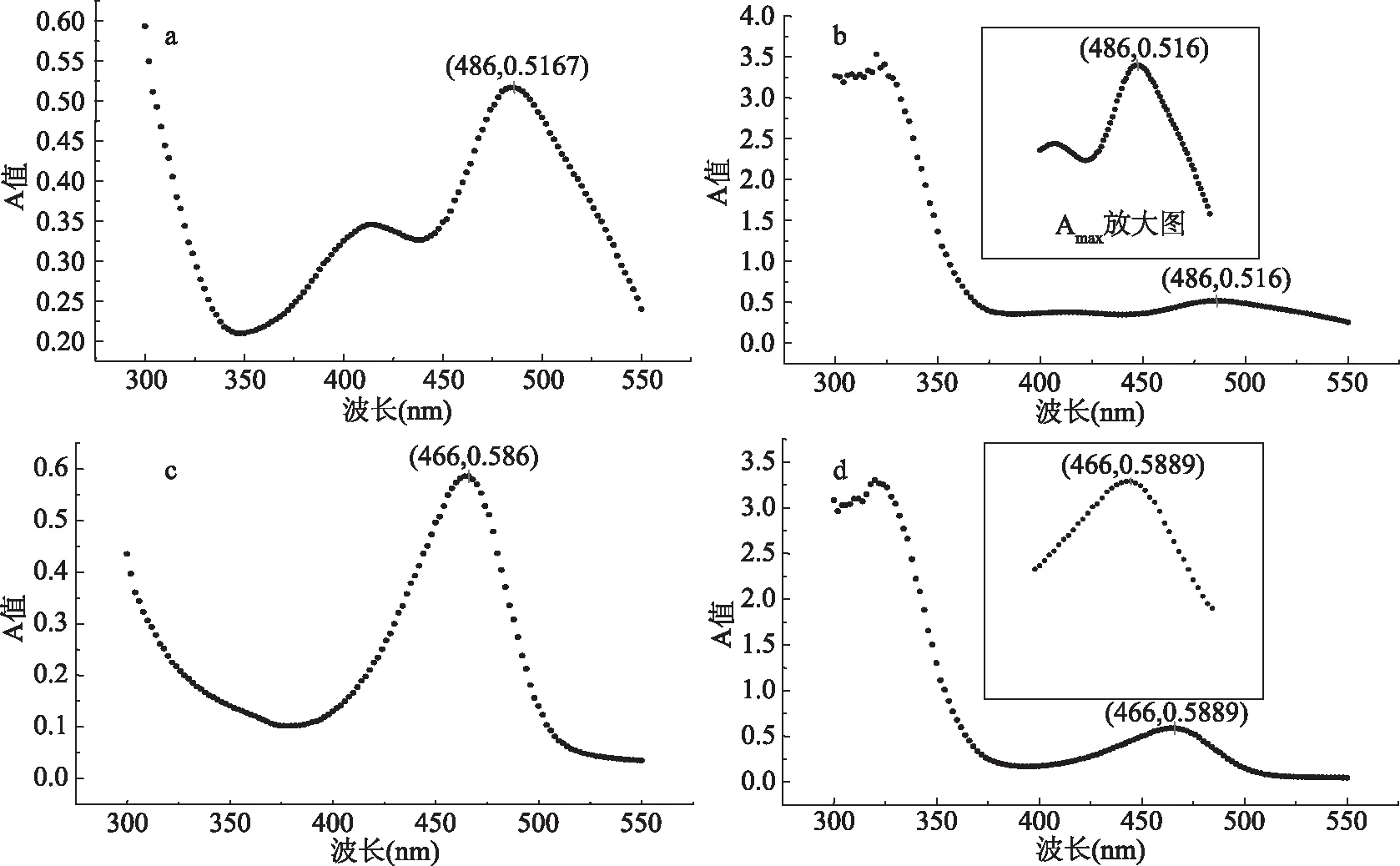
图1 水溶性红曲色素溶液吸收特征分析
2.2 两种水溶性色素紫外光降解动力学分析
由图2a可知,红色色素保存率与紫外照射时间负相关,距离紫外光源的距离越近下降速率越快[18]。在距离紫外光源16、12、8、4 cm条件下,每隔15 min取样一次并测其色素保存率。照射105 min后,色素保存率分别由100%下降到43.09%、34.98%、19.65%、8.90%;由图2b可知,黄色色素保存率由100%下降到36.95%、22.17%、12.77%、6.33%。随着紫外强度的增加和照射时间的延长,红色素和黄色素开始降解,颜色不断的变浅。由于随着紫外强度的增加和照射时间的延长,水溶液中发生光化学反应,产生大量的羟基自由基(·OH)等氧化离子,导致色素的光氧化降解[7]。由色素的光化学反应机理可知,色素光降解的反应速率公式为:dA/dt=-kA0,积分后为ln(A/A0)=-kt即A(%)=e-kt[19],式中A表示色素一定时间t照射后的色素含量,A0表示初始色素含量,A(%)表示色素保存率。表1中色素保存率和紫外照射时间(t)的回归方程可以看出,回归系数R2都大于0.9800,因此色素光降解过程中色素保存率A(%)与时间t符合一级动力学方程。
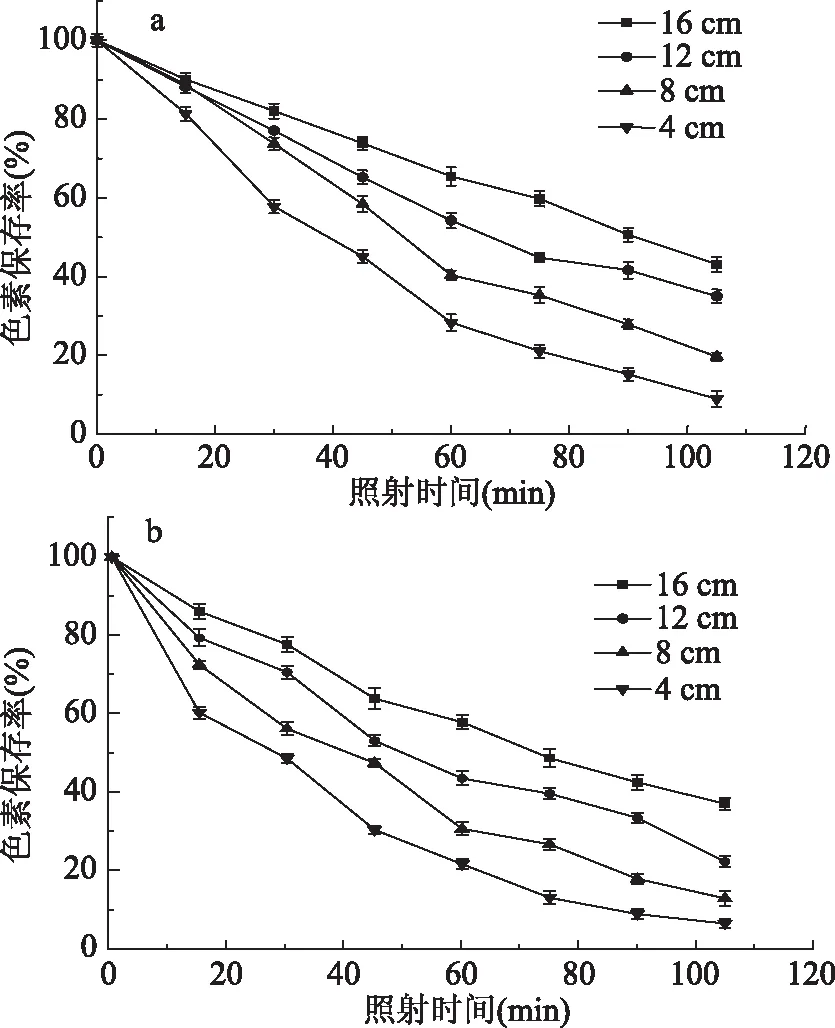
图2 不同光照强度条件下色素保存率与照射时间的关系
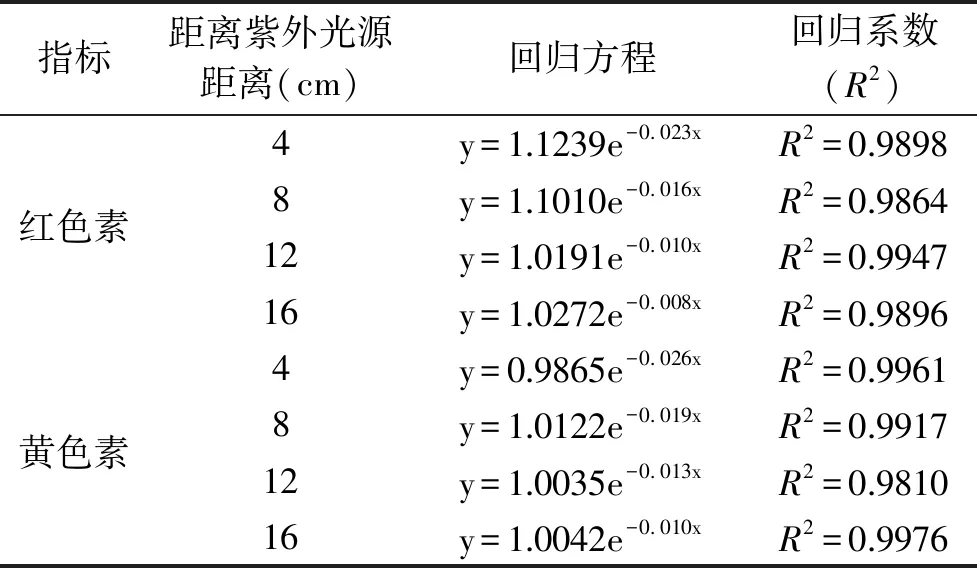
表1 色素降解动力学方程分析Table 1 Analysis of the degradation kinetics of pigments
2.3 金银花醇提物添加量的确定
由图3a可知,随着金银花醇提物浓度的增加,红色素保存率下降速度缓慢。在相同条件下照射180 min后,不同金银花醇提物浓度0.0、0.1、0.3、0.5、0.7、0.9 mg/mL色素保存率分别由100%减少到20.43%、42.80%、53.59%、55.27%、57.92%、60.72%。由图3b可知,随着金银花醇提物浓度的增加,黄色色素保存率下降速度缓慢。相同条件下照射180 min后,色素保存率分别由100%下降到19.12%、34.18%、42.22%、44.25%、46.53%、51.60%。可以看出随着金银花醇提物浓度的增加黄色色素保存率也不断的增加。但从0.5 mg/mL开始红色素和黄色素增长趋势均变缓慢。由图3c可知,随着金银花醇提物添加浓度的增加红色素水溶液的初始浊度开始增加,分别为2.13、11.87、15.00、17.57、21.40、22.60 NTU;由图3d可知,随着金银花醇提物添加浓度的增加黄色素水溶液的初始浊度也开始增加,分别为1.10、6.10、8.13、9.77、11.03、14.53 NTU。综合浊度、成本以及效果考虑我们选择金银花醇提物浓度为0.5 mg/mL为最佳添加浓度。
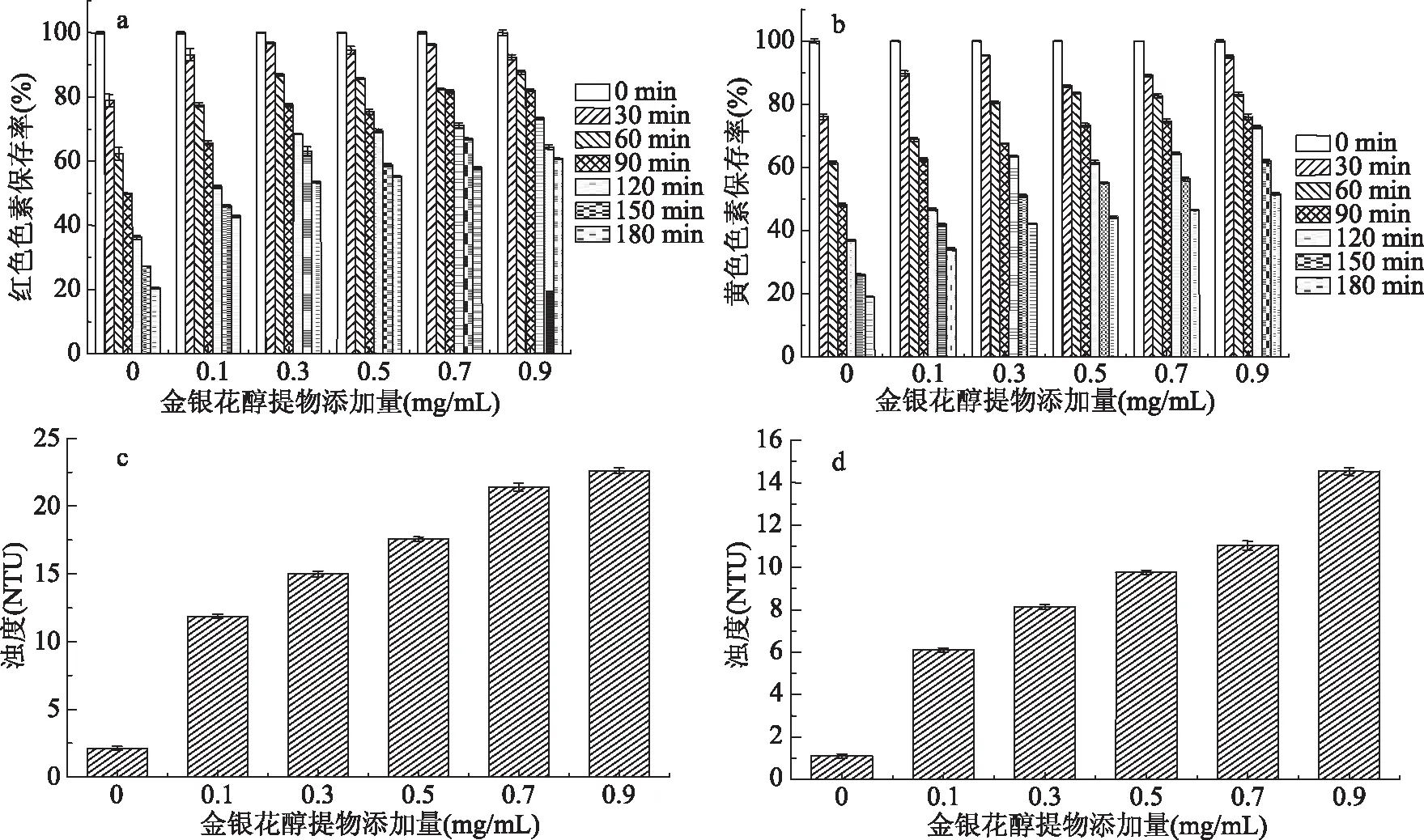
图3 金银花醇提物添加量对色素浊度的影响
2.4 酸性环境下金银花醇提物对色素光稳定性的影响
我国市场大部分饮料呈酸性,其pH在2.5~7.5之间[20]。水溶性红曲色素作为天然色素广泛地被应用到酒水、饮料当中。溶液过酸过碱都会使色素褪色降解[21],水溶性红曲色素在酸性饮料中的使用受到了限制[22]。由图4a可知,相同条件下照射180 min红色素水溶液在pH7、4条件下,空白组色素残存率分别由100%下降到了20.43%、11.95%;添加金银花醇提物色素残存率分别由100%下降到了56.26%、54.72%,色素保存率分别是空白组的2.75倍、4.58倍,因此金银花醇提物在酸性条件下有效地提高了红色素光稳定性。由图b可知,相同条件下照射180 min黄色素溶液在pH7、4条件下,空白组色素保存率分别由100%下降到了19.12%、8.07%;添加金银花醇提物色素残存率分别由100%下降到了52.58%、47.85%,色素保存率分别是空白组的1.75、5.93倍,因此金银花醇提物有效地提高了色素的酸稳定性。
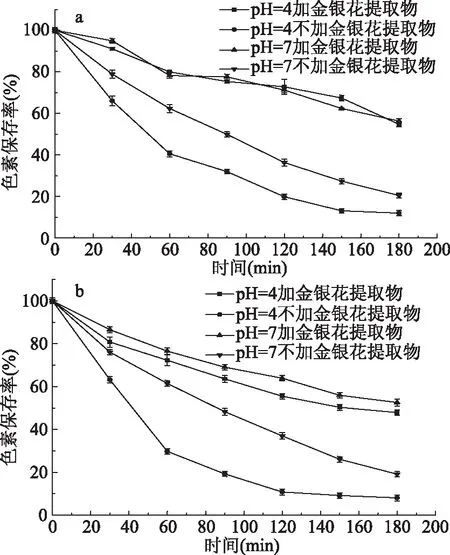
图4 不同pH条件下金银花醇提物对色素光稳定性的影响
2.5 金银花醇提物护色部分有效物质的分析
研究表明金银花中含有很多抗氧化物质,如绿原酸、槲皮素、芦丁、木犀草素等,其中含量最多的是绿原酸[14],本文采用高效液相色谱法对其有效物质进行定性定量检测。由图5a可知,通过对绿原酸、芦丁、槲皮素标准品进行HPLC分析,保留时间分别为7.19、20.30、34.08 min。由图5b可知,金银花醇提物溶液主要含有绿原酸和槲皮素不含芦丁。由绿原酸回归方程y=12258x-92.325,槲皮素回归方程y=34736x-94.721计算,可得出金银花醇提物中绿原酸和槲皮素的含量分别为108.13、25.19 mg/g。
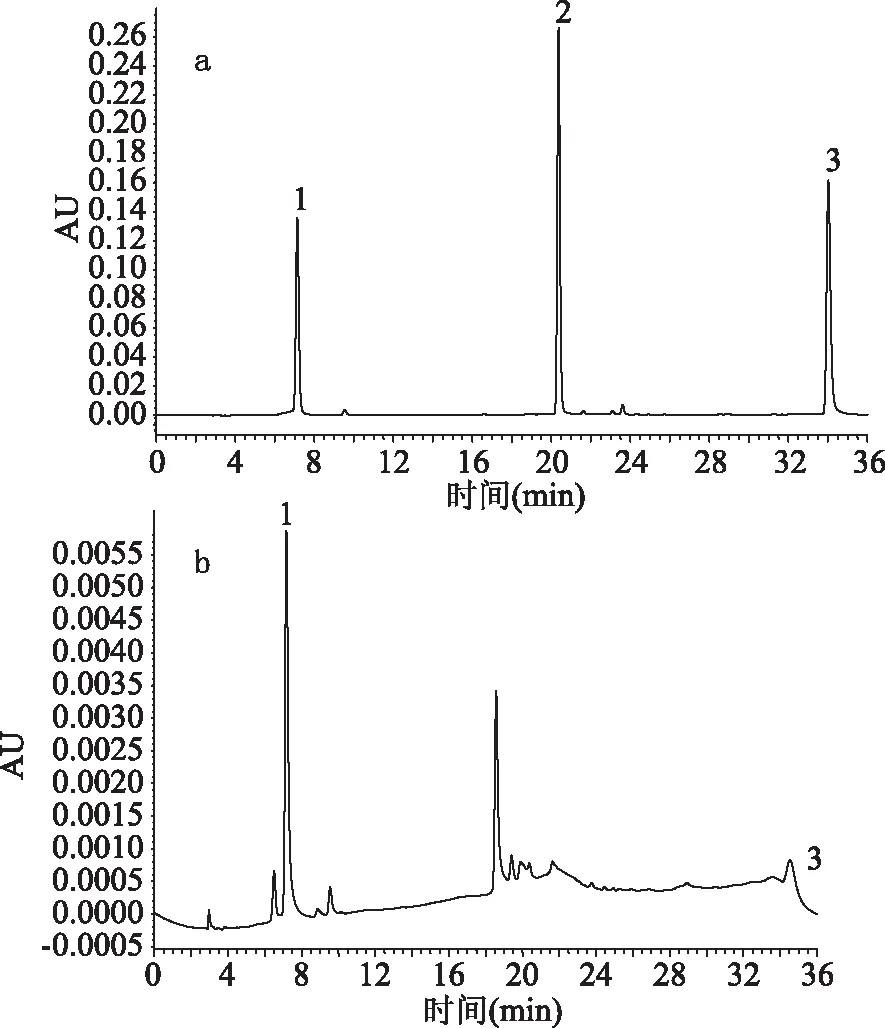
图5 绿原酸、芦丁、槲皮素和金银花醇提物的HPLC分析图
2.6 金银花醇提物和绿原酸的护色作用效果
通过图6中的a、b可以看出,金银花醇提物和绿原酸以及VC对红色素和黄色素的光稳定性都有较好的作用。对于红色素在相同条件下照射180 min,对照组、0.5 mg/mL VC色素溶液、0.5 mg/mL金银花醇提物色素溶液、0.5 mg/mL绿原酸色素溶液色素保存率分别由100%降到27.20%、55.05%、59.37%、49.44%。可以看出金银花醇提物的护色效果最佳,其次是VC和绿原酸,色素保存率分别是空白对照组色素保存率的2.18、2.02、1.82倍。所以金银花醇提物和绿原酸都具有良好的护色效果。对于黄色素相同条件下照射180 min,对照组、0.5 mg/mL VC色素溶液、0.5 mg/mL金银花醇提物色素溶液、0.5 mg/mL绿原酸色素溶液其色素保存率分别由100%降到13.79%、48.14%、44.06%、35.34%。可以看出对于黄色素护色效果最好的是VC,其次是金银花醇提物和绿原酸,分别是对照组色素保存率的3.49、3.20、2.56倍。因此金银花醇提物对水溶性红曲色素就有很好的护色效果,通过绿原酸的护色作用可以看出,金银花醇提物的护色作用可能与绿原酸的存在密切相关。
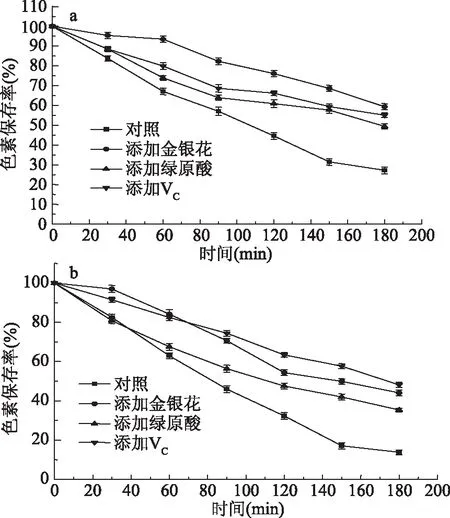
图6 金银花醇提物护色效果及有效物质分析
3 结论
水溶性红曲红色素和水溶性红曲黄色素都会发生光降解反应,且光照强度越强降解速率越快,符合一级降解动力学方程。结合添加金银花醇提物后色素溶液的浊度(NTU),确定金银花醇提物最优添加量为0.5 mg/mL,紫外照射180 min红色色素保存率可以达到56.26%(空白组20.43%);黄色色素保存率可以达到52.58%(空白组19.12%)。在pH=4的条件下,红色素和黄色素添加金银花醇提物的色素保存率分别是空白组的4.58、5.93倍。因此金银花醇提物能有效提高水溶性红曲红色素、黄色素的保存率以及酸性条件下的光稳定性。通过HPLC分析,金银花醇提物中含有大量的绿原酸,红色素以及黄色素溶液中分别添加0.5 mg/mL绿原酸,色素保存率分别是空白组的2.18、3.20倍,因此金银花醇提物的护色作用与其所含绿原酸密切相关。金银花醇提物作为纯天然的红曲色素护色剂,其成本低,天然无害,具有很好的应用前景。
