新型纳米模拟酶在食品安全分析中的应用进展
2019-08-28关桦楠龚德状
关桦楠,宋 岩,龚德状,刘 博,张 娜
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
食品安全问题关系国计民生,一直是社会各界广泛关注的焦点[1]。在食品科学领域,酶及其制剂一直被广泛应用于各个方面。酶法食品分析具有快速分离相似待测物、检测条件易实现、检测速度快等优势,可以用于指示食品生化状态。但由于天然酶成本高、难于纯化和贮藏条件苛刻等问题。在实际食品安全检测中,食品分析常采用其他化学分析方法和仪器分析法,普遍存在着样品制备繁琐、灵敏度和准确度较低、需要专业技术人员和昂贵的设备作为支撑、难以满足现场快速检测的要求等缺点[2]。随着纳米材料的开发、制备及应用的成熟,纳米粒子已成为监测食品安全性的分析工具。基于无机纳米材料的新型纳米模拟酶可代替传统酶应用于酶检测法,为食品分析领域提供一项方便快捷、稳定性好、灵敏性高且特异性强的快速检测方法[3]。本文综述了新型纳米模拟酶的理化性质、种类,以及在食品安全分析中的应用进展,旨在为更好地利用新型纳米模拟酶材料,进一步研究开发并将其与电化学法、比色法等检测方式的结合提供参考,为新型纳米模拟酶的性能优化及拓宽应用领域提供理论依据。
1 新型纳米模拟酶的概述
1.1 纳米酶的理化特性
由于其独特的纳米级特性,如高稳定性、可比活性、生物相容性和低成本,已成为替代天然酶的新型替代材料。基于纳米材料表面的物理化学性质,为改变纳米粒子的固有性质、改善催化活性、拓宽纳米材料应用范围,近年来通过形貌粒径调控、化学掺杂、表面修饰和材料复合设计等改善了纳米酶的性能,灵敏调节纳米酶活性的外部触发因子,实现了催化性能可调控、耐受性强、可重复利用的性能突破[4-6]。
1.2 纳米酶的优势
纳米酶,也称纳米模拟酶,即具有某种或某些酶特征的纳米材料。几十年来具有催化活性的纳米材料被广泛开发用来模拟天然酶[7]。纳米模拟酶是一种新型的酶模拟物,不仅具有纳米材料的独特性能,而且具有天然酶的催化活性。与天然酶和常规人工酶相比,纳米酶功能上可依赖于尺寸修饰和生物偶联的大比表面积,实现催化等其他功能,和对外部刺激的智能响应;应用上具有制备简单、稳定性高、成本低廉、易于保存运输、环境耐受性高等优点[7]。不同的材料可以催化类似的反应,其中大部分是氧化还原反应。其机理在于多数无机纳米材料具有氧化还原性质,且其反应的机理与酶的催化过程类似。而反应过程中氧化产物的颜色或荧光变化,以及某些底物的颜色变化,都使其成为检测应用的理想选择[8]。同时,模拟酶的开发也打破了一些天然酶应用的限制,克服了其稳定性差、提取困难、价格昂贵、催化活性易受多种物理、化学等因素影响而失活的缺陷[9]。
2 新型纳米模拟酶材料的种类
近年来,多种纳米材料被发现可以模拟天然酶的活性,主要包括金属纳米材料、金属氧化物纳米材料、碳基纳米材料、金属有机框架(Metal-organic frameworks,MOFs)、硫化物纳米材料、生物质复合纳米材料和其它纳米材料[10]。
2.1 金属纳米模拟酶材料
金属纳米材料应用较多的是贵金属,如金纳米粒子及纳米棒、银纳米粒子和铂纳米粒[11]。还有一些双金属和其它金属纳米材料,如Au@M(M=Bi,Pd和Pt)纳米材料,Ag@M(M=Au,Pd和Pt)纳米材料[12]。
金属氧化物纳米材料应用较多的为铁氧化物纳米材料和铈氧化物纳米材料,其中铁氧化物纳米材料可作为类过氧化物酶、类过氧化氢酶、类氧化酶等[13],二氧化铈纳米材料可作为超氧化物歧化酶、类过氧化氢酶、类氧化酶等[14]。除此之外,已开发的还有钴氧化物纳米材料(Co3O4)[15],铜氧化物纳米材料(CuO)[16],锰氧化物纳米材料(MnO2)[17],钒氧化物纳米材料(V2O5/V2O3)[18-19],钛氧化物纳米材料(TiO2)[20],钼氧化物纳米材料(MoO3)[21],钌氧化物纳米材料(RuO2)[22],双金属氧化物MFe2O4(M=Co,Mn,Zn)[23-25]等。
2.2 碳材料纳米模拟酶材料
碳基纳米材料包括碳纳米管[26]、石墨烯及其衍生物[27]、碳纳米点[28]、碳纳米角[29]、碳纳米团簇[30]等,都具有一些酶的活性。金属有机框架(MOFs)是指由金属离子与有机配体通过配位键连接而成的具有无限结构的多孔材料,种类繁多,也可以模拟天然酶的催化活性[31]。
2.3 氧化物及其复合体模拟酶材料
硫化物纳米材料,如CuS、MnSe、FeSe,硫化物的模拟酶活性,相比于金属氧化物模拟酶在酸性条件下稳定性更好,同时拓宽了硫化物纳米材料的应用范围[32-34]。
复合纳米材料是通过组装不同的纳米酶材料,形成的复杂高效的纳米酶复合体,如Au-Fe3O4复合物,氧化石墨烯(rGo)-Fe3O4纳米复合物[35-36]。
此外,还有一些其它纳米材料。普鲁士蓝纳米颗粒也被证明在特定条件下具有多酶性质[37]。少量金属氢氧化物也被发现可以有效模拟酶的催化性质,如Cu(OH)2、CoFe的双层氢氧化物[38-39]。
发展至今,纳米材料可用来模拟多种酶活性,常用的包括过氧化物酶模拟酶、过氧化氢酶模拟酶、氧化物酶模拟酶、超氧化物歧化酶模拟酶、核酸酶模拟酶、酯酶模拟酶、葡萄糖氧化酶模拟酶和亚硫酸氧化酶模拟酶等,这些纳米酶己被广泛应用于生物传感、免疫分析、疾病诊断与治疗、食品安全控制和检测及环境监测等领域。其所模拟的活性酶种类、特点及应用范围详见表1。

表1 纳米材料模拟酶活性特点及应用范围Table 1 Characteristic and application range of nano-enzyme mimetics activity
3 新型纳米模拟酶在食品安全分析中的应用
3.1 新型金属模拟酶在食品分析中的应用
金纳米棒(GNRs)一直被用来提高Pt/Pd纳米粒子的表面积以增强其催化活性。Biswas等[45]首次提出了GNRs具有催化性能,合成了纵横比为2.8的GNRs开发新型纳米模拟酶用于农药马拉硫磷的简单比色抑制测定,其过氧化物酶活性比辣根过氧化物酶(HRP)和阳性金纳米颗粒高2.5倍,且稳定性高。GNR的催化活性与马拉硫磷浓度成反比关系。该测定方法特异性强,与有机磷酸酯和金属盐的交叉反应小于0.01%,灵敏度为1.78 μg/mL。该研究表明,GNRs具有固有的过氧化物酶活性,这种催化活性可能是由于其表面的正电荷有助于过氧化物自由基的产生和部分电子的转移过程。GNRs的催化活性在广泛的pH和温度范围内表现出较强的稳定性。此外该研究首次提出了基于GNRs 酶模拟活性与马拉硫磷浓度之间的反比关系制备简单比色法的概念,可进一步提高检测的灵敏度应用于马拉硫磷的测定。GNRs的催化活性显示出巨大的潜力,可用于开发各种分子的检测。
金纳米簇(Au NCs)是一种新型的酶模拟物,与天然酶相比,在严苛条件下具有更好的稳定性。Fang等[46]以简便、低成本的方法获得了荧光蛋壳膜模板金纳米簇(Au-ESM),并通过与谷胱甘肽(GSH)的反应过程调节Au-ESM的过氧化物酶活性。此外,模拟酶膜的催化活性可以通过抗原-抗体反应来调节。在目标分子调节催化活性的基础上,建立免疫法比色测定葡萄球菌肠毒素(SE-B)。该比色法可在0.4~20 ng/mL的浓度范围内检测SE-B,检出限为0.12 ng/mL。在实际应用中,所提出的比色分析可进一步用于检测面粉,玉米和大米等食品样品中的SE-B,需要的样品量极低,具有很高的灵敏度和精密度,为食品中SE-B 的检测提供了快速现场筛选策略样品的方法,且成本低廉,可广泛应用。该项研究中的Au-ESM具有良好的发展前景,可作为目标分子检测平台,为开发具有生物医学和食品安全应用的诊断设备开辟新的途径。
Au@Pt 纳米材料是在GNRs的表面修饰上一层岛状的纳米铂点,He等[47]发现在GNRs外涂有由铂纳米点组成的外壳形成的Au@Pt纳米结构具有的氧化物酶、过氧化物酶和过氧化氢酶的活性,建立了一种基于Au@Pt NRs的酶联免疫吸附法(ELISA)检测小鼠白细胞介素2(IL-2)。与HRP相比,成本低、制备方便、稳定性高、催化活性好,完全克服了天然酶的缺点。此外,可以通过控制结构和合金成分变化进一步定制催化活性,整体结构通过借用内部Au核和Pt纳米点的外延生长而具有刚性和良好的光学响应,从而形成稳定有效的酶模拟活性,在生物催化、生物检测和纳米生物医学方面具有新的潜在应用。
双金属纳米材料可利用不同组分的协同效应实现多功能催化。Wu等[48]采用简便、绿色的方法合成了牛血清白蛋白生物分子支架(BSA-Bi/Pt NPs)中的双金属Bi/Pt纳米颗粒。由于铋的改性,与Pt NPs相比,Bi/Pt NPs增强了过氧化物酶的催化活性。此外,在高温、极端pH环境、高离子强度等恶劣条件下以及在常见的生物矩阵中都具有高稳定性。这些突出的优势使Bi/Pt NPs可以广泛应用于生物检测领域,如血糖检测,细胞外过氧化氢(H2O2)监测,癌细胞标记等,并取得了令人满意的结果。其中,葡萄糖的检出限为0.2 mmol/L,线性检测范围为1~100 mmol/L。BSA-Bi/Pt NPs可以增强底物的亲和力,可广泛应用于食品分析或医药分析领域。
3.2 新型金属氧化物及其复合体模拟酶在食品分析中的应用
纳米Fe3O4过氧化物是催化领域应用的热点。Ding等[49]基于Fe3O4磁性纳米颗粒的模拟酶活性,以2,2′-联氮-二-3-乙基苯并噻唑啉-6-磺酸二铵盐(ABTS)为底物,建立了Fe3O4MNPs-H2O2-ABTS检测系统,比色测定乳制品中的三聚氰胺。检测过程中,三聚氰胺优先与过氧化氢反应,以减少在Fe3O4MNPs催化下使ABTS氧化显色的过氧化氢量,通过过氧化氢的消耗量实现对三聚氰胺的定量检测。检测时间不超过1 h,检测限为 2.5 mg/kg,回收率在98%~115%之间。该传感器构建方法简便,而且可以在不借助任何仪器的情况下,在视觉上评估三聚氰胺的存在。刘细祥等[50]建立了过氧化氢-甲基橙-纳米四氧化三铁模拟酶催化反应体系。其原理是在pH=1.42的HCl-NaAc介质中,纳米Fe3O4可催化双氧水产生羟基自由基迅速氧化甲基橙,体系颜色由红色逐渐变浅,直至完全褪去,吸光度差随H2O2浓度的增加而线性降低。该体系用于食品中痕量双氧水的测定,在优化的条件下,该方法的线性范围为1.17~35.2 μmol,检出限为0.6 μmol/L。该方法弥补了纳米Fe3O4催化氧化甲基橙分光光度法检测H2O2的空白,且兼具光度法的简便性、催化法灵敏度高和成本低等优点,具有广阔的应用前景。
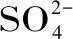
纳米模拟酶与比色技术的结合,为食品比色分析检测构建了一个新平台。Qin等[52]发现Co3O4NPs具有氧化酶活性,可以催化氧化显色底物3,3′,5,5′-四甲基联苯胺(TMB)形成有色产物,亚硫酸盐的存在抑制了Co3O4-O2-TMB反应体系并引起反应体系颜色的变化。机理为Co3O4NPs的氧化酶活性可能源于它们在过氧化物酶底物和吸附在Co3O4NPs表面上的氧气分子之间转移电子的能力,电子传递促使TMB被氧化而发生显色反应,传递后又恢复到最初状态,而亚硫酸根离子空间位阻小于大分子TMB,因此同时存在时会被优先吸附到Co3O4表面而阻止显色反应。基于此机理建立了测定亚硫酸盐的比色法,用于检测百合干、山楂卷及粉丝等食品中的亚硫酸盐,该方法线性关系良好,检测范围为 0.2×10-6~1.6×10-5mol/L,最低检测限为5.3×10-8mol/L,回收率为93.8%~100.5%。Wang等[53]将金纳米颗粒(AuNPs)中掺杂了Fe3O4NPs合成Au@Fe3O4纳米材料,由于AuNPs和Fe3O4NPs之间的协同作用,Au@Fe3O4纳米材料的过氧化物酶活性得到有效增强。在此基础上,开发了一种比色适体传感器用于谷物和豆类食品中赭曲霉毒素(OTA)的检测,具有高特异性,检测限可以达到30 pg/mL,花生和谷物中OTA的回收率分别为92%~97.2%和96%~108.1%。
在比色分析的基础上,模拟酶催化理论还可以与化学发光体系相结合。Zhang等[54]发现CoFe2O4NPs具有氧化酶活性,在典型底物TMB、ABTS和邻苯二胺(OPD)的催化作用下,CoFe2O4NPs可以通过在NaAc缓冲液中溶解的O2催化底物氧化,并产生典型的颜色反应,鲁米诺通过溶解氧氧化产生微弱的发射光,CoFe2O4NPs可强化化学发光(CL),峰值位于430 nm左右(与3-氨基邻苯二甲酸酯的最大发射光谱相同)。在相对较低的浓度水平下,亚硫酸盐对系统有抑制作用,反之则具有增强效果。两种状态下系统的发光体3-氨基邻苯二甲酸酯阴离子(3-APA*)都处于兴奋状态,如图1所示。在讨论鲁米诺-CoFe2O4NPs-亚硫酸盐CL系统可能机理的基础上,建立了流动注射化学发光法测定痕量亚硫酸盐。在最佳条件下,该系统可以响应低至2.0×10-8mol/L的亚硫酸盐。该方法已用于白葡萄酒样品中痕量亚硫酸盐的测定,与标准滴定方法给出的结果一致。该研究较好的改良了检测体系的灵敏度,拓展了模拟酶催化检测的应用范围,将会成为食品分析技术改良的一个新方向。
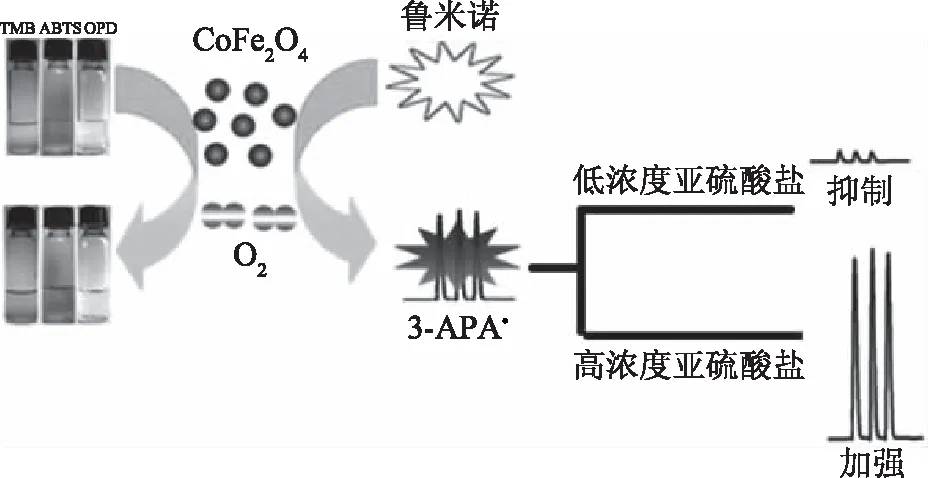
图1 鲁米诺-CoFe2O4 NP-亚硫酸盐发光系统的构建原理[49]
3.3 新型碳材料模拟酶在食品分析中的应用
选择性制备所需结构的复合材料对于提升模拟酶的催化活性具有重要意义。Qian等[55]合成了Fe3O4/石墨烯纳米复合材料(Fe3O4NPs/rGO),基于其对TMB显示出较高的过氧化物酶活性构建比色平台。利用乙酰胆碱酯酶和胆碱氧化酶的特异性催化反应选择性检测乙酰胆碱含量,应用于实际牛奶样品中的检测,具有较高的置信度和实用性,平均回收率为87.2%~115.2%。
为结合多种改性纳米粒子的表面功能及催化活性的应用而开发不同的传感器,Margarita等[56]用Cu2+-改性氮化碳纳米粒子(Cu2+-g-C3N4NPs)和Cu2+-改性碳点(Cu2+-Cdots)作为催化剂模拟辣根过氧化物酶的功能,在鲁米诺-H2O2的存在下可以产生化学发光,并催化H2O2氧化多巴胺形成氨基色素。研究发现,这两种Cu2+改性纳米粒子扩大了过氧化物酶活性的pH范围,且表面功能可以经过化学单元(如环糊精)的进一步改性来增强其催化功能。Cu2+-g-C3N4NPs可用于开发H2O2传感器,葡萄糖检测平台和葡萄糖氧化酶探测传感器。碳点经改性后,催化效果增强了4倍。利用碳材料高效复合金属离子和氮化物,可将几种具有良好模拟酶活性的粒子的优势在一起,改善催化效果,提升催化速率,进而改良检测体系的灵敏度和特异性。
二肽(FF)-多金属氧酸盐(POMs)-氧化石墨烯(GO)三元杂化物是一种优异的过氧化物酶样模拟物。Zhuo等[57]通过再沉淀法制备该杂化物,经复聚策略获得FF和POMs的超分子组合。在室温条件下,将含有PW12和FF的乙醇溶液以摩尔比1∶3添加到水中,立即产生了丁达尔效应,导致化合物的沉淀。然后进行阳离子二苯丙氨酸肽静电包封H3PW12O40(PW12)和FF@PW12球与氧化石墨烯(GO)的组装,见图2。

图2 FF@PW12@GO复合体模拟酶构建示意图[57]
由图2可知,使用TMB作为显色底物,在非均相中评估了FF@PW12的过氧化物酶活性,在均质中比原始无包封剂的PW12高13倍。此外,含有重量百分比为5% GO的FF@PW12@GO的三元杂化物可以比FF@PW12的活性提高1.7倍。推测GO和POM之间的氢键和离子的非共价相互作用会产生增强过氧化物酶活性的协同效应[57]。利用TMB对紫外可见光的吸收程度与H2O2的浓度的相关性,FF@PW12@GO可被用来检测H2O2,检测限为0.11 μmol/L,检测范围为1~75 μmol/L。将三个独立组分集成到一个系统中,从而产生了协同作用,对整体催化性能做出贡献。为使用POMs引入GO构建H2O2提供了有效途径[57]。
3.4 新型金属有机框架纳米模拟酶在食品分析中的应用
3.4.1 金属有机框架纳米模拟酶在食品分析中的应用 金属有机框架(MOFs)是一种具有柔性结构的功能材料。Qi等[58]设计并制造了一种能够为过氧化氢的催化反应发出荧光的PA-Tb-Cu MOF双功能纳米酶,不仅具有优异的催化活性,而且可以实时荧光指示催化过程中H2O2的浓度直至低至0.2 μmol/L。这种纳米酶由发光Tb3+,催化Cu2+和邻苯二甲酸(PA)作为桥接配体组成。Tb3+是一种发光离子且具有较长的荧光寿命,Cu2+是许多辅基的关键催化中心。酶催化反应直接由功能性离子/分子组装,用于取代天然酶和显色剂的常见组合使用。另外,基于Tb3+的发光纳米酶不受生物系统自发荧光的影响。Qi等进一步利用PA-Tb-Cu MOF和抗坏血酸体系测定牛奶样品中的H2O2,PA-Tb-Cu MOF和AA的发光催化分析反应见图3。牛奶样品中的H2O2测量回收率为91.50%~108.5%,该方法能够满足牛奶中的H2O2测定,具有较高的精度和良好的重复性。
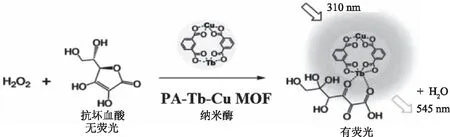
图3 用PA-Tb-Cu MOF纳米酶催化抗坏血酸+H2O2体系[58]
3.4.2 共价有机框架纳米模拟酶在食品分析中的应用 共价有机框架(Covalent organic frameworks,COFs)应用广泛,是近来备受关注的多孔聚合物。然而,COF材料作为酶模拟物的催化应用仍然在很大程度上未被探索。Wang等[59]首次成功合成铁-卟啉-基于共价有机骨架(铁-COF),在H2O2存在下,Fe-COF可以催化底物TMB以产生颜色,表明它具有过氧化物酶活性。此外,动力学研究表明Fe-COF纳米材料对基质H2O2和TMB的亲和力高于天然酶辣根过氧化物酶(HRP)。在优化条件下,将Fe-COF纳米材料应用于比色传感器中,用于H2O2的灵敏检测。检测范围为7~500 μmol/L,检测限为1.1 μmol/L。此外,Fe-COF与葡萄糖氧化酶(GOx)相结合,可采用一锅法测定葡萄糖,如图4所示,检测范围为5~350 μmol/L,检测限为1.0 μmol/L。作为过氧化物酶的模拟物,具有制备简便、稳定性好、催化效率高等优点。基于以上方法,有助于促进COF复合材料作为酶模拟物的应用。

图4 Fe-COF作为催化剂的葡萄糖检测比色传感器的原理示意图[59]
3.5 新型生物质复合型纳米酶在食品分析中的应用
作为分析化学的一个重要研究领域,葡萄糖生物传感器由于其在各领域的广泛应用而备受关注。Wang等[60]制造了一个人工酶体系GOx@ZIF-8(NiPd)纳米花实现串联催化,如图5所示。通过简单的共沉淀,纳米酶(NiPd空心纳米粒子)和天然酶(葡萄糖氧化酶)同时固定在ZIF-8上。GOx@ZIF-8(NiPd)不仅表现出NiPd的过氧化物活性,而且保持了GOx的酶活性。利用OPD作为显色基板,生成黄色氧化产物邻苯二甲酸二丙烯酯(DAP),可以在一个步骤内实现葡萄糖视觉检测的级联反应。该体系为纳米粒子与天然酶之间的合作架起了桥梁,结合了各自的功能特性,实现了高效的串联催化反应,建立了一种用于检测葡萄糖的安培生物传感器。
图5 GOx@ZIF-8(NiPd)人工酶系统串联催化示意图
金纳米粒子已被证明是具有天然葡萄糖氧化酶活性的有效纳米粒子,它可以催化葡萄糖氧化,生成H2O2。以金纳米粒子具有酶活性为基础,Lin等[61]研制了一种混合催化剂,如图6所示。石墨烯-中孔二氧化硅混合物(GS)被用作纳米容器,在不同的位置固定金纳米粒子(用作GOx模仿剂)和生物质血红素(用作过氧化物酶类似物),含有多个催化位点的集成催化剂可用于催化反应,而无需真正酶的帮助。这两种方法都可以在串联催化反应中成功地用于葡萄糖检测。

图6 GSHA系统中串联反应示意图[55]
4 结论与展望
本文总结了近年来新型纳米模拟酶在食品分析方面的研究进展。新型纳米模拟材料的不断开发应用正在逐渐拓宽其在各个领域的应用范围。在食品分析领域,纳米模拟酶催化效率高,成本低,稳定性好,易于制备和储存的优势,逐渐取代了天然酶的应用。虽然纳米模拟酶的应用已经取得了很大进展,但在这一前沿仍然面临许多挑战。鉴于天然酶的多样性,今后的工作重点应放在设计具有新催化性能的纳米粒子上。大多数纳米酶很难像天然酶那样催化一种特定的底物,因此为了模拟复杂的天然酶系统,不仅要提高纳米粒子的选择性,还要根据纳米粒子和天然酶的性质功能将二者结合,完成可以高效催化的人工酶系统的组装,为智能、多功能人工酶的设计开发提供新的途径。另外,有必要开发合适的纳米酶来构建基于酶的电化学生物传感器,基于纳米粒子的表面改性调整其催化活性在生物传感应用中的作用。为扩大纳米模拟酶应用范围,可以将具有特殊纳米性能的纳米粒子相结合产生协同作用效果。最后,还需深入挖掘与完善纳米粒子模拟天然酶的详细催化机制和理论。
