大豆蛋白及其水解物的界面流变学行为和搅打性质
2019-08-28张晓敏何志勇曾茂茂
张晓敏,何志勇,2,曾茂茂,秦 昉,陈 洁,2,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.江南大学食品安全国际合作联合实验室,江苏无锡 214122)
大豆广泛生长在世界各地,大豆的蛋白质含量很高,约占大豆总含量35%~40%。大豆蛋白含有人体所需的各种氨基酸,比例合理,营养价值高,是最具发展潜力的植物蛋白[1]。大豆蛋白不仅在营养方面有很多优点,在功能性质上也有出色的表现。大豆蛋白的凝胶性可以用于肉类、豆腐等食品的制作,乳化性可以用于咖啡伴侣中,而起泡性则是制作蛋糕、充气糖果和冰淇淋等泡沫体系食品的重要功能性质。但是天然的大豆蛋白起泡能力和泡沫稳定性并不是特别理想,不能满足实际应用的需要。目前常用物理改性[2]、化学改性[3]、酶法改性[4]等方法改善大豆蛋白的起泡能力和泡沫稳定性。
泡沫和乳液等食品分散体系的形成和稳定性与蛋白质在界面处的吸附和其它动态界面行为(例如膜粘弹性)息息相关。目前,常用界面流变学技术研究界面处蛋白质的吸附形成过程以及吸附层中分子间的相互作用[5]。7S是大豆蛋白中的一个重要组分,其乳化性和起泡性明显优于11S。胃蛋白酶选择性水解可以保留大豆蛋白的7S组分,水解11S组分。本实验室前期发现大豆蛋白经选择性水解11S后的产物,其乳化性卓越,可以媲美酪蛋白酸钠[6]。但是其起泡性的研究并没有进行,所以在此基础上,本文使用配备有Du Noüy环的旋转流变仪研究大豆分离蛋白(SPI)、β-伴大豆球蛋白(7S)、大豆蛋白选择性水解物(SPSH)及大豆蛋白限制性水解物(SPLH)在空气-水界面处的吸附层界面剪切流变行为和搅打性质,并与蛋清蛋白(EW)作对比。通过界面剪切流变学获得大豆蛋白的空气-水界面性质,分析不同结构对大豆蛋白界面剪切流变学行为和搅打性质的影响。
1 材料与方法
1.1 材料与仪器
大豆(台湾292)、鸡蛋 无锡欧尚超市;木瓜蛋白酶(>2000 U/mg) 生工生物工程(上海)股份有限公司;胃蛋白酶(3000~3500 U/mg) 上海斯信生物科技有限公司;低分子量标准蛋白质(14.4~97.4 kDa) 上海升正生物技术有限公司;正己烷、无水乙醇、十二烷基硫酸钠(SDS)、盐酸、氢氧化钠、无水亚硫酸氢钠、氯化钠等 均为分析纯,国药集团化学试剂有限公司。
JZ7114型粉碎机 上海朝阳微电机厂;Avanti J-26XP高速离心机 美国Beckman公司;GL-10MD大容量高速冷冻离心机 湘仪离心机仪器有限公司;LGJ-25C冷冻干燥机 北京四环科学仪器厂有限公司;HAAKE MARS Ⅲ流变仪 德国Thermo Scientific公司;Mini-PROTEAN3Cell凝胶电泳仪 美国Bio-Rad公司;DDQ-A40A1型电动打蛋器 小熊电器股份有限公司。
1.2 实验方法
1.2.1 大豆蛋白及其水解产物和蛋清蛋白的制备 按照Diftis等[7]的方法制备大豆分离蛋白(SPI)。将大豆去皮、粉碎,用正己烷∶无水乙醇=10∶1 (v/v)脱脂2 h,料液比1∶3 (w/v),使用真空循环水泵抽提,在通风厨内风干过夜,得到脱脂豆粉。脱脂豆粉加10倍(w/v)的水,用2 mol/L NaOH调节pH至8.0,室温搅拌2 h,离心(6500 r/min,20 min),取上清,将上清液用2 mol/L HCl调至pH至4.5,静置30 min,离心(3750 r/min,10 min),取沉淀,将沉淀加水复溶,调节pH至7.0,冷冻干燥后置于-80 ℃冰箱备用。
根据Ruíz-Henestrosa等[8]的方法稍作修改制备β-伴大豆球蛋白(7S)。将大豆去皮、粉碎、脱脂,脱脂豆粉加15倍(w/v)的水,用2 mol/L NaOH调节pH至7.5,室温搅拌2 h,离心(6500 r/min,20 min)。在上清液中加入0.98 g/L亚硫酸氢钠,用2 mol/L HCl调节pH至6.4,4 ℃静置过夜。离心(6500 r/min,20 min),在上清液中加入0.25 mol/L NaCl,用2 mol/L HCl调节pH至5.0,4 ℃搅拌1 h,再次离心(6500 r/min,20 min)。上清液加1倍(v/v)的水稀释,用2 mol/L HCl调节pH至4.8,搅拌1 h,离心(6500 r/min,20 min)。沉淀用去离子水清洗3遍,加水复溶,调节pH至7.0,冷冻干燥后置于-80 ℃冰箱备用。
大豆蛋白选择性水解产物(SPSH)由大豆蛋白分离物制备,根据Li等[6]的方法稍作修改。将7%(w/v)SPI溶液在55 ℃变性30 min,用2 mol/L HCl调节pH至2.0。将SPI溶液在37 ℃下用胃蛋白酶(E/S=1%)水解3 h。酶反应完成后,立即用2 mol/L NaOH将混合物调节pH至7.0,进行巴氏杀菌。离心(6500 r/min,20 min)后,将上清液冷冻干燥后置于-80 ℃冰箱备用。
大豆蛋白限制性水解产物(SPLH)由大豆蛋白分离物制备,根据Li等[6]的方法稍作修改。将5%(w/v)SPI溶液调节pH至7.0,在50 ℃的条件下加入木瓜蛋白酶(E/S=0.2%)水解至pH-stat法测得水解度为1.0%时停止水解。水解结束后将水解产物在沸水中加热10 min,并在冰水中冷却至室温。离心(6500 r/min,20 min)后,将上清液冷冻干燥后置于-80 ℃冰箱备用。
用分蛋器分开蛋清和蛋黄,蛋清液除去系带,在较低转速下搅拌均匀,制备蛋清蛋白(EW)。
1.2.2 聚丙烯酰胺凝胶电泳(SDS-PAGE) SDS-PAGE在4%浓缩胶和12%分离胶下进行。使用pH8.0的缓冲液,缓冲液中含有0.01 mol/L Tris-HCl,2% SDS,10%甘油和0.02%溴酚蓝。将浓度为0.2%(w/v)的SPI、7S、SPSH、SPLH和EW分别与等体积的缓冲液混合,在沸水中加热3 min,然后冷却。将试样(20 μL)上样到凝胶上。将样品用考马斯亮蓝R-250染色1 h,并用脱色液(甲醇∶乙酸∶水=2∶3∶35)脱色,直至背景褪色。
1.2.3 界面剪切流变学测量 根据Li等[6]的方法,使用配备有铂/铱(Pt/Ir)Du Noüy环的HAAKE MARS III流变仪测量待测样品在空气-水界面处的界面流变学。使用的Du Noüy环的直径为19.450 mm,厚度为0.379 mm。将20 mL浓度为0.5%(w/v)的SPI、7S、SPSH、SPLH和EW溶液分别置于烧杯(直径38 mm)中,将Du Noüy环降低至与溶液表面刚好接触。在开始每一系列测量之前执行惯量校准和MSC(微应力控制)校准以优化测量结果。
先进行第一次动态时间扫描,以γ=1%的应变振幅(在线性区域中)和ω=1 rad/s的角频率扫描1 h,记录弹性模量(G′)、粘性模量(G″)和复数粘度(η)随时间的变化。之后在ω=1 rad/s下,在γ=0.01%~100%的范围内进行动态应变扫描,记录弹性模量(G′)随应变振幅的变化。最后,进行第二次动态时间扫描,参数和第一次动态时间扫描一致,以观察应变扫描后的结构恢复,记录复数粘度(η)随时间的变化。所有测量均在室温下进行。
1.2.4 搅打起泡性测定 根据Li等[9]的搅打方法测量泡沫膨胀率(FE)和泡沫稳定性(FS)。将50 mL浓度为16%(w/v)的SPI、7S、SPSH、SPLH和EW溶液分别转移至500 mL塑料量筒中,然后用电动打蛋器以最高档搅打10 min。泡沫膨胀率(FE)和泡沫稳定性(FS)计算如下:
其中:V0是液体的初始体积;V1是泡沫的体积;V2是静置30 min后的泡沫体积。
1.3 数据统计
本文数据均进行三次重复;显著性差异使用Statistix 9.0软件进行统计;图片使用Origin 8.5软件绘制。
2 结果与分析
2.1 大豆蛋白及其水解物的SDS-PAGE
图1显示了SPI、7S、大豆蛋白选择性水解产物(SPSH)、大豆蛋白限制性水解物(SPLH)和蛋清蛋白(EW)的SDS-PAGE图谱。大豆分离蛋白(SPI)主要由7S和11S组成。7S是由α′(71 kDa),α(67 kDa)和β(50 kDa)三个亚基组成的糖蛋白,通过非共价键结合。从SDS-PAGE图谱中可以看出,自提的7S纯度不是特别高,还存在部分11S组分。11S由酸性亚基A(约35 kDa)和碱性亚基B(约20 kDa)组成,两个亚基通过二硫键形成稳定的AB亚基。SPI经胃蛋白酶水解得到的SPSH,11S亚基带消失,7S的三个亚基仍然存在,实现了大豆蛋白的选择性水解。SPI经木瓜蛋白酶水解得到的SPLH控制了水解度至1%,仅留下分子量约10 kDa的多肽链,几乎没有二级结构。蛋清中蛋白质种类很多,从SDS-PAGE中可以看出三个比较明显的条带。EW在35~45 kDa有一个很宽的条带,主要是卵白蛋白、卵球蛋白G2和卵球蛋白G3,70 kDa左右的条带为卵转铁蛋白,而10 kDa左右的条带为溶菌酶。
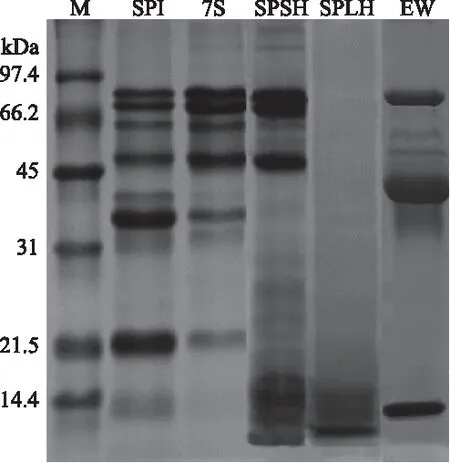
图1 大豆蛋白及其水解物的SDS-PAGE图谱
2.2 大豆蛋白及其水解物的界面剪切流变学行为
2.2.1 蛋白质吸附过程中的模量变化 泡沫的形成和稳定很大程度上取决于蛋白质在界面的吸附、展开、重排以及它们的相互作用。时间扫描实验可以监测界面处蛋白质的动态吸附过程[6]。图2显示了第一次时间扫描空气-水界面处蛋白质层的界面弹性模量(G′)和粘性模量(G″)随时间的变化。
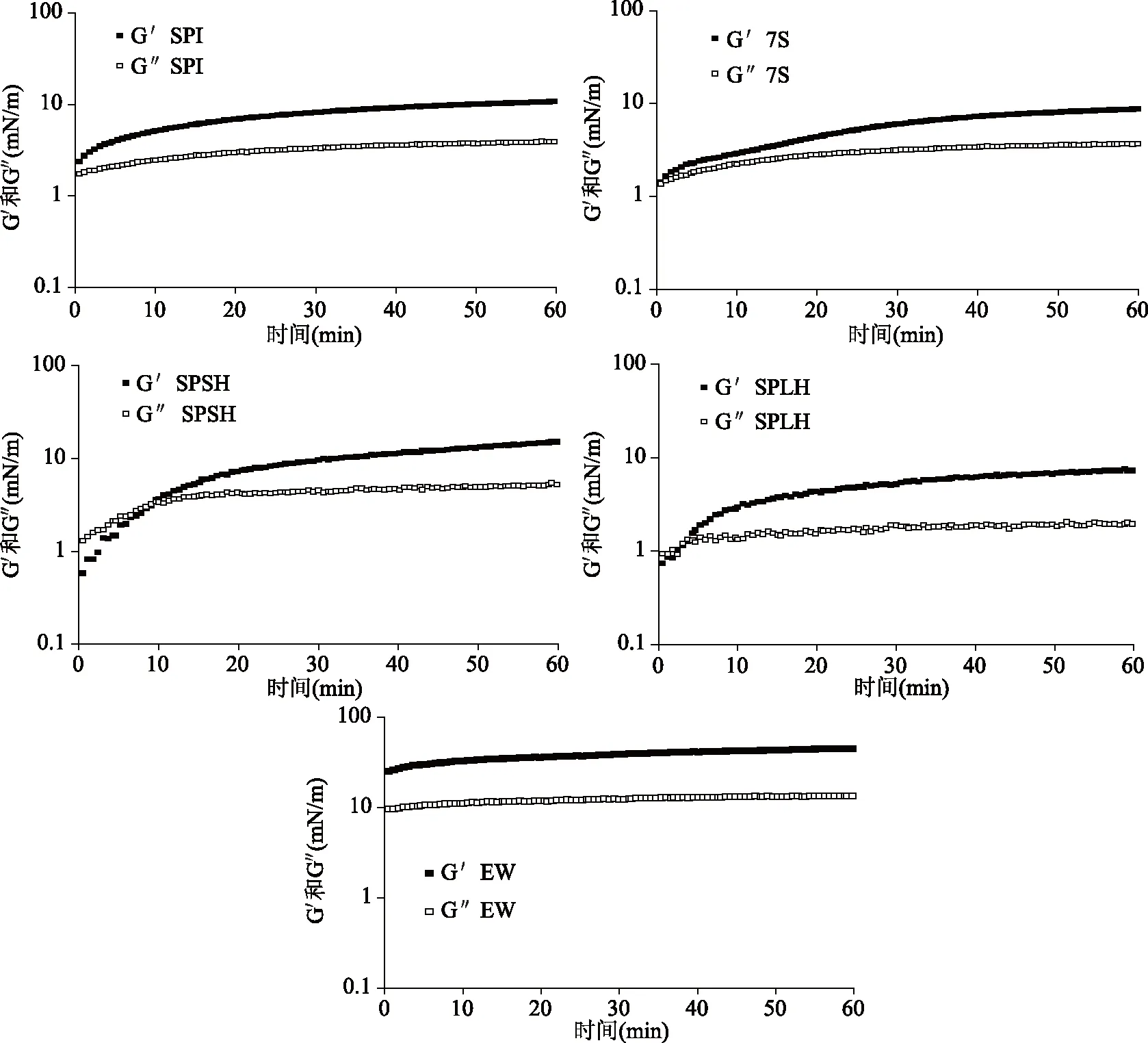
图2 蛋白质的弹性模量(G′)和粘性模量(G″)随时间的变化
从吸附开始,SPI和7S的弹性模量G′总是大于粘性模量G″,表明SPI和7S在空气-水界面处的界面膜一直是以弹性为主导的。而SPSH和SPLH,最初G″大于G′,但G″的增长速率较慢,G′迅速增加,增长幅度大于G″,并持续一段时间,在那之后,G′超过G″。不同结构的蛋白在界面吸附时的表现不同,SPI和7S为球状蛋白质,吸附至界面展开所需的能量较大,所以吸附速度较慢,而经过酶解的SPSH和SPLH分子量降低,多肽的结构更加灵活,所以开始时的G′比较小,但是可以快速地吸附至界面上,迅速增加粘弹性模量。Baldursdottir等[10]指出,球状蛋白质会在界面处展开和结构重排。G′和G″的增加有可能是界面处的蛋白质分子通过疏水相互作用建立网络结构[11],也可能是多层吸附结构的形成。球状蛋白质在界面处的相互作用更强,导致形成的界面膜粘弹性高于SPLH,而SPSH同时存在7S组分和多肽,既可以快速地吸附至界面,同时形成粘弹性强的界面膜。蛋清蛋白(EW)的G′和G″比SPI,7S,SPSH和SPLH大一个数量级,并且G′总是大于G″,表明由EW形成的界面膜在吸附过程中主要表现出弹性,粘弹性很强。随着吸附时间的增加,EW的G′和G″迅速增加,达到稳定,表明EW在吸附到界面后迅速产生结构重排,达到吸附平衡。EW具有较大的粘弹性模量和较快的吸附平衡,表明EW可以快速在空气-水界面形成强粘弹性界面膜,防止气泡积聚,从而保持泡沫的高稳定性。
2.2.2 吸附层结构断裂情况 为了研究蛋白质吸附层可能的结构断裂机理,进行了应变扫描实验。图3展示了不同蛋白质在空气-水界面处的弹性模量(G′)随应变的变化。
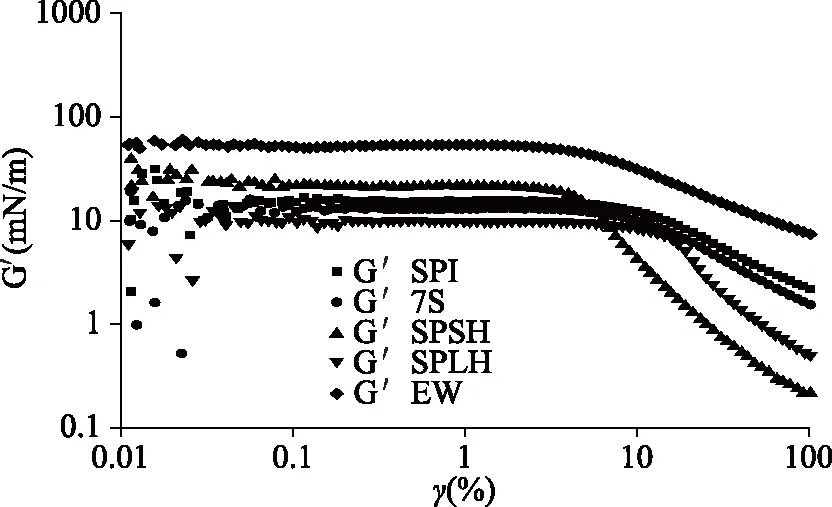
图3 蛋白质的弹性模量(G′)随应变振幅的变化
SPI和7S在空气-水界面处的吸附层表现出几乎相同的断裂机制。SPI的弹性模量略大于7S的弹性模量,差别不大,均约为10 mN/m。SPI和7S的线性粘弹性区域几乎没有显著差异,均约9%的应变幅度。曾有报道称大豆蛋白在空气-水界面处的线性粘弹性区的应变幅度小于0.2%[12]。SPSH的弹性模量大于SPI和7S,约为20 mN/m,表明一些小分子肽可以增加界面的粘弹性,但SPSH的线性粘弹性区小于SPI和7S,约6%的应变幅度。SPSH可以通过形成坚固的高粘弹性界面膜维持泡沫稳定性。虽然SPLH的弹性模量小于SPI和7S,但线性粘弹性区域大,超过10%,表明SPLH具有很强的抗变形能力,这可能是SPLH形成的泡沫稳定性高的原因。通常,线性粘弹性区域越长,凝胶结构越紧密,系统越稳定。EW具有约50 mN/m的弹性模量,显著高于SPI,7S,SPSH和SPLH,表明由EW形成的空气-水界面膜具有很强的机械强度。因此,蛋清蛋白在剧烈机械搅打后可形成长期稳定且大量的泡沫。
2.2.3 吸附层结构恢复能力 在应变扫描后快速进行第二次时间扫描,并且通过比较第一次和第二次时间扫描的复数粘度的变化来检测界面膜结构破坏后的恢复,结果如图4所示。复数粘度η是弹性模量和粘性模量的综合反映,可用于描述界面膜的总粘弹性变化。
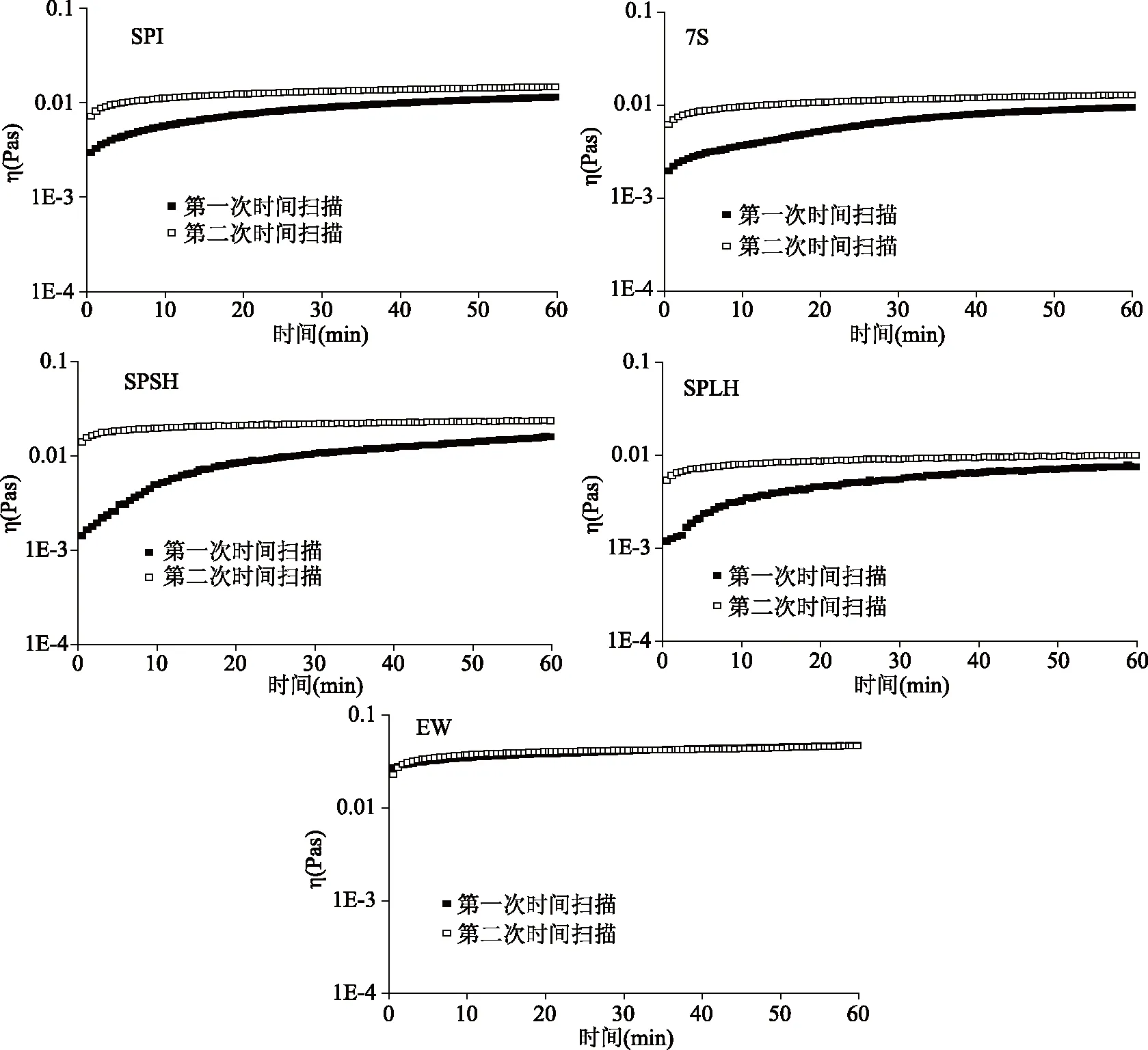
图4 蛋白质的复数粘度(η)随时间的变化
SPI,7S,SPSH,SPLH和EW的第二次吸附的复数粘度恢复非常快,并且最终的复数粘度都可以恢复到第一次吸附时的原始值。除EW外,其他四种蛋白质在时间扫描的60 min内无法达到吸附平衡。SPSH达到平衡所需的时间最长,其次是SPI和7S,SPLH最短。可能因为SPLH主要含有低分子量肽,几乎没有二级结构,所以达到吸附平衡时间最短。SPI和7S的分子量大,界面处的结构重排复杂,而SPSH含有大分子量7S和小分子量肽,蛋白和多肽相互竞争吸附,需要更多能量才能部分扩展到界面上,并且吸附在界面也是最复杂的。通常,更快的吸附速率表示更快地覆盖空气-水界面,有助于防止泡沫形成期间的聚集并促进更小气泡的形成。
2.3 大豆蛋白及其水解物的搅打起泡性质
泡沫的形成取决于空气-水界面处蛋白质分子的迁移,解析和重排。通过搅打法测量不同蛋白质的泡沫膨胀率(FE)和泡沫稳定性(FS)如图5所示。蛋白质的起泡性质基本上与它们在空气-水界面的吸附及其形成薄膜的性质有关[13]。对于SPI,泡沫膨胀率(FE)为450%,泡沫稳定性(FS)是88.89%。7S的FE为400%,7S的FS为87.5%。从界面剪切流变学也可以看出SPI和7S在空气-水界面的吸附速率很慢,导致SPI和7S的FE比较小。SPI和7S在空气-水界面形成的界面膜最终G′分别为10.73 mN/m和8.766 mN/m,粘弹性模量较高,这是因为SPI和7S为球状蛋白,分子间相互作用强,形成了以弹性为主导地位的界面膜,维持了泡沫的稳定性,泡沫稳定性较高。

图5 通过搅打法测量的不同蛋白质的泡沫膨胀率和泡沫稳定性
与天然大豆蛋白相比,通过酶处理可以大大提高大豆蛋白的起泡性能。酶水解改善了大豆蛋白的起泡性质,其对蛋白质的三种主要结构变化为:平均分子量的降低,疏水区域的打开,以及可电离基团的增加[14]。这些结构变化影响水解产物中肽之间的分子间相互作用,从而影响它们的起泡和界面行为。向日葵分离蛋白的泡沫稳定性也可以通过有限的水解而增加[15]。限制性水解产物SPLH的FE有所提高,为700%,FS为90%。这是因为SPLH主要含有小分子多肽,可以快速地吸附至界面上,迅速增加粘弹性模量,从而提高SPLH的FE。但多肽的相互作用比球蛋白弱,所以SPLH的粘弹性模量比SPI和7S低。SPLH的线性粘弹区很大,超过10%,表明SPLH具有较强的抗变形能力,这可能是SPLH的FS增加的原因。选择性水解产物SPSH同时含有7S和多肽,多肽可以快速地吸附至界面,球蛋白则可以增加粘弹性模量,所以SPSH的FE也有所提高,为680%,界面膜的粘弹性强度则提供了SPSH稳定的泡沫稳定性。EW的泡沫膨胀率很大,这是因为EW可以在空气-水界面快速吸附完成结构重排,达到吸附平衡,并且界面膜的弹性模量很大,有很强的机械强度。因此,蛋清蛋白在剧烈机械搅打后可形成大量长期稳定的泡沫。Dabestani等[16]使用糖果混合器搅拌和转移泡沫至玻璃漏斗称重的方式计算泡沫膨胀率,测得的数值比本方法低,本方法的操作简单,并与蛋糕制作的搅打过程类似,可以为将来大豆蛋白在蛋糕应用过程中提供更多参考。
3 结论
本文使用配备有Du Noüy环的旋转流变仪测定了大豆蛋白及其水解物在空气-水界面处的吸附层界面剪切流变学行为,并揭示了其与搅打起泡性质之间的关系。不同结构的蛋白质在空气-水界面表现出不同的界面剪切流变学行为,SPI和7S为球状蛋白质,吸附速度较慢,SPLH主要含小分子量多肽,可快速吸附至界面上。SPSH同时存在7S和多肽,既可快速吸附至界面,又能形成粘弹性强的界面膜。增加吸附至界面的速度有利于提高泡沫膨胀率。泡沫稳定性与界面膜粘弹性模量大小和线性粘弹性区域大小密切相关,增加粘弹性模量和线性粘弹区都可以增加泡沫稳定性。实验结果表明水解可以大大提高大豆蛋白的搅打起泡性质,为大豆蛋白在蛋糕、充气糖果和冰淇淋等充气食品的应用开发提供了实际意义。
