不同品种甜樱桃中不同形态酚酸的比较及其抗氧化性分析
2019-08-28冯晓元左骥民马智宏
高 媛,冯晓元,姜 楠,王 蒙,平 华,左骥民,马智宏,*
(1.北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097;2.北京市大兴区农业技术推广站,北京 102607)
樱桃营养丰富,因富含多种有效成分而具有一定的保健价值,其中尤以酚类物质最为突出[1]。酚类物质具有抗氧化、清除自由基、抗癌、抑菌等生物活性。酚酸是酚类物质中的一类,约占植物源食品中酚类化合物的三分之一,多为苯甲酸和肉桂酸的羟化衍生物。研究表明,酚酸还与果蔬采后运输、果实色泽、风味等密切相关[2-3]。酚酸类物质的种类和含量因品种、产地、发育阶段、提取方式等不同而有所差异[4-5]。
果蔬中的酚酸类物质根据存在形式可以分为游离型、游离酯型和结合型。游离酯型和结合型酚酸可在酸、碱或酶的作用下水解释放出来,从而被检测到。且有研究表明,对于植物中存在的绝大多数游离酯型,在碱性条件下更容易水解,酸性条件则不利于酚酸的释放[6]。不同形态的酚酸已在多种水果中得到分离和鉴定[7-8]。尽管关于樱桃中酚酸的组成和含量已有很多报道,但大多数研究仅关注了可溶性的游离型酚酸,而对游离酯型和结合型关注较少。研究表明,游离酯型酚酸在体内外试验中均具有较强的抗氧化活性[5,9]。因此,全面分析樱桃中酚酸类物质的含量和组成能更好的分析其营养价值。
本研究利用超高效液相色谱-串联质谱法(UPLC-MS/MS)对5个樱桃品种,包括彩虹、艳阳、萨米脱、23-51和瓦列里中的游离型、游离酯型和结合型酚酸含量进行测定和差异性评估,并对其抗氧化特性进行了分析,以期为樱桃中功能成分开发提供数据支撑。
1 材料与方法
1.1 材料与仪器
5个甜樱桃品种彩虹、艳阳、萨米脱、23-51和瓦列里 均采自北京市林业果树科学研究院试验园(北京通州,39°41′N,116°41′E)。采样时,挑选大小一致,无损伤,无病虫害的果实,用保温袋包裹,放进泡沫保温箱中,在2 h内运回实验室。每个品种采集三个重复,每个重复约2 kg。
Acquity TM超高效液相色谱仪-TQS串联质谱仪、电喷雾电离(electron spray ionization,ESI)接口 美国Waters公司;IKA A11分析研磨机、KS260摇床 德国IKA公司;BUCHI-R-210旋转蒸发仪 瑞士BUCHI;Milli-Q超纯水机 美国Mimpore公司;3-30k台式高速离心机 德国Sigma公司;PAL-2手持糖度计 日本ATAGO;pHS-3C精密pH计 上海雷磁。
1.2 实验方法
1.2.1 样品制备 采集的樱桃样品中部分用来测定单果重、可溶性固形物含量(Brix)、pH和可滴定酸;剩余样品用于酚酸类物质的提取和测定,在液氮保护下研磨成粉末,于-80 ℃保存待用。
1.2.2 不同品种樱桃理化指标的测定 取樱桃果实30颗称重,计算单果重。30颗果实挤压取上清获得樱桃汁,可溶性固形物含量(SSC)使用手持糖度计测量。pH采用电子pH计测定。可滴定酸(TA)使用酸碱滴定法测定,吸取2 mL上清液,加蒸馏水50 mL,并滴加酚酞指示剂2滴,用0.1 mol/L NaOH滴定至微红色,且30 s不褪色,测定结果以乳酸计。
1.2.3 酚酸类物质的提取
1.2.3.1 游离型酚酸 酚酸提取参照本实验室前期优化的方法做了适当改动[10]。取10 g样品于50 mL离心管中,加入20 mL 80%甲醇水提取液(v/v,含0.1%盐酸),涡旋振荡10 s,室温下超声提取20 min,超声功率700 W,于4 ℃ 10000 r/min离心5 min,将上清液转移至50 mL容量瓶。重复上述步骤一次,合并上清液,定容至50 mL。混匀后过0.22 μm有机相滤膜,待测。
1.2.3.2 游离酯型酚酸 游离酯型酚酸提取方法参考Li等[11]的方法并做了适当修改。取10 g样品于50 mL离心管中,加入20 mL 80%甲醇水提取液(v/v,含0.1%盐酸),涡旋混匀,室温下超声提取20 min,超声功率700 W,于4 ℃ 10000 r/min离心5 min,将上清液转移至100 mL鸡心瓶。重复上述步骤一次,合并上清液,剩余残渣可用于结合型酚酸的测定,上清液于旋转蒸发仪上在40 ℃下减压蒸发至15 mL以内。转移至100 mL离心管中,加入20 mL 4 mol/L NaOH,充入N2,40 ℃气浴振荡避光水解2 h。之后用浓HCl调节pH至2。20 mL乙酸乙酯萃取两次,合并萃取液,在旋转蒸发仪上40 ℃下减压蒸发至近干,用10 mL 50%甲醇水(v/v)溶解,混匀过0.22 μm有机相滤膜,备用。该提取方法中,游离型和游离酯型酚酸均被乙酸乙酯萃取,因此最终游离酯型酚酸含量为该部分得到的酚酸含量减去上一节(1.2.3.1)中对应游离型酚酸的数据。
1.2.3.3 结合型酚酸 取上一步离心后剩余的残渣,加入20 mL 4 mol/L NaOH,充入N2,40 ℃气浴振荡,避光水解2 h,浓HCl调节pH至2。用20 mL乙酸乙酯萃取两次,合并萃取液,40 ℃下减压蒸发至近干,用10 mL 50%甲醇水(v/v)溶解,混匀过0.22 μm有机相滤膜,备用。
1.2.4 分离和检测 色谱条件:色谱柱为Acquity HSS C18 column(2.1×150 mm;1.8 μm);柱温45 ℃;样品室温度10 ℃,进样体积5 μL;流动相A为0.1%甲酸水溶液;流动相B为0.1%甲酸乙腈;梯度洗脱条件:初始流动相A为95%,保持0.5 min,4.5 min 内降至70%,随后在4.5 min内降至10%,保持0.5 min后在0.5 min内升至95%,保持2.5 min;流速0.3 mL/min;总运行时间为13 min。
质谱条件:离子源模式采用正负离子模式(ESI+和ESI-);毛细管电压2.5 kV(ESI+)/-1.5 kV(ESI-);离子源温度为150 ℃,脱溶剂气温度为500 ℃,去溶剂气流量为1000 L/h,锥孔气流速为150 L/h。采用多反应监测(Multiple Reaction Monitoring,MRM)模式。
1.2.5 酚类物质的定量分析 分别称取各酚酸标准品10 mg,配制成1 mg/mL的酚酸标准储备液,于-20 ℃保存。酚酸混合标准工作液采用梯度稀释法现用现配。将混合标准品溶液,依次逐级稀释,配制成一系列质量浓度的混合标准工作液。以峰面积与相应浓度进行线性回归,得到线性方程和相关系数。样品分析采用标准曲线法进行定量分析。
1.2.6 抗氧化性测定 DPPH自由基清除能力的测定:取0.2 mL上清液,加入0.3 mL的乙醇,再加入2.5 mL的100 μmol/L DPPH充分混合,室温避光放置30 min后,测定517 nm下的吸光度值A1。对照采用无水乙醇溶液代替样品加入2.5 mL的100 μmol/L DPPH溶液中,其余操作同上,517 nm下得到的吸光度值为A0。重复3次。根据以下公式计算样品对DPPH的抑制率:
DPPH清除能力(%)=(1-A1/A0)×100
式中:A0:未加样品液时DPPH溶液的吸光度值;A1:加样品液时DPPH溶液的吸光度值。
铁还原能力的测定(FRAP):取2.5 mL用40 mmol/L HCl溶解的10 mmol/L TPTZ(Sigma Chemical Co.,St. Louis,MO),2.5 mL的20 mmol/L的FeCl3·6H2O和25 mL 0.3 mol/L醋酸缓冲液(pH3.6)混合得到FRAP溶液。将新鲜配制的FRAP溶液放置于37 ℃水浴中保温。取120 μL待测溶液,与3.6 mL水浴的FRAP溶液和360 μL去离子水充分混合,在37 ℃水浴中保温10 min。于593 nm测定反应液的吸光值。空白采用120 μL去离子水代替样品。样品反应液的吸光值应在以FeSO4·7H2O为标准品制作的标准曲线范围之内。样品铁还原能力与1 mmol/L FeSO4·7H2O有相同抗氧化能力的量相比较,用μmol Fe2+·g-1·FW表示。
1.3 数据处理
每个样品设置三个重复,数据用平均值±标准差的形式表示。单因素方差分析(ANOVA)使用统计学软件SPSS 20.0完成,采用Duncan多重比较进行显著性方差分析,显著性水平p<0.05。不同品种樱桃酚类物质偏最小二乘判别分析利用数据分析网站http://www.metaboanalyst.ca/完成。
2 结果与分析
2.1 不同品种樱桃果实理化指标分析
5个品种樱桃果实的单果重、可溶性固形物含量、pH和可滴定酸含量见表1。从表中可以看出,艳阳单果重最大,而23-51最小。艳阳单果重略微小于Ballistreri等的报道[12],研究表明,果实重量除与品种有关外,还与负载量、果实成熟阶段等有关[13-14]。可溶性固形物含量和可滴定酸在不同品种间有所差异。其中,萨米脱的可溶性固形物含量最高(18.39 °Brix);可滴定酸变化范围从0.85%(23-51)~1.15%(瓦列里);而pH变化从3.76~4.01。可滴定酸和pH与文献报道范围一致[12,15]。
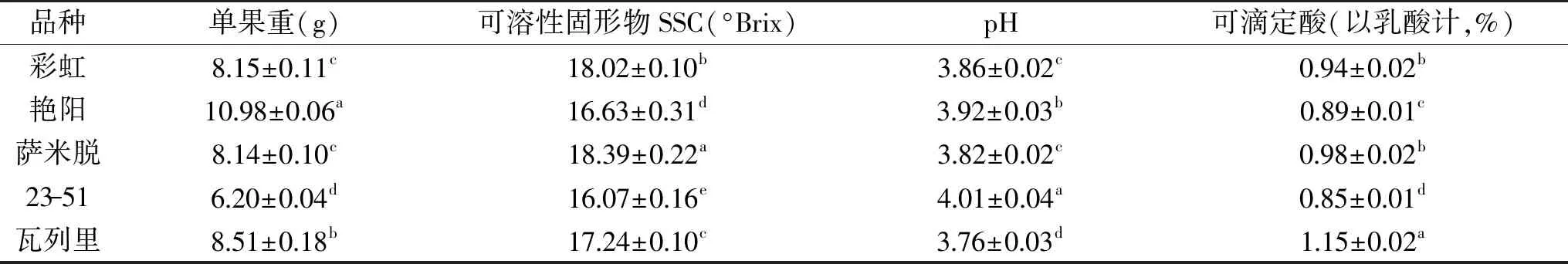
表1 不同品种樱桃理化指标(n=3)
2.2 不同品种樱桃中的酚酸类物质
樱桃中的酚酸主要以三种形态存在,游离型、游离酯型和结合型。游离型酚酸通过提取可以直接被检测到,游离酯型和结合型酚酸通常以酯键、醚键等与许多化合物连接在一起,需要经过水解释放出来才能被检测到。酚酸类物质根据结构不同,可以分为羟基苯甲酸类和羟基肉桂酸类。不同品种樱桃中的酚酸含量见表2。

表2 不同品种樱桃中的游离型、游离酯型和结合型酚酸含量(mg/kg FW)
游离型酚酸:不同樱桃品种中共检出4种游离型酚酸,包括新绿原酸、绿原酸、香草酸和对羟基苯甲酸。樱桃中的游离型酚酸以新绿原酸含量最高,其次是绿原酸,这与文献报道一致[5,16-17]。不同品种间酚酸含量差异较大。其中,瓦列里樱桃中的新绿原酸含量最高(413.81 mg/kg FW),其次为萨米脱,艳阳中含量最低。酚酸含量因品种、栽培模式、果实成熟阶段、储藏条件等不同而有所差异[4,14-15]。此外,樱桃中还含有较低含量的香草酸和对羟基苯甲酸,这两种酚酸在23-51中含量最高。
游离酯型酚酸是一种可通过甲醇水溶液直接提取的可溶性成分,但与可溶性糖、多肽等通过酯键或醚键相连,需要通过水解才能释放出来[18-19]。游离酯型酚酸总量在瓦列里中含量最高,其次是23-51和萨米脱,彩虹中含量最低。樱桃中的游离酯型酚酸以咖啡酸为主,这与文献报道一致[5];5个品种中瓦列里中的咖啡酸含量最高,彩虹中含量最低。除咖啡酸外,彩虹、艳阳和萨米脱中对香豆酸具有较高的含量,而对于23-51和瓦列里,则是原儿茶酸高于其他种类酚酸。研究表明,咖啡酸和对香豆酸均具有较强的抗氧化活性和自由基清除能力[20]。此外,23-51中还含有相对较高含量的香草酸。
结合型酚酸是不可溶性酚酸,不能直接被甲醇溶液提取,多与细胞壁多糖、木质素等通过酯键或醚键相连,需经水解才能释放出来[18,21]。樱桃中共检测到4种结合型酚酸,包括2种羟基苯甲酸类(香草酸和原儿茶酸)和2种羟基肉桂酸类(咖啡酸和对香豆酸)。23-51中的结合型酚酸总量最高,彩虹中含量最低。与游离酯型酚酸类似,樱桃中的结合型酚酸同样以咖啡酸含量最高。结合型的咖啡酸和对香豆酸在文献中被报道过[5],而原儿茶酸和香草酸是第一次被检出。
不同形态酚酸在多种水果、谷物麸皮中得到分析[7,22],但关于樱桃中不同形态酚酸的测定报道较少,目前仅在一篇文献中被报道过[5],大部分都仅关注了游离型酚酸。从分析结果来看,樱桃中的游离酯型酚酸可占酚酸总量的38%~51%。游离酯型酚酸在植物抗氧化作用中也发挥着重要作用[18,23]。因此,全面分析酚酸的含量及存在形式,能更好的解释其生物活性及其营养价值。
2.3 抗氧化性分析
不同形态酚酸提取液DPPH自由基清除能力和铁还原能力(FRAP)的测定结果如图1所示(由于结合型酚酸类物质提取液抗氧化特性很低,未在图中展示)。从图中可以看出,DPPH自由基清除能力和铁还原能力测定的抗氧化性结果趋势一致。结果表明,瓦列里酚酸类物质提取液的DPPH自由基清除能力和FRAP均最高。另外,五个樱桃品种中,游离型酚类物质提取液的抗氧化性要高于游离酯型的。且抗氧化性指标的测定结果与酚酸类物质含量呈现较高的一致性。
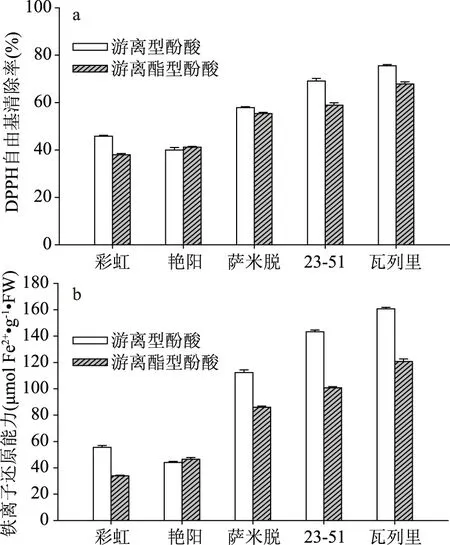
图1 不同品种甜樱桃提取液抗氧化性分析
2.4 偏最小二乘判别分析
为了更好的比较不同樱桃品种间酚酸类物质的差异,以5个樱桃品种中检测到的各酚酸物质总量(包括游离型、游离酯型和结合型)为变量进行偏最小二乘判别分析(PLS-DA),结果如图2所示。得分散点图(图2a)和VIP得分图(图2b)共同反应了不同品种樱桃与酚酸类物质之间的关系。前两个主成分解释了总方差的99.0%,其中主成分1占总方差的97.4%。从散点图可以看出,五个不同樱桃品种能够较好的区分开。VIP得分一般用来评价各代谢组分对区分各个品种/处理的贡献值,从VIP得分图可以看出,新绿原酸和咖啡酸是区分五个樱桃品种贡献最大的物质(一般认为VIP>1的组分对区分组间差异有贡献),也是造成品种间差异的主要化合物;在五个樱桃品种中,差异最大的两个物质新绿原酸和咖啡酸均在瓦列里中含量最高。
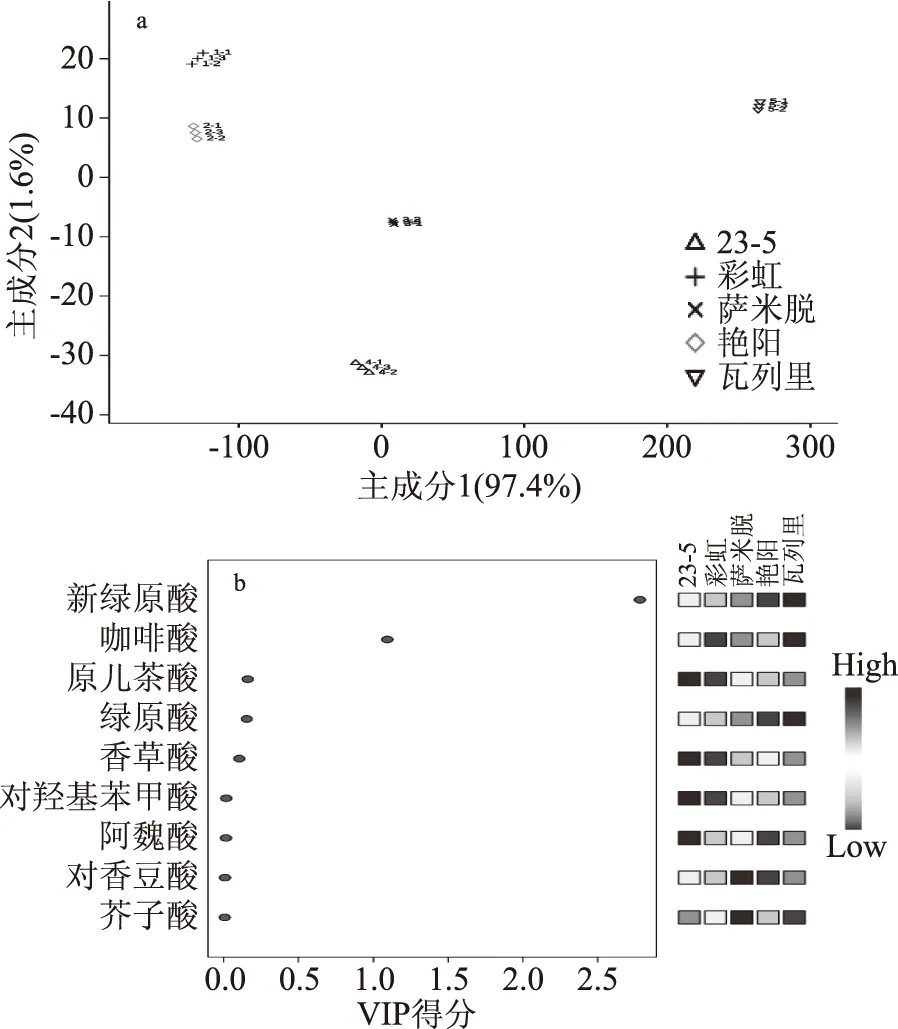
图2 不同品种甜樱桃中酚酸类物质偏最小二乘判别分析
3 结论
本实验采用UPLC-MS/MS对五个不同品种甜樱桃中的不同形态酚酸(包括游离型、游离酯型和结合型)进行了测定和分析。结果表明,不同品种间酚酸总量差异较大。三种形态酚酸中,游离型和游离酯型酚酸占酚酸总量的94%以上,结合型酚酸含量较低。不同樱桃品种中,游离型酚酸均以新绿原酸为主,游离酯型和结合型酚酸以咖啡酸含量最高。游离型和游离酯型酚酸总量在瓦列里中含量最高(分别为435.69和261.93 mg/kg FW);而对于结合型酚酸,则是在23-51中含量最高(16.92 mg/kg FW)。不同形态酚酸DPPH自由基清除能力和铁还原能力测定结果与酚酸含量具有一致性。PLS-DA结果显示新绿原酸和咖啡酸是区分不同甜樱桃品种贡献最大的物质。研究结果将为果蔬中不同形态酚酸鉴定及功能性产品开发提供一定的参考价值。
