二步法制备稀有人参皂苷Rh1组异构体
2019-08-28金豆豆刘春莹徐龙权宋建国鱼红闪
金豆豆,刘春莹,徐龙权,宋建国,鱼红闪,*
(1.大连工业大学生物工程学院,辽宁大连 116034;2.大连大学生命科学与技术学院,辽宁大连 116622)
人参(PanaxginsengC.A. Meyer)属五加科(Araliaceae)多年生草本植物[1],是一种名贵中药,分布于中国东北,俄罗斯东部,朝鲜等地[2]。人参皂苷Re,Rg1和Rh1是三醇类皂苷[3-5],现代药理学研究表明,人参皂苷Re具有抗溶血作用[6-7];人参皂苷Rg1具有抗疲劳作用,可以调节中枢神经兴奋度并能改善记忆力[8-9];人参皂苷Rh1属于稀有皂苷,具有抑制癌细胞增殖的作用,但在人参植物中含量极少,与Rg1相比更易被人体吸收,并且具有更好的生理活性[10-11],如何高利用低廉的皂苷有效地制备人参皂苷Rh1是近年来的研究目标。
在Rg1的制备方面,金赞敏等[12]发现微生物sp.G9(即为本文的Absidiasp.P39r菌种)产皂甙α-鼠李糖苷酶具有专一性,能够水解人参皂甙Re的C-6位末端上的一个α-鼠李糖基制备人参皂甙Rg1,且酶反应的最佳温度是40 ℃,最适pH为5.0。在稀有人参皂苷Rh1的制备方面,Cao等[13]以原人参三醇组皂苷为底物,采用弱酸(冰醋酸)水解法制备出Rh1,由于该方法副产物较多,后续采用硅胶柱层析法才能进一步制备出纯度达90%的Rh1。目前关于转化人参皂苷的文献报告很多,大多数情况下使用酸、碱水解法转化人参皂苷,但这种方法反应剧烈,产生的产物复杂,并且强酸和强碱会对环境造成严重污染[14-15]。
在前期研究中发现,酶法催化转化人参皂苷反应条件温和,反应过程容易控制,在常温下即可进行,底物特异性强且产物单一,对环境没有污染[16-18]。在人参皂苷的催化转化研究中也发现,过渡态金属离子如Fe3+可以催化人参皂苷的糖基水解,反应具有定向性,且产物分离相对容易并能够将金属离子进行回收,从而有效地降低其对环境的污染。
本文采用二步法,首先以Re为底物通过酶催化反应制备Rg1,再以制备出的Rg1为底物,Fe3+为催化剂进行反应,以得到包含20(S)-Rh1和20(R)-Rh1在内的异构体组合物为目的,实现用廉价人参皂苷制备稀有人参皂苷的目标,为其进一步的开发应用奠定基础。
1 材料与方法
1.1 材料与仪器
Absidiasp.P39r(犁头霉)菌株 大连工业大学生物工程学院菌种保藏所;人参皂苷Re、Rg1样品以及Re、Rg1、20(S)-Rh1、20(R)-Rh1、Rk3和Rh4对照品 实验室自制,HPLC纯度达到95%以上;AB-8大孔吸附树脂 南开大学化工厂;人参粉 北京同仁堂大连分店;麦芽汁 实验室自制;透析袋(0.1~0.5 kDa) 上海新睿生物科技有限公司;硫酸铵、无水乙酸钠、冰醋酸、无水乙醇、乙二醇、甲醇、正丁醇、异丁醇、正丙醇、1,2-丙二醇、异丙醇、异戊醇、聚乙二醇、正戊醇、正己醇、正庚醇、环己醇、丙三醇、环戊醇、苯甲醇、1,3-丙二醇 Sigma-Aldrich;娃哈哈纯净水 大连娃哈哈饮用水有限公司;HPLC试剂 色谱纯;实验所用其他试剂 均为国产分析纯。
Waters 2695-2424高效液相色谱仪 美国Waters公司产品。
1.2 实验方法
1.2.1 菌种的液体培养 固体斜面培养基:采用麦芽汁培养基,此培养基配方为:5 °麦芽汁+2%琼脂。将Absidiasp.P39r菌株接种在此培养基上,在29 ℃条件下培养6 d,之后用牛皮纸包好,放在4 ℃下保藏备用。
人参浸出液的制备:将100 g人参粉与600 mL水在烧杯中混合均匀,小火煎煮7 h,(煎煮的过程中注意补水和搅拌,防止糊化);冷却,用四层纱布过滤掉残渣的滤液,将滤液在8000 r/min条件下离心10 min,取上清液,即是诱导物浸出液,补水至300 mL,高压灭菌,于4 ℃保藏备用。
液体发酵培养基:取12 mL的人参浸出液加入48 mL的麦芽汁,再加入40 mL自来水补齐至100 mL,配制成液体发酵培养基(麦芽汁的最终浓度为5°)。蒸汽灭菌(121 ℃,1 MPa)21 min,冷却至室温。
1.2.2 酶液的制备 根据李明华等[19]研究的霉菌液体菌种的方法培养菌种,取活化好的Absidiasp.P39r菌株斜面,用移液枪取5 mL菌种接种到液体发酵培养基后置于振荡培养箱中。再将发酵培养好的100 mL发酵液进行高速离心,转速为8000 r/min,时间是15 min(去除菌体),取上清液。在上清液中缓慢加入硫酸铵粉末(在磁力搅拌条件下)进行盐析,直至加入的硫酸铵饱和度为85%,之后在4 ℃下静置、过夜。再在13000 r/min条件下离心20 min,收集沉淀,即为酶蛋白。用10 mL 0.02 mol/L pH5.0醋酸钠-醋酸缓冲液将酶蛋白沉淀溶解,转入透析袋用相同的缓冲溶液进行透析48 h,透析过程中每隔2 h换一次透析袋。透析结束后,用高速冷冻离心机在13000 r/min下离心10 min,除去不溶性杂蛋白[20]。所得上清液即为酶液。
1.2.3 酶转化生成Rg1最佳反应条件的确定 底物Re的配制:取1 mg Re对照品加入到200 μL无水乙醇和800 μL pH5.0醋酸钠-醋酸缓冲液中完全溶解,取1 mL底物Re溶液加入1 mL酶液进行酶反应。对Absidiasp.P39r菌产酶液催化转化Re的最佳反应条件进行确定(表2),固定反应条件为:反应温度40 ℃,底物浓度1 mg/mL,乙醇浓度10%,反应时间20 h,考察不同缓冲液pH(3.4、3.8、4.2、4.6、5.0、5.4、5.8、6.2)对产物中Rg1质量分数的影响;固定反应条件为:缓冲液pH5.0,底物浓度1 mg/mL,乙醇浓度10%,反应时间20 h,考察不同反应温度(25、30、35、40、45、50、55、60 ℃)对产物中Rg1质量分数的影响;固定反应条件为:缓冲液pH5.0,反应温度40 ℃,乙醇浓度10%,反应时间20 h,考察不同底物浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL)对产物中Rg1质量分数的影响;固定反应条件为:缓冲液pH5.0,反应温度40 ℃,底物浓度1 mg/mL,反应时间20 h,考察不同乙醇浓度(0、2%、4%、6%、8%、10%、12%、14%、16%、18%、20%)对产物中Rg1质量分数的影响;固定反应条件为:缓冲液pH5.0,反应温度40 ℃,底物浓度1 mg/mL,乙醇浓度10%,考察不同反应时间(6、8、10、12、14、16、18、20、22、24、26 h)对产物中Rg1质量分数的影响。进行单因素实验,分别对每个反应取样,加入2 BV水饱和正丁醇终止酶反应,振荡,分层,吸走下层液体,将上层液体蒸干得到粉末样品。粉末样品用色谱纯甲醇溶解,通过HPLC-PDA检测分析,根据催化反应得到的Rg1的质量分数来确定最佳反应条件。
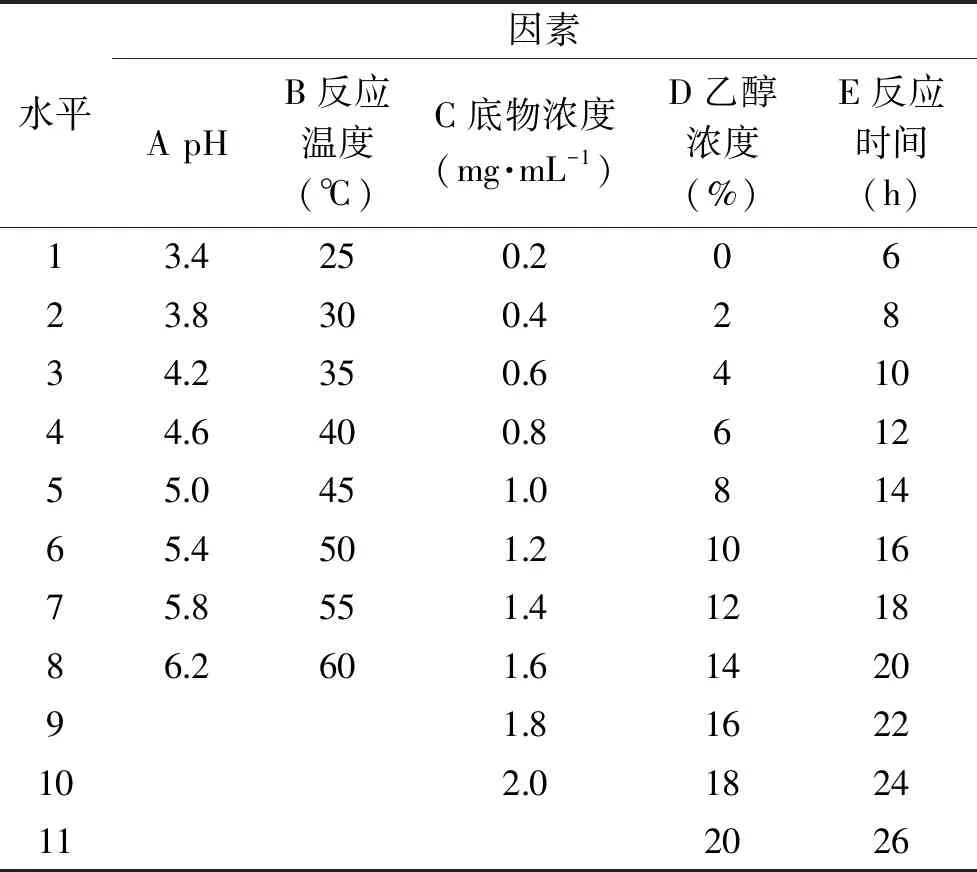
表2 酶催化转化Re生成Rg1反应条件
1.2.4 Fe3+催化生成Rh1组异构体最适有机溶剂体系的确定 底物Rg1的配制:取1 mg Rg1对照品加入到500 μL不同的有机醇试剂(选用无水乙醇、乙二醇、甲醇、正丁醇、异丁醇、正丙醇、1,2-丙二醇、异丙醇、异戊醇、聚乙二醇400、正戊醇、正己醇、正庚醇、环己醇、丙三醇、环戊醇、苯甲醇、和1,3-丙二醇)和500 μL去离子水中完全溶解,再选取纯净水为对照组。分别取1 mL底物Rg1溶液加入1 mL 1.5 mol/L FeCl3溶液进行金属离子催化反应,在40 ℃下反应 15 h后,2 BV水饱和正丁醇萃取,取正丁醇层加3 BV水继续萃取以除去Fe3+,水洗正丁醇层3遍,蒸干正丁醇层得到粉末样品。用色谱纯甲醇溶解,经HPLC-PDA检测分析,通过催化反应得到的20(S,R)-Rh1的质量分数来确定最佳有机溶剂体系。
1.2.5 Fe3+催化生成Rh1组异构体最佳反应条件的确定 底物Rg1的配制:取1 mg Rg1对照品加入到500 μL无水乙醇和500 μL去离子水中完全溶解,取1 mL底物Rg1溶液加入1 mL FeCl3溶液进行金属离子催化反应。用Fe3+作为催化反应中的金属离子,以酶反应得到的Rg1为底物(表3),反应条件为:固定反应条件为反应温度50 ℃,底物浓度1 mg/mL,FeCl3溶液浓度1.5 mol/L,反应时间15 h,考察不同乙醇浓度(30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%)对产物中20(S,R)-Rh1质量分数的影响;固定反应条件为乙醇浓度50%,底物浓度1 mol/L,FeCl3溶液浓度1.5 mol/L,反应时间15 h,考察不同反应温度(25、30、35、40、45、50、55、60、65 ℃)对产物中20(S,R)-Rh1质量分数的影响;固定反应条件为乙醇浓度50%,反应温度50 ℃,FeCl3溶液浓度1.5 molL,反应时间15 h,考察不同底物浓度(0.2、0.5、0.8、1.1、1.4、1.7、2.0、2.3、2.6、3.0 mg/mL)对产物中20(S,R)-Rh1质量分数的影响;固定反应条件为乙醇浓度50%,反应温度50 ℃,底物浓度1 mol/L,反应时间15 h,考察不同FeCl3溶液浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mol/L)对产物中20(S,R)-Rh1质量分数的影响;固定反应条件为乙醇浓度50%,反应温度50 ℃,底物浓度1 mol/L,FeCl3溶液浓度1.5 mol/L,考察不同反应时间(2、4、6、8、10、12、14、16、18、20、22、24、26、28 h)对产物中20(S,R)-Rh1质量分数的影响。进行单因素实验,分别对每个反应取样,分别加入2 BV水饱和正丁醇萃取,取正丁醇层加3 BV水继续萃取以除去Fe3+,水洗正丁醇层3遍,蒸干正丁醇层得到粉末样品。用色谱纯甲醇溶解,经HPLC-PDA检测分析,通过催化反应得到的20(S,R)-Rh1的质量分数来确定Fe3+催化的最佳反应条件。
1.2.6 酶转化产物和Fe3+催化反应产物的HPLC-PDA检测 色谱柱:中汇达C18色谱柱(φ250 mm×4.6 mm,5 μm);柱温35 ℃;进样量10 μL;流速1.0 mL/min;载气压力30 psi;漂移管温度80 ℃;流动相为乙腈(A)和水(B);流动相洗脱梯度:0~20 min,20% A;20~31 min,20%~32% A;31~40 min,32%~43% A;40~70 min,43%~100% A[21]。
对照品溶液的制备:精密称取人参皂苷Rg1,20(S)-Rh1,20(R)-Rh1,Rk3和Rh4对照品10 mg溶于5 mL色谱甲醇中,配成浓度为2 mg/mL的对照品溶液,然后分别取1 mL加入色谱甲醇稀释成浓度2.0、1.6、1.2、0.8、0.4 mg/mL的对照品溶液,过膜备用。分别取上述制备的不同浓度对照品溶液10 μL按上述色谱条件进样分析,以测得的峰面积的自然对数对进样浓度的自然对数绘制标准曲线,用最小二乘法进行线性回归,得到各个成分的回归方程[22],结果见表1。

表1 人参皂苷Rg1和Rh1组的线性回归方程
1.2.7 催化反应产物的质量分数计算 催化反应产物经HPLC-PDA测定后,参照上述回归方程分别计算Rg1、20(S)-Rh1、20(R)-Rh1、Rk3和Rh4的质量。将Rg1归为一组,20(S)-Rh1+20(R)-Rh1归为一组称为20(S,R)-Rh1,由于Rk3、Rh4与20(S)-Rh1、20(R)-Rh1类似,均为一组手性对称三醇类人参皂苷,相对分子质量相同,故将Rk3+Rh4归为一组,Rg1的质量分数(ω1)计算方法如下:
20(S,R)-Rh1的质量分数(ω2):
Rk3和Rh4的质量分数(ω3):

表3 Fe3+催化转化Rg1生成Rh1组异构体反应条件
式中:m1指酶催化反应得到的粉末状样品1的质量,m2指金属离子催化反应得到的粉末状样品2的质量。
1.3 数据处理
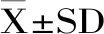
2 结果与分析
2.1 酶转化法制备Rg1的催化反应条件选择
采用1.2.3的方法对Absidiasp. P39r菌产粗酶液催化Re的反应条件进行优化,得到人参皂苷Rg1的质量分数折线图。图1A表明,随着pH的增加,Rg1的量先增加再减少,pH为4.6时,Rg1的质量分数最大为68.5%[23];图1B表明,随着温度的增加,Rg1的量先增加再减少,当温度为40 ℃时,Rg1的质量分数最大为71.5%;图1C表明,底物浓度为1.2%时,Rg1的质量分数最大为70.3%;图1D表明,随着时间的增加,反应时间为16 h时,Rg1的质量分数最大为68.4%。图1E表明,乙醇浓度为0%时Re仍有剩余,随着乙醇浓度的增加,Rg1的质量分数先增加后缓慢减少,当乙醇浓度在10%时Rg1的质量分数最大为69.4%。最终确定最佳反应条件为:缓冲液pH5.0,反应温度40 ℃,底物浓度1.2%,反应时间16 h,乙醇浓度10%。
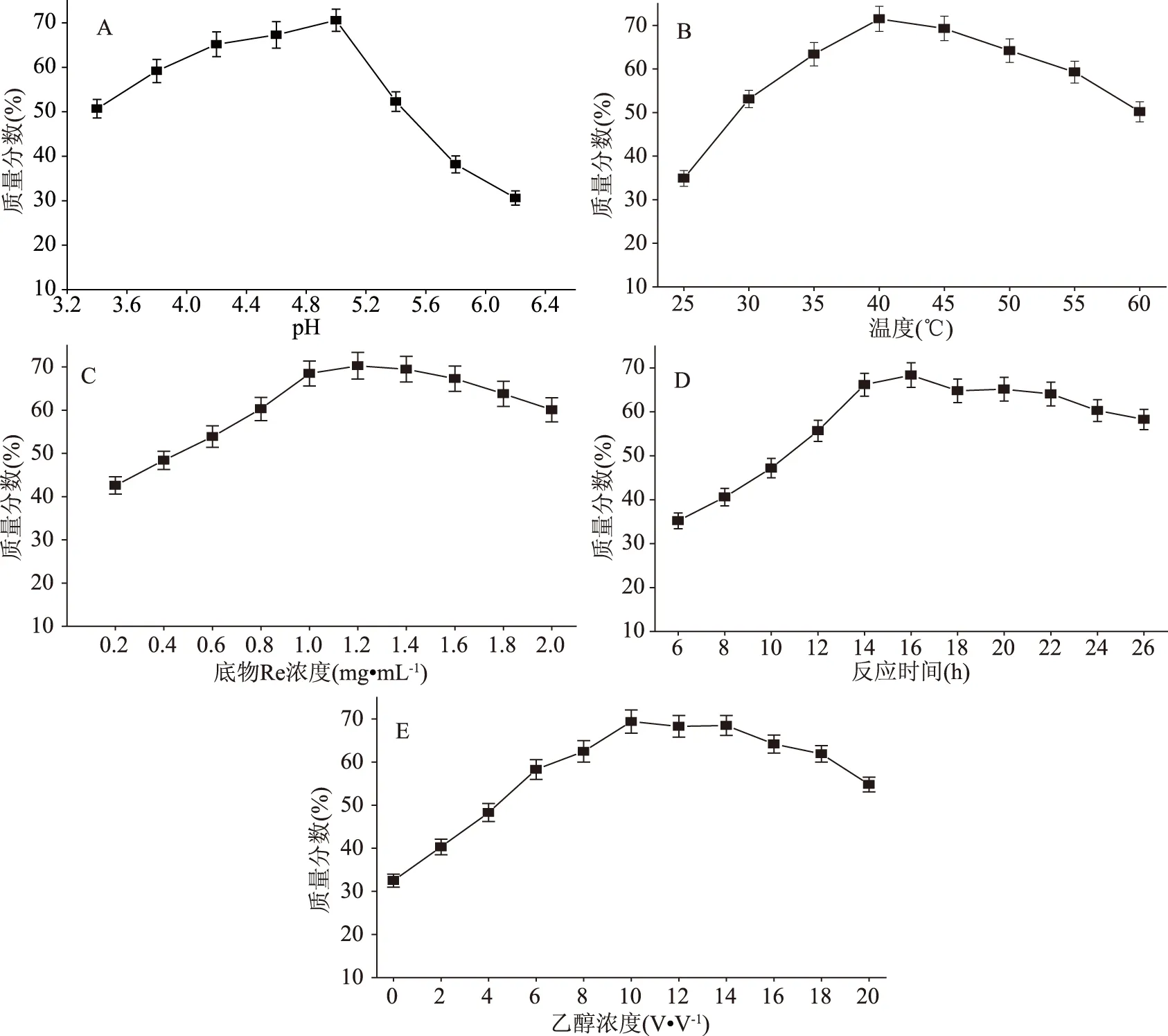
图1 不同反应条件下Rg1的质量分数折线图
2.2 Fe3+催化法制备Rh1组异构体的最佳有机溶剂体系
采用1.2.4的方法得到的结果如图2所示,在19种有机醇体系中,均有20(S,R)-Rh1生成,但质量分数不同,由于人参皂苷Rg1和Rh1是低极性化合物[24],水溶性不好,醇溶性较好,并且在乙醇体系中Fe3+催化人参皂苷Rg1生成的20(S,R)-Rh1含量最多,因此选择乙醇-水作为溶剂体系考察其对催化反应的影响。

图2 不同有机醇体系下Rh1组各组分质量分数
2.3 Fe3+催化法制备Rh1组异构体的最佳反应条件的优化
根据1.2.5的试验条件对Fe3+催化Rg1生成Rh1组异构体的反应条件进行优化,得到20(S,R)-Rh1,Rk3和Rh4的质量分数折线图。图3A表明,随着乙醇浓度的增加,20(S,R)-Rh1的量先增加再减少,乙醇浓度为50%时,20(S,R)-Rh1的质量分数达到最大为52.7%[25];图3B表明,当反应温度为30 ℃时,Rg1有较多剩余,50 ℃时Rg1基本都催化转化为Rh1组异构体,其中20(S,R)-Rh1的质量分数高达63.2%;图3C表明,底物Rg1浓度为1.7%时,20(S,R)-Rh1的质量分数最大为60.3%;图3D表明,随着Fe3+浓度的增加,20(S,R)-Rh1的质量分数先增加后减少,FeCl3溶液浓度为1.4 mol/L时,20(S,R)-Rh1的质量分数高达60.3%。

图3 不同反应条件下Rh1组化合物的质量分数折线图
图3E表明,在乙醇-水体系下,Fe3+催化人参皂苷Rg1的反应发生的很快,在2 min时就已经有20(S,R)-Rh1、Rk3和Rh4的生成,说明在C-20糖苷键裂解的同时进行脱水反应;当反应进行到14 h和16 h时,20(S,R)-Rh1、Rk3和Rh4的含量相继达到最高,分别为63.4%和14.5%。随后20(S,R)-Rh1的质量分数开始下降,Rk3和Rh4趋于平衡。从上述结果可以看出,Fe3+直接催化裂解了人参皂苷Rg1 C-20上的葡萄糖苷键,在生成20(S)-Rh1和20(R)-Rh1的同时发生脱水反应生成Rk3和Rh4。由此得出Fe3+催化转化人参皂苷Rg1的反应过程,结果如图4所示。最终确定最佳反应条件为:乙醇浓度50%,Fe3+溶液的反应浓度1.4 mol/L,反应温度50 ℃,底物浓度1.7%,反应时间14 h。
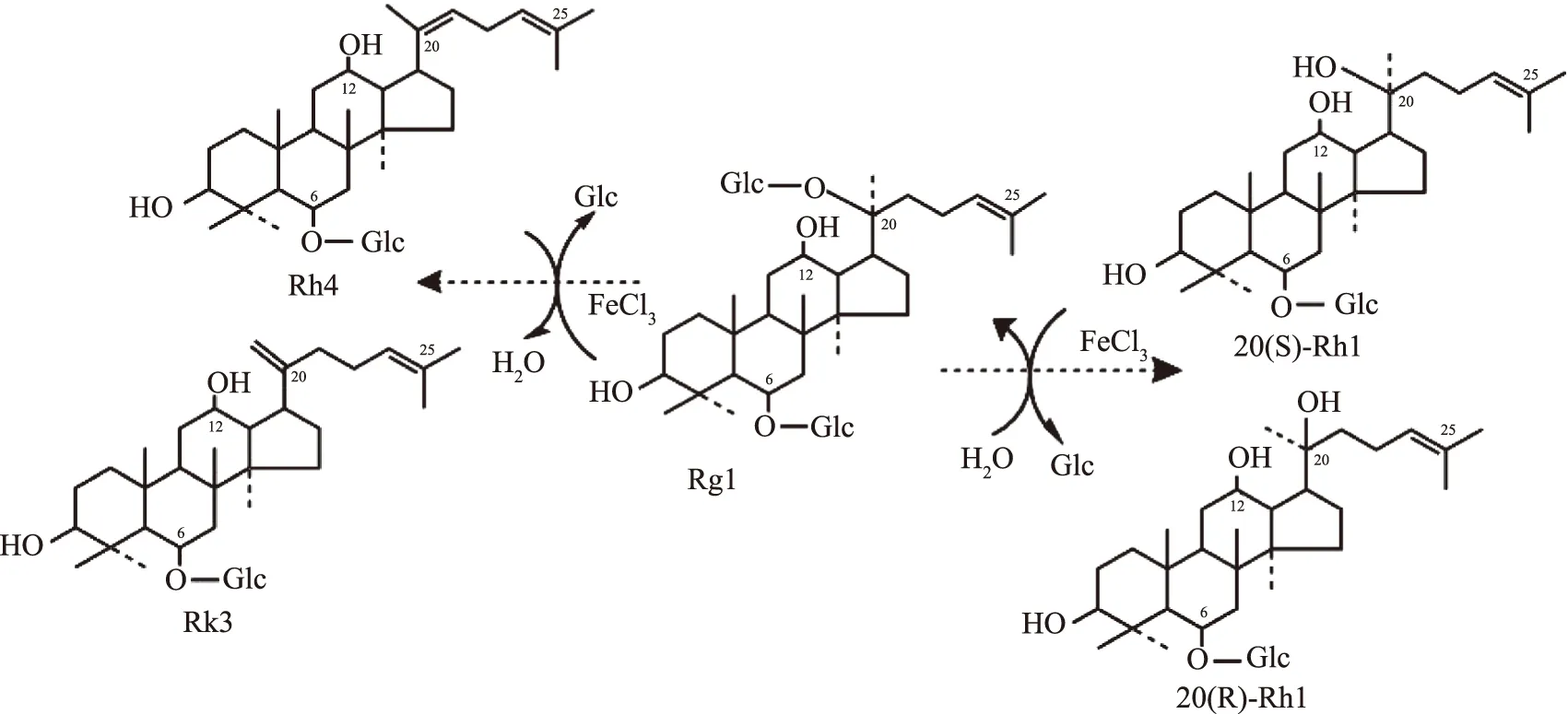
图4 Fe3+催化人参皂苷Rg1的反应过程
2.4 二步法催化转化制备Rh1组异构体
根据2.1~2.3得出的最佳反应条件,以Re为底物,Absidiasp.P39r菌株产酶液为催化剂进行反应,采用10%乙醇作为溶剂体系,称取20.0 g Re溶于200 mL无水乙醇,待底物完全溶解后,加入0.02 mol/L pH为5.0的醋酸钠-醋酸缓冲液,定容至1 L,加入1 L酶液,在40 ℃下反应14 h后,将反应液用去离子水稀释5倍,并快速经提前处理好的AB-8大孔吸附树脂[24]进行脱糖处理,并将溶液进行旋转蒸发至粉末状。最终得到催化产物粗品质量14.1 g,得率为70.5%。制备得到的粗品经HPLC-PDA测定,结果如图5所示。发现粗品中含有1种催化反应产物Rg1纯度达94%以上。
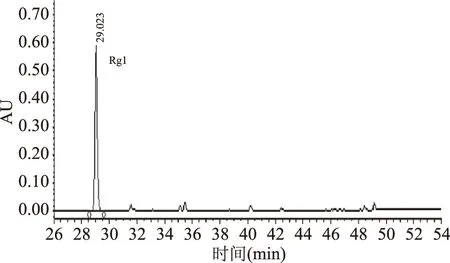
图5 Rg1的HPLC检测图
然后以Rg1为底物,FeCl3为金属离子催化剂进行反应,采用50%乙醇作为溶剂体系,称取10.2 g Rg1和68.12 g FeCl3溶剂于300 mL体积分数为50%的乙醇中,在50 ℃下反应14 h后,将反应液用去离子水稀释5倍,并快速经提前处理好的AB-8大孔吸附树脂进行脱铁脱糖处理[25-26],并将溶液进行旋转蒸发至粉末状。最终得到催化产物粗品质量8.18 g,得率为80.2%。制备得到的粗品经HPLC-PDA测定,结果如图6所示。发现粗品中含有4种催化反应产物,分别为20(S)-Rh1、20(R)-Rh1、Rk3和Rh4。其中20(S,R)-Rh1的含量为61.83%,Rk3、Rh4的含量总和为27.34%。其中20(S)-Rh1的含量为37.71%,20(R)-Rh1的含量为24.12%,Rk3的含量为7.27%,Rh4的含量为20.07%。20(S,R)-Rh1、Rk3和Rh4的含量之比为62∶27。
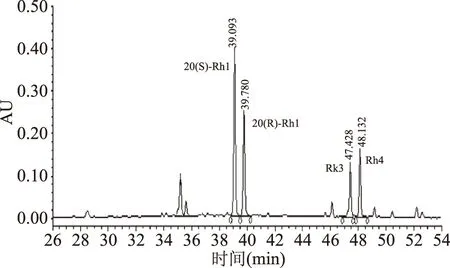
图6 Rh1组化合物的HPLC检测图
3 结论
Absidiasp.P39r菌株产酶可催化Re转化为Rg1,在缓冲液pH5.0,底物浓度1.2%,反应时间16 h,乙醇浓度10%,反应温度40 ℃下Rg1的产率最高。以20 g Re为底物,在最佳条件下制备Rg1,得率为70.5%;在乙醇-水体系中,Fe3+催化人参皂苷Rg1生成的20(S,R)-Rh1含量最多,该溶媒体系下催化反应条件的优化结果为:乙醇浓度50%,反应温度50 ℃,底物浓度1.7%,Fe3+溶液反应浓度1.4 mol/L,反应时间14 h。在 乙醇-水体系的最佳条件下考察Fe3+催化反应产物随时间的变化,发现在C-20葡萄糖苷键裂解生成20(S,R)-Rh1的同时,脱水反应生成Rk3和Rh4。以10.2 g Rg1为底物,50%乙醇-水体系中催化反应14 h制备得到粗品,得率为80.2%,其中20(S)-Rh1的含量为37.71%,20(R)-Rh1的含量为24.12%,Rk3的含量为7.27%,Rh4的含量为20.07%。20(S,R)-Rh1、Rk3和Rh4的含量之比为62∶27。
酶转化法和金属离子催化法均具有条件温和,产物单一,对环境没有污染;反应特异性强,目标产物质量分数高,周期短的特点,易于工业化放大生产。本论文通过两种方法联用,为稀有人参皂苷Rh1组异构体的催化制备提供了新方法。
