余甘子总多酚的提取及其抗氧化活性研究
2019-08-28杨冰鑫刘晓丽
杨冰鑫,刘晓丽
(广东工业大学轻工化工学院,广东广州 510006)
余甘子(PhyllanthusemblicaL.)属大戟叶下珠属,源于缅甸和印度,现在中南半岛、印度尼西亚、菲律宾、中国等地均有分布,其中在中国的产量相对较多[1]。余甘子已被列为我国药食同源品种之一,其果实含有多酚[2]、超氧化物歧化酶(SOD)、多糖、萜类化合物、脂肪酸、蛋白质、生物碱,以及12种维生素、17种氨基酸、16种微量元素等成分。余甘子药理作用也极其广泛,主要有抗氧化、保肝作用[3-5]、降低血脂作用、抗肿瘤等功效[6]。
近年来,大量文献报道,很多植物中提取的酚类物质具有很好的抗氧化活性。植物酚类物质被应用于多种食品的抗氧化,如肉与肉制品、奶制品、焙烤食品等。据报道,余甘子多酚可以作为抗氧化剂替代品运用于食品的抗氧化;将余甘子多酚作为一种天然油脂抗氧化剂应用于饼干的加工;添加余甘子多酚的产品在贮存过程中的过氧化物值和酸价都明显低于添加人工合成抗氧化剂BHA的产品等[7]。
本研究主要以溶剂浸提的方法提取余甘子多酚,以期得到余甘子多酚提取的最优方案,并对余甘子多酚的抗氧化活性进行研究,为余甘子在天然抗氧化剂的开发方面提供科学依据。
1 材料与方法
1.1 材料与仪器
余甘子鲜果 购自四川;昆明小鼠 健康状况良好,14只,雌雄各半,8~9周龄,25~30 g,许可证号:SCXK(粤)2013-0034,广州中医药大学;无水乙醇、铁氰化钾、三氯化铁、三氯乙酸(TCA)、无水碳酸钠、磷酸氢二钠、磷酸二氢钠、30%双氧水、水杨酸 分析纯,天津市致远化学试剂有限公司;没食子酸标准品(批号:149-91-7) HPLC≥98%,上海源叶生物科技有限公司;2-硫带巴比妥酸(TBA)、福林酚溶液 分析纯,上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 分析纯,上海源叶生物科技有限公司;茶多酚 分析纯,合肥巴斯夫生物科技有限公司;乙二胺四乙酸二钠(EDTA)、硫酸亚铁 分析纯,天津市大茂化学试剂;实验用水 去离子水。
202-00A烘箱 上海索普仪器有限公司;800T摇摆式高速粉碎机 广州市打样电子机器设备有限公司;U-1950紫外-可见光分光光度计 北京普析通用仪器有限责任公司;SHA-BA恒温振荡器 常州奥华仪器有限公司;SHZ-(Ⅲ)真空抽滤机 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 没食子酸标准曲线的绘制 精确称量没食子酸标准品0.0050 g,加入浓度为60%的乙醇溶液定容至50 mL,制成没食子酸标准溶液,分别吸取不同浓度的没食子酸标准品0.5 mL溶液于10 mL的容量瓶中[8],加入5 mL浓度为10%的福林酚溶液,摇匀后静置5 min,最后加入4.5 mL的7.5%的碳酸钠溶液定容至刻度线,静置反应1 h,用紫外-可见光分光光度计在740 nm[9]处测量各个样品的吸光值,以没食子酸的浓度(mg/mL)为横坐标,以吸光值为纵坐标制出没食子酸的标准曲线[10]。
1.2.2 余甘子多酚的提取 新鲜余甘子去除果核,55 ℃烘26 h,用摇摆式高速粉碎机进行粉碎,过60目筛网既得余甘子粉末[11]。精确称量1 g余甘子粉末,量取25 mL浓度为60%的乙醇溶液于三角瓶中,在温度为50 ℃的恒温振荡器中回旋振荡135 min,真空抽滤取上清液,滤渣重复上述操作,合并两次滤液[12],即得到余甘子多酚提取液。
1.2.3 余甘子多酚含量的测定 采用福林酚比色法[13],以没食子酸为标准品绘制曲线(见图1)。取0.1 mL浓度为2 mg/mL余甘子提取液于10 mL的定量瓶中,按照1.2.1的方法测定吸光值,根据标准曲线计算总多酚含量,总多酚含量用mg GAE(没食子酸)/mg果粉表示,计算公式如下:
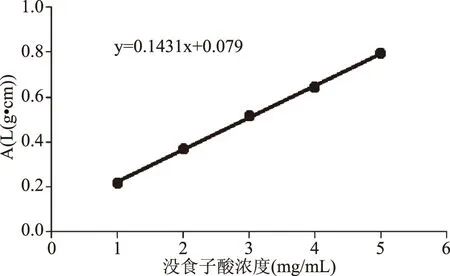
图1 没食子酸标准曲线
总多酚含量(mg GAE/mg)=AV/m
式中,A-没食子酸浓度(mg/mL);V-定容后体积(mL);m-样品质量(mg)[14]。
1.2.4 单因素实验
1.2.4.1 浸提时间对多酚提取效果的影响 余甘子粉末溶于浓度为60%的乙醇,温度设置为50 ℃,提取时间分别为45、90、135、180、225 min,冷却并进行真空抽滤,剩余的滤渣重复上述操作,合并两次滤液,得到余甘子多酚提取液,测定其多酚含量。
1.2.4.2 浸提温度对多酚提取效果的影响 余甘子粉末溶于浓度为60%的乙醇,温度分别设置为30、40、50、60、70 ℃,135 min后冷却并进行真空抽滤,剩余的滤渣重复上述操作,合并两次滤液,得到余甘子多酚提取液,测定其多酚含量。
1.2.4.3 乙醇浓度对多酚提取效果的影响 余甘子粉末分别溶于浓度依次为15%、30%、45%、60%、75%的乙醇,温度设置为60 ℃,135 min后冷却并进行真空抽滤,剩余的滤渣重复上述操作,合并两次滤液,得到余甘子多酚提取液,测定其多酚含量。
1.2.5 正交试验 本研究采用了三因素三水平的正交试验,考查浸提时间、浸提温度、乙醇浓度三个因素对余甘子多酚提取效果的影响,筛选出最适的提取条件。正交试验因素水平表如下:

表1 正交试验因素水平表
1.2.6 抗氧化性研究
1.2.6.1 总还原能力的测定 采用铁氰化钾还原法[15]测定。取2.5 mL的pH6.6磷酸缓冲溶液,加入1 mL浓度依次为0.2、0.4、0.6、0.8、1.0 mg/mL的样品和2.5 mL的1%铁氰化钾溶液,振荡混匀,在50 ℃的水浴锅中放置20 min,取出冷却至室温,再加入2.5 mL的10% TCA溶液终止反应,4000 r/min离心10 min,取2.5 mL的上清液于试管中,加入2.5 mL的去离子水和0.5 mL的0.1% FeCl3溶液振荡混匀后静止10 min,在波长为700 nm处检测其吸光度A值,平行3次实验。
1.2.6.2 DPPH自由基清除率的测定 采用DPPH清除自由基的方法[16],取3 mL的0.1 mg/mL DPPH-无水乙醇溶液,加入3 mL浓度依次为6、20、34、48、62 μg/mL的样品,静置30 min,4000 r/min离心10 min,最后在517 nm处测其吸光值为A1,以3 mL的样品和3 mL的无水乙醇在517 nm处测的吸光值为A2,以3 mL的无水乙醇和3 mL的DPPH-无水乙醇在517 nm处测得的吸光值为A3,DPPH自由基清除率的计算公式为:
DPPH自由基清除率(%)=[1-(A1-A2)]×100/A3
式中:A1为样品上清液的吸光度;A2为样品加无水乙醇的吸光度;A3为无水乙醇加DPPH上清液的吸光度。
1.2.6.3 羟自由基清除率的测定 采用水杨酸滴定法[17],利用H2O2与Fe2+反应产生·OH,加入水杨酸可以与·OH反应并产生有色物质,该物质在510 nm处有吸收峰。先向试管中加入9 mmoL/L FeSO4和1 mL的9 mmoL/L的水杨酸溶液各1 mL,浓度依次为0.4、0.8、1.2、1.6、2 mg/mL的样品2 mL,最后加入1 mL的8.8 mmoL/L H2O2进行显色反应,在37 ℃的水浴锅中反应30 min,最后在510 nm处测其吸光值为A1,以不加样品,用45%乙醇溶液代替样品在510 nm处测得的吸光值为A3;以用去离子水代替8.8 mmoL/L的H2O2在510 nm处测得的吸光值为A2,羟自由基(·OH)清除率的测定公式如下:
羟自由基清除率(%)=[1-(A1-A2)]×100/A3
式中:A1为样品上清液的吸光度;A2为不加H2O2时的吸光度;A3为空白上清液的吸光度。
1.2.6.4 自发性肝脂质氧化的抑制实验 昆明小鼠,处理前禁食禁水12 h,脱臼处死,取其肝脏,用组织捣碎机捣碎,将捣碎后的肝组织和浓度为0.9%的冰生理盐水混合,4000 r/min离心4 min,将沉淀进行再次研磨,然后混匀制成5%(m/v)的肝匀浆。采用硫带巴比妥酸显色法[18-19]进行检测,取5%肝匀浆1 mL,浓度依次为10、40、70、100、130 μg/mL的样品0.32 mL,在37 ℃的水浴锅中水浴1.5 h,回旋的转速为180 r/min,加入1 mL的EDTA和TCA的混合液(EDTA的浓度为0.1%,TCA的浓度为10%),4000 r/min离心10 min,再加入1 mL的0.67%TBA,沸水浴30 min,在532 nm处测吸光值A2,以加去离子水为空白对照,测得吸光值为A1,肝脂质氧化抑制率的计算公式为:
自发性肝脂质氧化抑制率(%)=[1-(A1-A2)]×100/A2
式中:A1为样品上清液的吸光度;A2为空白上清液的吸光度。
1.3 数据处理
2 结果与分析
2.1 没食子酸标准曲线
结果显示没食子酸的浓度在1~5 mg/mL范围内,线性回归方程为:y=0.1431x+0.0791,其中r=0.9997,线性关系良好。
2.2 单因素实验结果
2.2.1 浸提时间对多酚提取效果的影响 从图2可以看出,当浸提时间在45~135 min范围内,随着时间的增加,所提取的多酚含量逐渐增加,当浸提时间超过135 min时,随着时间的增加,所提取的多酚含量先急剧减少然后无明显变化,可能与余甘子多酚的稳定性差有关,当浸提时间过长时,其发生氧化变形的可能性增加,多酚含量出现下降。由图2可知,最适的浸提时间为135 min,此时多酚的含量为(0.1920±0.002) mg GAE/mg。
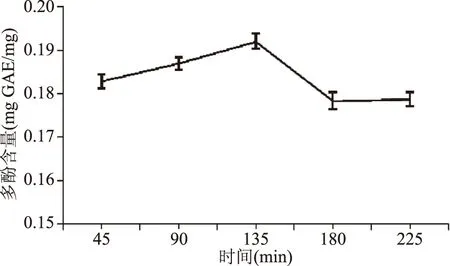
图2 不同浸提时间下多酚的提取效果
2.2.2 浸提温度对多酚提取效果的影响 从图3可以看出,当浸提温度为30~50 ℃时,各提取液中多酚含量无明显差异,当温度在60 ℃时浸提液中总多酚含量达到最高值,此时多酚的含量为(0.2036±0.002) mg GAE/mg。当浸提温度超过60 ℃时,高温会导致余甘子多酚部分降解变性,使得余甘子多酚含量降低。因此,浸提的最佳温度是60 ℃。
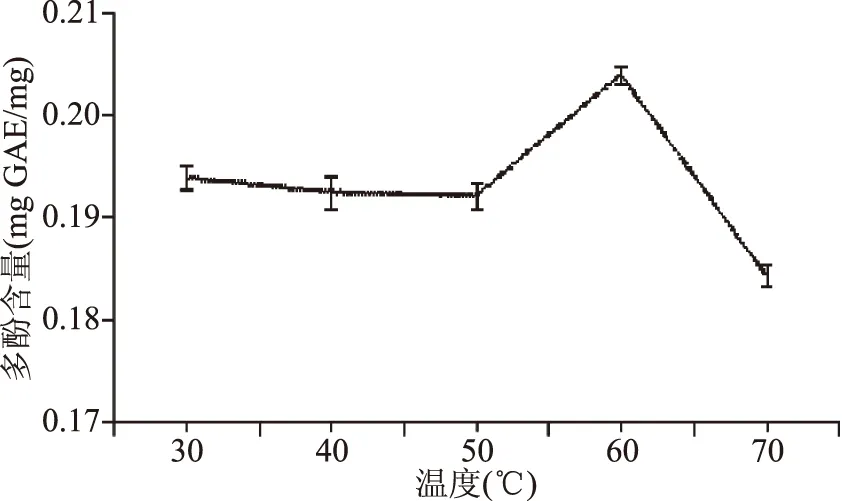
图3 不同浸提温度下多酚的提取效果
2.2.3 乙醇浓度对多酚提取效果的影响 从图4可以看出,当乙醇的浓度范围在15%~45%时,余甘子多酚随乙醇浓度增加而逐级递增,当乙醇的浓度为45%时,此时的所提取出的多酚含量最多为(0.2328±0.003) mg GAE/mg,当乙醇的浓度范围在45%~75%时,所提取的多酚含量呈明显下降趋势,这与多酚的性质有关,多酚在乙醇中的溶解度相对于水较好,但当乙醇浓度较高时,会使细胞蛋白质凝固,影响其有效成分的释放[20]。因此,浸提溶剂最佳浓度为45%。
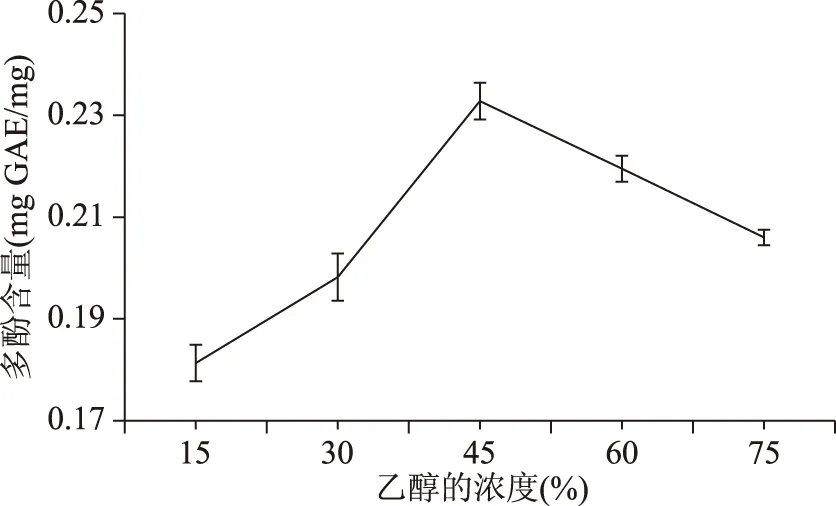
图4 不同乙醇浓度下提取多酚的提取效果
2.3 正交试验设计结果
浸提时间、浸提温度以及乙醇浓度对余甘子多酚的提取工艺存在一定的影响。从表2可以看出最优的组合是A2B3C2,此时浸提时间为135 min,浸提温度为70 ℃,乙醇的浓度为45%,所提取的多酚含量为(0.2427±0.008) mg GAE/mg。通过方差分析可知,浸提时间、浸提温度、不同乙醇浓度对余甘子多酚提取的影响极显著;这三个因素对余甘子多酚提取含量的影响大小依次为:浸提温度>乙醇浓度>浸提时间。

表2 正交试验结果

表3 方差分析
2.4 抗氧化性研究
2.4.1 总还原能力的测定 总还原能力可以解释物质抗氧化活性的原理,作为抗氧化能力评价的指标之一[21],余甘子多酚类物质中的酚羟基将K3[Fe(CN)6]中的Fe3+还原成Fe2+,亚铁氰化钾和三氯化铁在酸性条件下生成亚铁氰化铁,在700 nm处有吸收峰。从图5可以看出,在样品浓度为0.2~1 mg/mL范围内,余甘子多酚和茶多酚的总还原能力随浓度的增加而增加,余甘子多酚的总还原能力低于茶多酚。
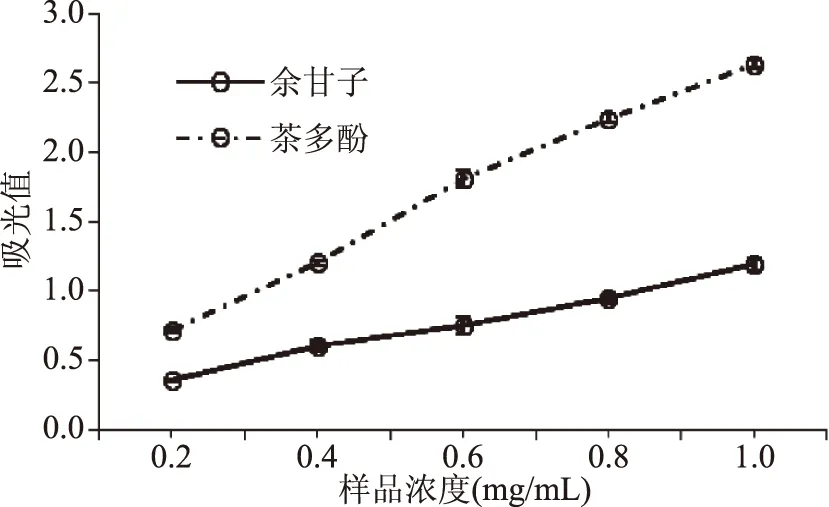
图5 各个样品总还原能力的测定
2.4.2 DPPH自由基清除率的测定 余甘子多酚类物质中的酚羟基提供电子可与DPPH自由基中的孤对电子有效的结合,从而清除DPPH自由基。从图6可以看出,在样品浓度为6~62 μg/mL范围内,余甘子多酚对DPPH自由基的清除能力明显优于茶多酚,余甘子多酚和茶多酚对DPPH自由基清除的EC50值分别为为(9±0.01)和(27.1±0.05) μg/mL。因此,余甘子多酚成分对DPPH自由基的清除能力比茶多酚强。
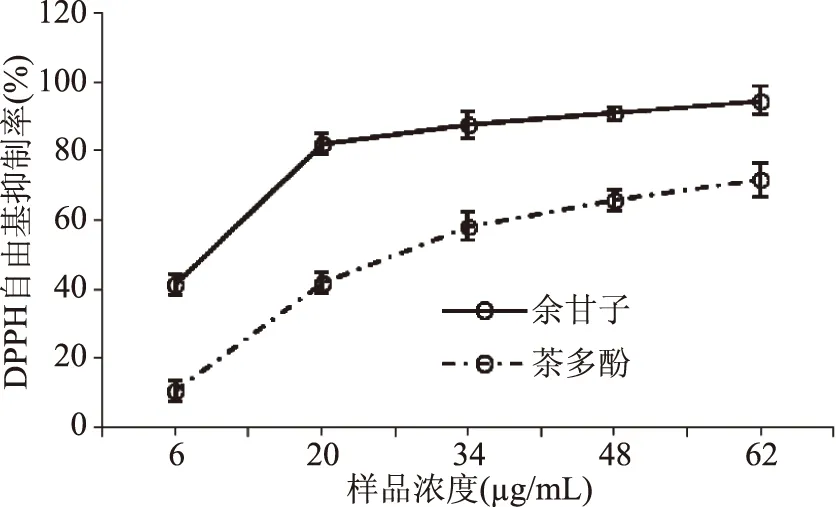
图6 DPPH自由基的清除能力
2.4.3 羟自由基清除率的测定 余甘子多酚类物质中的酚羟基作为供电子基团与具有极强吸电子能力的羟自由基结合,从而清除羟自由基。从图7可以看出,在样品浓度为0.4~1.1 mg/mL范围内,余甘子多酚对羟自由基的清除能力优于茶多酚,当样品浓度升高,在浓度为1.1~2 mg/mL范围内,余甘子多酚对羟自由基的清除能力稍低于茶多酚。进一步考察余甘子多酚和茶多酚对羟自由基清除的EC50值分别为(0.47±0.01)和(0.63±0.03) mg/mL。因此,余甘子多酚对羟自由基的清除能力优于茶多酚。
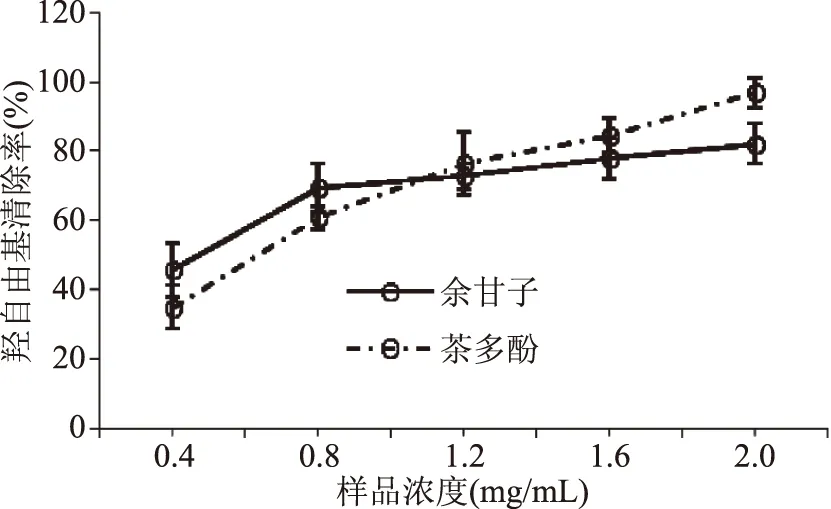
图7 多酚对羟自由基的清除作用
2.4.4 对小鼠自发性肝脂质氧化的抑制作用 肝脂质氧化产生大量的丙二醛及其它醛类物质,丙二醛可与TBA生成有色化合物在532 nm处有吸收峰。从图8中可以看出,在样品浓度为40~130 μg/mL范围内,余甘子多酚对自发性肝脂质过氧化的抑制作用明显优于茶多酚,余甘子多酚对肝脂质过氧化抑制的EC50值为(122±2) μg/mL。因此,余甘子多酚成分对自发性肝脂质氧化的抑制能力比茶多酚强。

图8 样品对肝脂质氧化的抑制作用
3 结论
浸提时间、浸提温度、乙醇浓度对余甘子多酚提取都有很大的影响。本实验以浸提时间为135 min、浸提温度为70 ℃、乙醇浓度为45%,所提取的余甘子多酚为(0.2427±0.008) mg GAE/mg,提取效果较好。通过对总还原能力、DPPH自由基和羟自由基清除率、自发性肝脂质过氧化抑制活性的测定,表明余甘子多酚的DPPH自由基清除率、羟自由基清除率、自发性肝脂质氧化抑制率均明显高于茶多酚,可以作为抗氧化剂替代品用于食品的抗氧化,也可以进一步开发为功能性食品的添加物。
