葡萄海棠果酵素发酵工艺优化及体外抑菌与抗氧化活性的研究
2019-08-28刘维兵王舸楠王犁烨武亚婷程方方马玉麒
刘维兵,王舸楠,2,王犁烨,武亚婷,殷 娜,程方方,马玉麒,武 运,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830000;2.中国食品发酵工业研究院,北京 100000)
酵素产业是生物发酵产业中的朝阳产业,酵素产业的发展符合国家产业政策要求,在国家重点发展大健康产业的环境下,酵素产业未来将会继续保持较高的发展速度,发展空间也将更加广阔。微生物酵素是以一种或多种新鲜蔬菜、水果等为原料,经多种有益菌发酵而产生的微生物发酵产品,具有抗衰老、抗菌、消炎、净化血液,增强机体免疫能力等多种保健功能[1-2]。近年来,食用酵素发展迅速,我国大陆地区食用酵素相关研究尚处于起步阶段,与发达国家和地区相比,仍有较大差距,国外的食用酵素产品在国内的售价普遍昂贵。所以,自主研发的食用酵素产品在国内有广阔市场前景[3]。但目前国内酵素产业多以多原材料天然发酵为主,所以发酵周期长,生产成本较高。
葡萄,又名蒲桃,味甘酸、性平。葡萄果实营养丰富,除含有丰富的糖、蛋白质、有机酸外,还富含花青素、多酚、维生素B(Vitamin B,VB)、维生素C(Vitamin C,VC)等多种维生素,黄酮类化合物、矿物质和多种微量元素[4]。海棠果(CalophylluminophyllumL.),又名胡桐、海桐、红厚壳、君子树、海棠木、琼州海棠,为藤黄科(Guttiferae)植物,海棠果味甘微酸、入脾、胃经、性平[5]。
新疆葡萄种植面积广、范围大、产量多,新疆鲜食葡萄产区主要分布在以无核白和马奶子为主的吐哈地区,以及以阿图什作为中心发展木纳格鲜食葡萄的昌吉、伊犁、霍城、焉耆盆地等,主要种植全红鲜食葡萄。国外80%的葡萄用于酿酒,而我国只有20%的葡萄用于酿酒,绝大多数葡萄用于鲜食,但由于鲜食葡萄受气候和市场价格的影响较大,不易储存和运输,并且对食用卫生标准要求较高,从而制约了新疆鲜食葡萄产业的发展。酿酒葡萄利润率低制约葡萄酒业发展[6]。另外,新疆海棠果种植面积正在逐渐增长,奇台全县海棠果种植面积已达2万亩,新疆伊犁也有海棠果的大面积种植。
本实验以新疆地产鲜食葡萄和海棠果为原料,酵母菌与乳酸菌先后发酵,缩短发酵时间,保证产品质量。通过真空冷冻干燥等工艺,制成葡萄海棠果酵素粉成品,以提高新疆鲜食葡萄与海棠果的利用率,延伸葡萄与海棠果的深加工产业链。
1 材料与方法
1.1 材料与仪器
葡萄、海棠果 新疆乌鲁木齐市九鼎农产品批发市场;马克斯克鲁维酵母、M40乳酸菌、大肠杆菌、白色念珠菌、金黄色葡萄球菌 新疆农业大学食品科学与药学学院食品生物发酵与质量安全研究室;纤维素酶(50000 U/g) 上海蓝季生物有限公司;果胶酶(500000 U/g) 上海源叶生物有限公司;SOD试剂盒 南京建成生物工程研究所;α,α-二苯基-β-苦苯肼(DPPH)、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS) Solarbio公司;其他试剂 均为分析纯。
5417R高速冷冻离心机 Eppendorf公司;LE2002E/02电子天平 梅特勒-托利多仪器(上海)有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;LDZX-50KBS立式高压灭菌器 上海申安医疗器械厂;HR40-ⅡA2生物安全柜、DW-86W100J医用低温保存箱 青岛海尔特种电器有限公司;Y15全自动葡萄酒检测仪 Biosystem公司;Elx50酶标仪 BioTek Instruments公司;LGJ-25C四环冻干机 北京四环科学仪器厂有限公司;MJX-100B-2霉菌培养箱 上海博讯实业有限公司医疗设备厂;E200MV R显微镜 Nikon Corporation Tokyo Japan。
1.2 实验方法
1.2.1 工艺流程 葡萄、海棠果→榨汁→灭菌→酶解→酵母菌发酵→乳酸菌发酵→真空冷冻干燥→葡萄海棠果酵素粉
1.2.2 操作要点
1.2.2.1 榨汁与灭菌 将紫外线照射1 h后的葡萄、海棠果(去籽)用榨汁机打碎,然后将葡萄海棠果果汁放入65 ℃水浴锅中,30 min巴氏杀菌。
1.2.2.2 复合酶酶解 采用纤维素酶和果胶酶酶解葡萄海棠果果汁,酶解成使微生物和人体易于利用的小分子糖类[7]。复合酶酶解葡萄海棠果果汁的工艺为:pH3.8、温度50 ℃、酶解时间180 min。加酶量按质量分数添加,纤维素酶0.4%、果胶酶0.2%[8-10]。
1.2.2.3 菌种的活化和培养 酵母菌:将斜面保藏的马克斯克鲁维酵母,接种在马铃薯葡萄糖(Potato Dextrose Broth,PDB)肉汤中进行活化,在28 ℃恒温培养箱内培养24 h。然后将菌液在马铃薯葡萄糖(Potato Dextrose Agar,PDA)培养基上进行涂布,在28 ℃恒温培养箱内培养2~3 d。菌种经过冷冻后,生长延迟期较长,故需经过两次继代培养,菌液待用[11-14]。
乳酸菌:采用MRS培养基,其他活化、培养方法同酵母菌。
1.2.2.4 接种和发酵 先在25 ℃、pH3.8条件下接种0.20%酵母菌到葡萄海棠果果汁中发酵24 h,后在37 ℃条件下,接种0.50%乳酸菌,静置发酵28 h。
1.2.2.5 真空冷冻干燥 通过真空冷冻干燥得到水分质量分数小于5%的葡萄海棠果酵素粉。真空冷冻干燥条件:冷冻温度为-45 ℃,真空度为10~20 Pa,冷阱温度为-80 ℃[15]。
1.2.3 酵母菌发酵单因素实验
1.2.3.1 最佳质量比的确定 在葡萄海棠果果汁充分溶氧的条件下,控制发酵温度为25 ℃,酵母菌接种量为0.20%,pH4.0,发酵时间为16 h,葡萄∶海棠果的质量比分别设为3∶1、1∶1、1∶3、1∶5和1∶7。发酵结束后测定酵母菌浓度和SOD酶活力,确定最佳质量比。
1.2.3.2 初始pH的确定 葡萄海棠果汁自身的pH在3.8左右。在葡萄海棠果果汁充分溶氧的条件下,控制发酵温度为25 ℃,酵母菌接种量为0.20%,质量比为1∶3,用CaCO3调节发酵液酸度,分别在pH3.6、3.8、4.0、4.2和4.4条件下进行发酵,发酵时间为16 h。发酵结束后测定酵母菌浓度和SOD酶活力,确定最适的发酵初始pH。
1.2.3.3 发酵时间的确定 在葡萄海棠果果汁充分溶氧的条件下,控制发酵温度为25 ℃,酵母菌接种量为0.20%,pH4.0,质量比为1∶3,发酵时间分别设置为8、16、24、32和40 h,发酵结束后测定酵母菌浓度和SOD酶活力,确定最适的发酵时间。
1.2.3.4 接种量的确定 在葡萄海棠果果汁充分溶氧的条件下,控制发酵温度为25 ℃,pH4.0,质量比为1∶3,分别接种0.10%、0.15%、0.20%、0.25%和0.30%酵母菌进行发酵,发酵时间为24 h。发酵结束后测定酵母菌浓度和SOD酶活力,确定最适的酵母菌接种量。
1.2.3.5 发酵温度的确定 在葡萄海棠果果汁充分溶氧的条件下,酵母菌接种量为0.20%,pH4.0,质量比为1∶3,分别控制在22、25、28、31、34 ℃条件下进行发酵,发酵时间为24 h,发酵结束后测定酵母菌浓度和SOD酶活力,确定最适的酵母菌发酵温度。
1.2.4 酵母菌发酵正交试验 根据单因素实验结果,影响酵母菌发酵的主要因素有酵母菌接种量、发酵温度、发酵时间、初始pH、质量比。故以此五因素设计L16(45)正交试验,以酵母菌数量和SOD酶活力为评价指标,确定酵母菌发酵的最佳工艺条件。
1.2.5 乳酸菌发酵单因素实验
1.2.5.1 接种量的确定 为确定乳酸菌在葡萄海棠果发酵液中的最适接种量,控制发酵温度为37 ℃,发酵时间为24 h,初始pH为3.5,接种量分别设为0%、0.25%、0.50%、0.75%、1.00%和1.25%,发酵结束后测定乳酸菌浓度和可滴定酸度。
1.2.5.2 发酵时间的确定 为确定乳酸菌在葡萄海棠果发酵液中的最适发酵时间,控制乳酸菌接种量为0.50%、发酵温度为37 ℃,初始pH为3.5,发酵时间分别设置为12、16、20、24、28和32 h,发酵结束后测定乳酸菌浓度和可滴定酸度。
1.2.5.3 发酵温度的确定 为确定乳酸菌在葡萄海棠果发酵液中的最适发酵温度,控制乳酸菌接种量为0.50%,初始pH为3.5,分别在35、37、39、41和43 ℃条件下进行发酵,发酵时间为28 h,发酵结束后测定乳酸菌浓度和可滴定酸度。
1.2.5.4 起始pH的确定 控制发酵温度为37 ℃,乳酸菌接种量为0.50%,采用CaCO3和NaOH调节葡萄海棠果发酵液酸度,调节pH在3.2、3.5、3.8、4.1和4.4条件下进行发酵,发酵时间为28 h。发酵结束后测定葡萄海棠果发酵液中乳酸菌数量和可滴定酸度含量,以此确定乳酸菌的最适发酵起始pH。
1.2.6 二次发酵中乳酸菌最佳接种时间的确定 乳酸菌利用葡萄与海棠果营养成分的速率快于酵母菌,所以先接种酵母菌进行发酵,再接种乳酸菌进行发酵[16-21]。根据试验实际情况,因为乳酸菌为二次发酵,且在酵母菌发酵中会产生许多产物及各其他指标数量会发生变化,如酵母菌数量、总糖含量、脂肪含量等,所以在二次发酵过程中,不对乳酸菌的二次发酵采取正交试验分析。
首次进行的酵母菌发酵葡萄海棠果果汁,除发酵时间外,其他发酵工艺参数均用表1正交试验确定的最佳工艺条件,将发酵时间设定为16、24、32 h。其次进行乳酸菌二次发酵,根据乳酸菌发酵单因素实验,选出的各个最佳单因素为最佳发酵工艺,来进行二次发酵葡萄海棠果发酵液,总发酵时间设定为52 h。通过测定酵母菌浓度、乳酸菌浓度、超氧化物歧化酶活力、花青素含量、多酚含量、DPPH自由基清除能力及ABTS+自由基清除能力,从而确定乳酸菌的最佳接种时间。
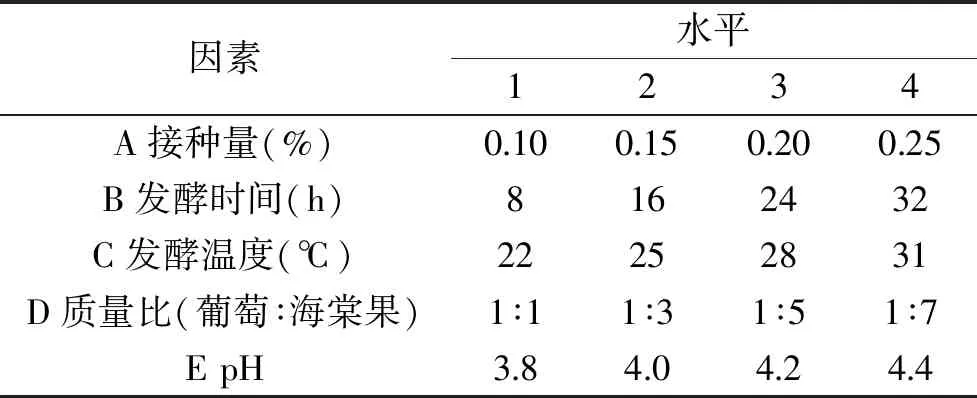
表1 L16(45)正交试验的因素与水平
1.2.7 葡萄海棠果酵素粉体外抗氧化试验 取葡萄海棠酵素粉6.0 g,用无水乙醇定容到10 mL溶液,浓度为0.6 g/mL。取该溶液适量,分别稀释到浓度为200.0、100.0、60.0、30.0、10.0和5.0 mg/mL的葡萄海棠酵素溶液,紫外分光光度计测定DPPH自由基清除率、ABTS+自由基清除率、羟基自由基清除率。
1.2.7.1 DPPH清除率测定 取葡萄海棠果酵素粉稀释液4 mL、0.02 mg/mL DPPH溶液4 mL混匀;25 ℃的恒温水浴锅中放置30 min 后,紫外分光光度计在517 nm 处测定其吸光值。空白组以4 mL无水乙醇代替样品。每组测定重复三次[22]。
式中:A0表示空白组的吸光度;A1表示样品溶液的吸光度;A2表示用无水乙醇代替DPPH时测得对应浓度的本底吸光度
1.2.7.2 ABTS+自由基清除率测定 用7 mmol/L ABTS(用5 mmol/L的PBS,pH7.4配制),加入过硫酸钾使最终浓度为2.45 mmol/L,在室温条件下黑暗放置12~16 h。使用前把ABTS+自由基用PBS稀释成在734 nm波长处吸光度为(0.7± 0.02)[23]。
取10 μL葡萄海棠果酵素粉稀释液加入到5 mL上述稀释液中,在30 ℃温度下反应5 min。以去离子水为参比溶液。在734 nm波长处测定吸光度。
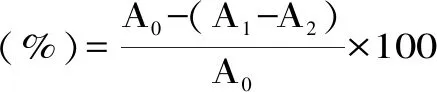
式中:A0表示空白对照液的吸光度;A1表示样品测定管的吸光度;A2表示样品本底管的吸光度。
1.2.7.3 羟基自由基清除率测定 135 μL葡萄海棠果酵素粉稀释液加入到1.4 mL的6 mmol/L H2O2,然后加入0.6 mL的20 mmol/L水杨酸钠和2 mL 1.5 mmol/L硫酸亚铁,37 ℃温度下恒温水浴1 h。以去离子水为参比溶液。在562 nm波长处测定吸光度[24]。
式中:A0表示空白对照液的吸光度;A1表示样品测定管的吸光度;A2表示样品本底管的吸光度。
1.2.8 葡萄海棠果酵素粉体外抑菌试验 酵母粉1 g、蛋白胨2 g、氯化钠1 g,加蒸馏水定容至 200 mL,固体培养基加琼脂粉4 g,121 ℃灭菌20 min。从经过活化的菌液中移取100 μL接种于LB液体培养基中,放入恒温振荡培养箱培养至对数生长期,备用。纸片法测定抑菌活性。
用打孔器将定性滤纸制成直径为0.6 cm的小圆纸片。分别吸取以上培养时间的供试菌液100 μL,均匀涂布于LB固体培养基中。将灭菌滤纸片分别放入10、20、40、80、160、320 mg/mL的葡萄海棠酵素溶液中浸泡1 min,取出并贴在含菌平板上,每皿贴1片。用无菌水浸泡的滤纸片做空白对照。大肠杆菌和金黄色葡萄球菌置37 ℃培养箱中培养12 h,白色念珠菌培养14 h[25]。培养结束后测定抑菌圈直径,结果取3个平行试验测定的平均值。
1.2.9 其他指标测定方法 酵母菌菌体浓度的测定采用血球计数板法;乳酸菌菌体浓度的测定参GB 4789.35-2010《食品微生物学检验乳酸菌检验》;可滴定酸度测定参照GB/T 12456-2008《食品中总酸的测定》;水分含量的测定参照GB 5009.3-2010《食品中水分的测定》;可溶性固形物含量采用手持折光仪测定;超氧化物歧化酶活力的测定采用SOD试剂盒;多酚含量、花青素含量的测定采用y15全自动葡萄酒检测仪。
1.3 数据处理
2 结果与分析
2.1 酵母菌发酵单因素实验
2.1.1 质量比对酵母菌发酵的影响 由图1可知,海棠果与葡萄的质量比在1∶3时,酵母菌浓度和超氧化物歧化酶的活力达到最大值,分别为6.1×108CFU/mL和368.93 U/mL。将海棠果与葡萄的质量比定为1∶1、1∶3、1∶5、1∶7用于后续正交试验。
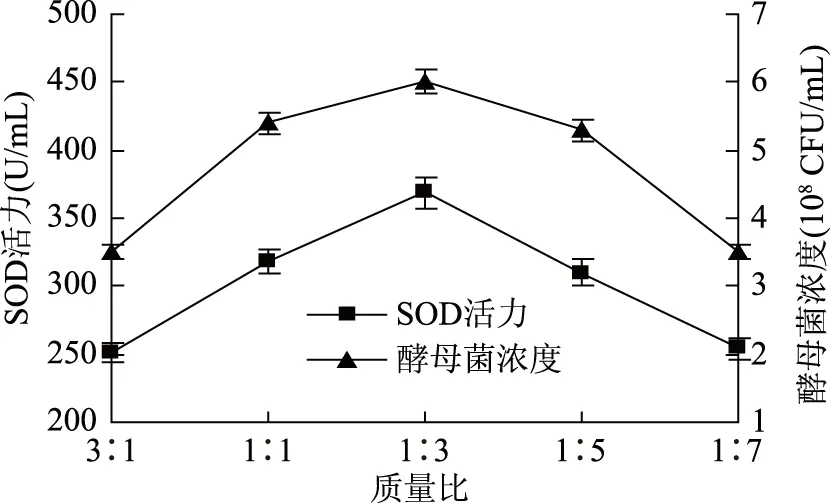
图1 质量比对酵母菌发酵的影响
2.1.2 初始pH对酵母菌发酵的影响 由图2可知,随着pH的升高,超氧化物歧化酶活力与酵母菌浓度不断升高,当pH超过4.0后,随着pH的升高,酵母菌浓度和超氧化物歧化酶活力也逐渐降低。所以当初始pH为4.0时,超氧化物歧化酶活力达到最大值379.43 U/mL,酵母菌浓度也达到最大值6.2×108CFU/mL。将初始pH设为3.8、4.0、4.2、4.4用于后续正交试验。
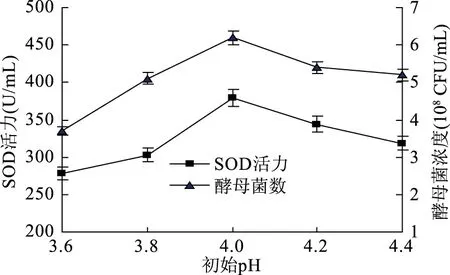
图2 初始pH对酵母菌发酵的影响
2.1.3 发酵时间对酵母菌发酵的影响 由图3可知,随着发酵时间的延长,葡萄海棠果果汁中酵母菌浓度和超氧化物歧化酶活力逐渐提高,24 h以后,酵母菌浓度和超氧化物歧化酶活力基本保持不变。将后续正交试验发酵时间设定为8~32 h。
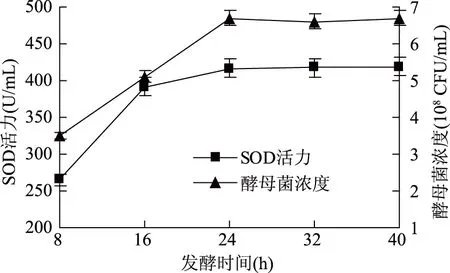
图3 发酵时间对酵母菌发酵的影响
2.1.4 接种量对酵母菌发酵的影响 由图4可知,随着酵母菌接种量的增加,葡萄海棠果果汁中的酵母菌浓度和SOD活力也随之提高,当接种量为0.2% 时,酵母菌浓度和超氧化物歧化酶活力分别达到6.4×108CFU/mL 和409.25 U/mL,当接种量超过0.2%后,酵母菌数量和超氧化物歧化酶活力基本保持不变。将酵母菌接种量设定为0.1%~0.25%用于后续正交试验。
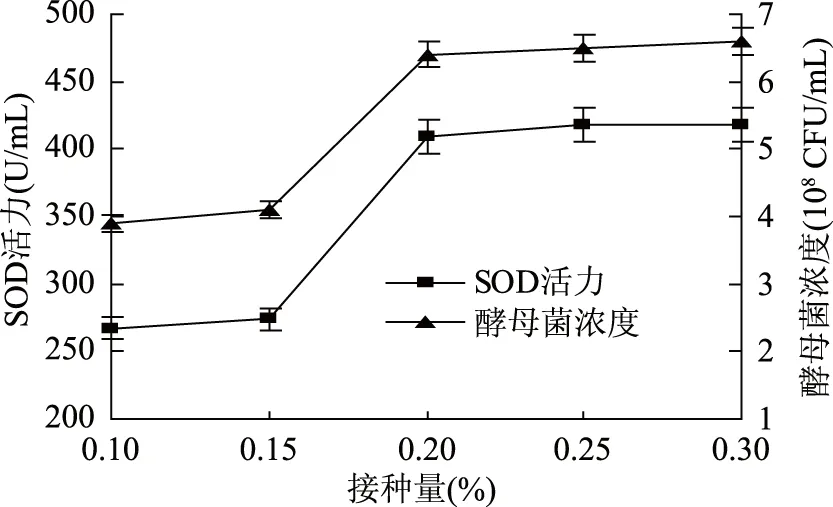
图4 接种量对酵母菌发酵的影响
2.1.5 发酵温度对酵母菌发酵的影响 由图5可知,温度在25 ℃时,酵母菌浓度和超氧化物歧化酶活力分别达到6.5×108CFU/mL 和421.23 U/mL,随着发酵温度的升高,发酵速率明显降低。将发酵温度设定为22~31 ℃用于后续正交试验。
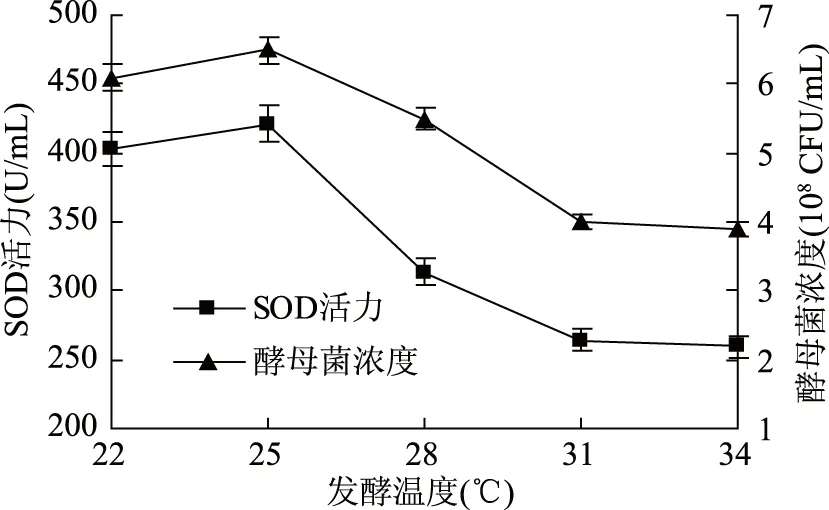
图5 温度对酵母菌发酵的影响
2.2 酵母菌发酵工艺条件优化
由表2极差值分析,影响酵母菌浓度的因素主次顺序为A>B>C>D>E,接种量酵母菌生长的主要控制因素,其次是发酵时间,最优组合是 A3B3C2D3E2。对超氧化物歧化酶活力而言,极差影响酵母菌产酶的活性的因素主次顺序为A>B>C>D>E,而且最优组合也是A3B3C2D3E2。综合来说,试验指标越大越好,对因素A、B、C分析,确定优水平为A3、B3、C2,因素D选择D3,由于葡萄海棠果汁本身pH为3.8,从经济角度考虑,选择E1。以配方A3B3C2D3E1设计试验,得出超氧化物歧化酶活力为428.12 U/mL,酵母菌浓度为7.87×108CFU/mL。故选择配方为A3B3C2D3E1为最佳配方,即接种量为0.20%,发酵时间为24 h,发酵温度为25 ℃,质量比为1∶5,初始pH3.8。
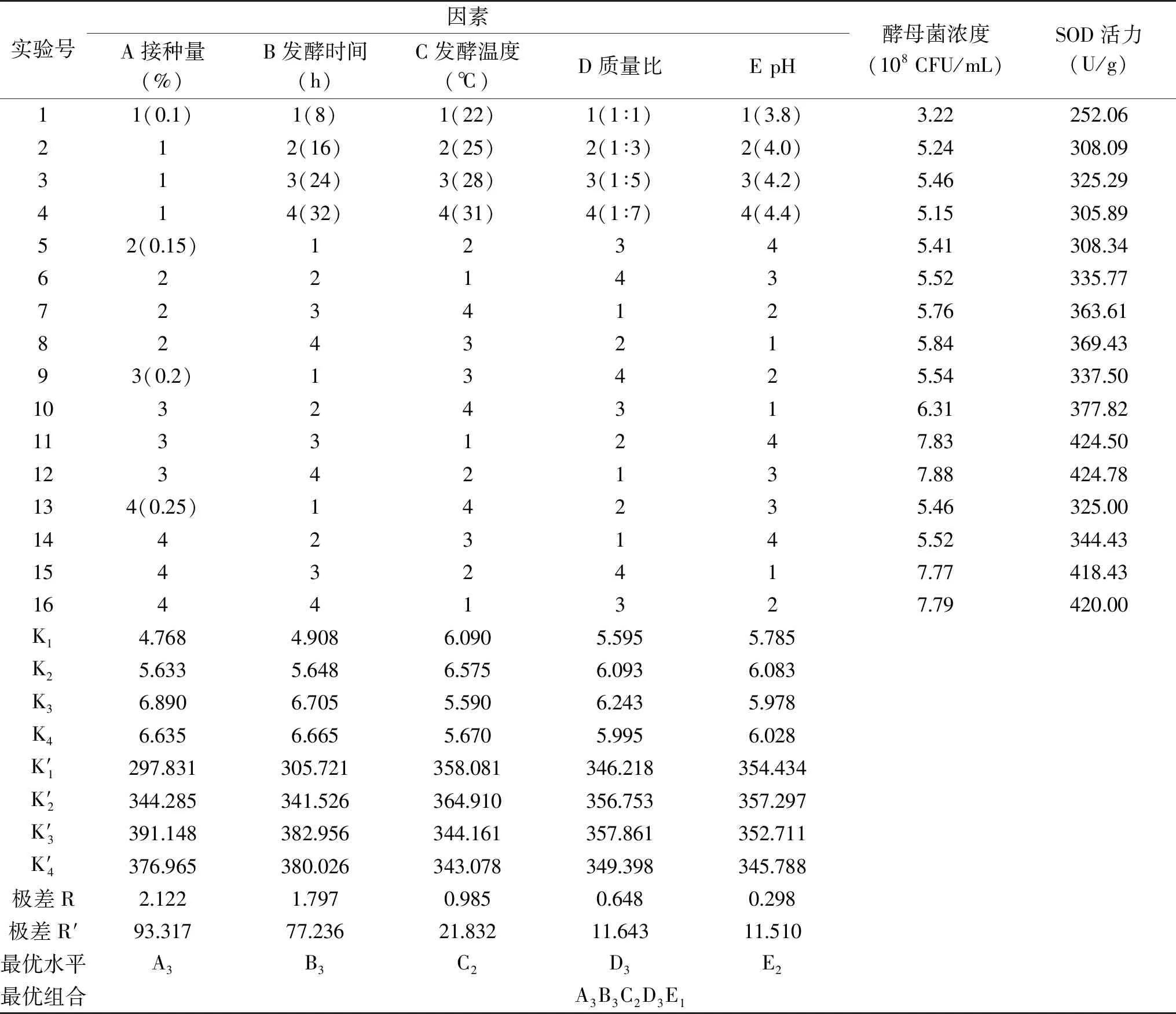
表2 L16(45)正交试验设计与结果
2.3 乳酸菌发酵单因素实验
2.3.1 接种量对乳酸菌发酵的影响 由图6可知,随着乳酸菌接种量的增加,葡萄海棠果果汁中的乳酸菌浓度和可滴定酸度随之提高,当接种量达到0.50%时,乳酸菌浓度和可滴定酸度分别达到 5.10×108CFU/mL和0.759%,当接种量超过0.50%后,乳酸菌浓度和可滴定酸度基本保持不变。故乳酸菌的最适接种量为0.50%。
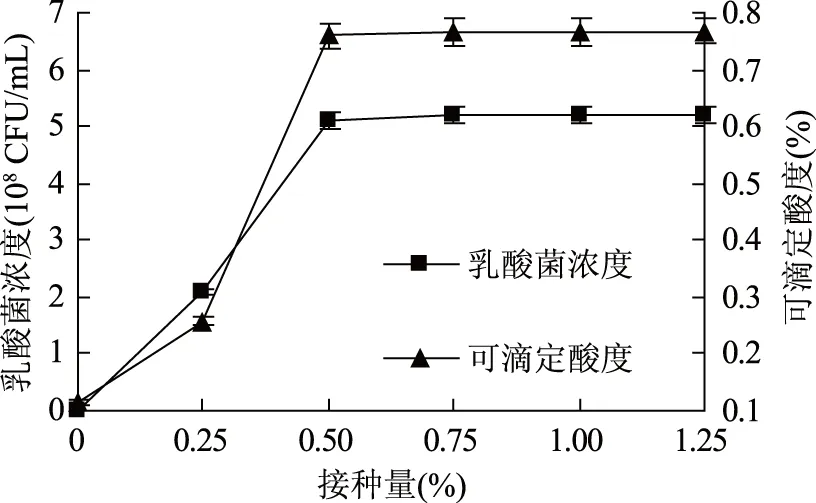
图6 接种量对乳酸菌发酵的影响
2.3.2 发酵时间对乳酸菌发酵的影响 如图7所示,在葡萄海棠果果汁中接种乳酸菌后,随着发酵时间的延长,当发酵时间达到24 h时可滴定酸度达到最大值,随着发酵时间的延长,可滴定酸度基本保持不变,发酵时间达到28 h时,乳酸菌活菌数是 5.31×108CFU/mL,此时乳酸菌活菌数达到最大值,随着时间的延长,乳酸菌活菌数略微降低,故将发酵时间定为28 h。
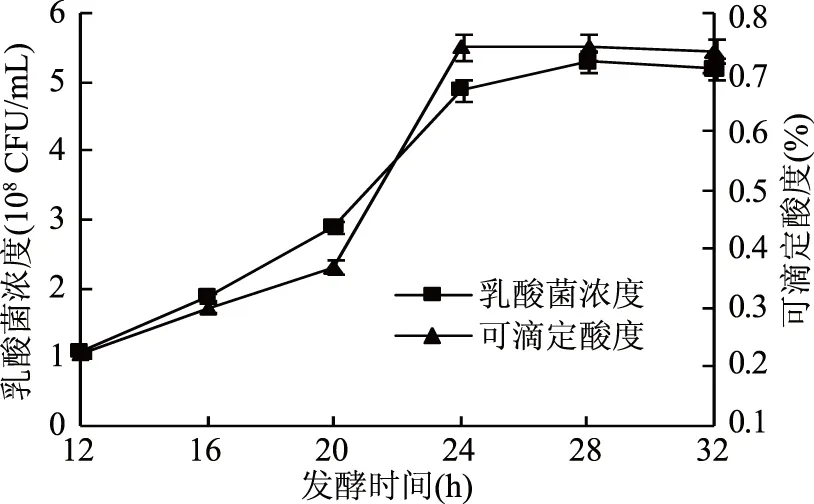
图7 发酵时间对乳酸菌发酵的影响
2.3.3 发酵温度对乳酸菌发酵的影响 由图8可知,随着发酵温度的升高,发酵速率加快,当温度达到37 ℃时,乳酸菌浓度达到最大值5.40×108CFU/mL。温度达到37 ℃以后,随着温度的升高,可滴定酸度变化不大,但乳酸菌浓度却随温度的升高而逐渐降低,所以乳酸菌的最适发酵温度为37 ℃。
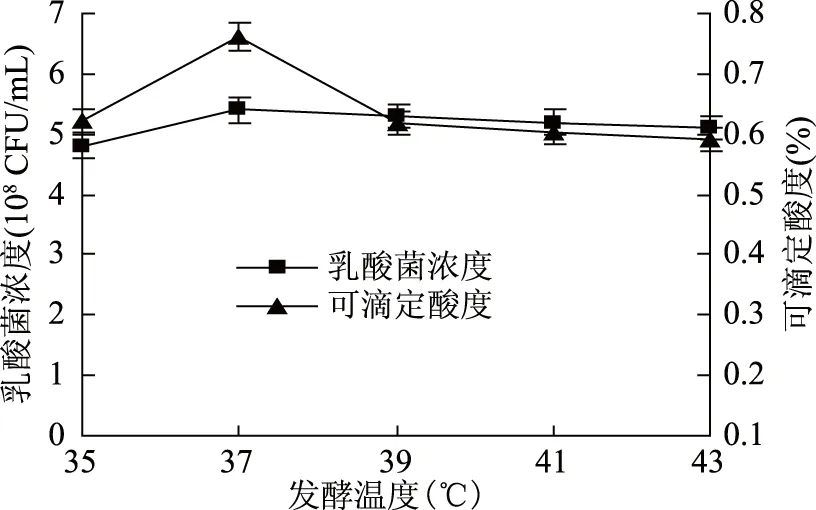
图8 发酵温度对乳酸菌发酵的影响
2.3.4 初始pH对乳酸菌发酵的影响 由图9可知,随着初始pH的变化,乳酸菌浓度基本保持在5.3×108CFU/mL、可滴定酸度基本保持在0.76%,乳酸菌发酵的初始pH可以选择为3.2~4.4。由于酵母菌发酵完葡萄海棠果果汁,得到的葡萄海棠果发酵液的pH为3.5,故选择乳酸菌发酵的初始pH为3.5。
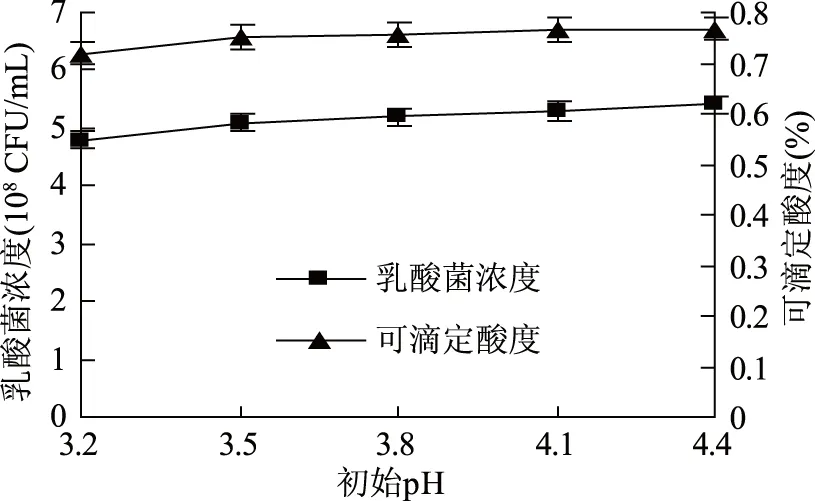
图9 初始pH对乳酸菌发酵的影响
2.4 复合发酵中乳酸菌的最佳接种时间
根据试验的实际情况,因为乳酸菌发酵为二次发酵,且在酵母菌发酵中会产生许多产物以及其他指标数量会发生变化,如酵母菌数量、可滴定酸等,所以在二次发酵过程中,不对乳酸菌的二次发酵采取正交试验分析数据的方法,而是根据最优单因素选出最佳组合进行二次发酵。
由表3可知,当酵母菌发酵16 h后再接种乳酸菌,发酵液中乳酸菌的浓度最高,但是酵母菌浓度、超氧化物歧化酶活力、多酚含量、DPPH自由基清除率、ABTS+自由基清除率和花青素含量等指标较低。当酵母菌发酵24 h后再接种乳酸菌,发酵液中酵母菌浓度、乳酸菌浓度、超氧化物歧化酶活力、多酚含量、DPPH自由基清除率、ABTS+自由基清除率和花青素含量等指标较高。
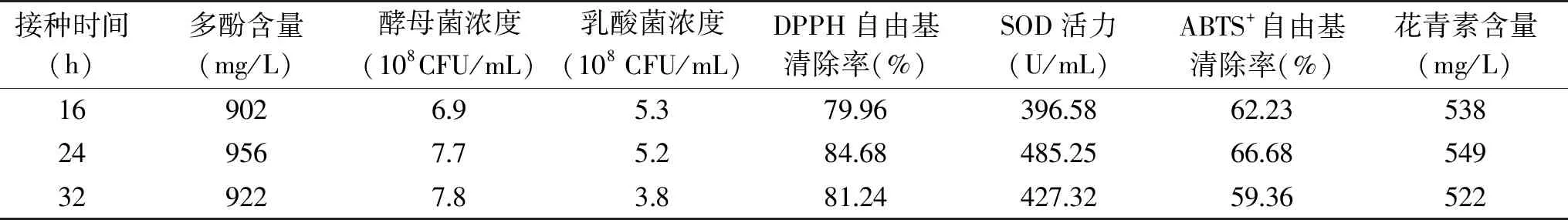
表3 二次发酵中乳酸菌的最佳接种时间对发酵液的影响
当酵母菌发酵32 h后再接种乳酸菌,虽然酵母菌浓度含量最高,但发酵液中乳酸菌浓度、超氧化物歧化酶活力、多酚含量、DPPH自由基清除率、ABTS+自由基清除率和花青素含量等指标都有所降低。综合以上各因素,酵母菌发酵24 h时接种乳酸菌为乳酸菌最佳接种时间。然后在37 ℃条件下,静置发酵28 h,在此条件下制得的发酵液中酵母菌浓度为7.7×108CFU/mL,乳酸菌浓度为5.2×108CFU/mL,超氧化物歧化酶活力为485.25 U/mL。
2.5 真空冷冻干燥制得葡萄海棠果酵素产品质量指标
2.5.1 感官指标 葡萄海棠果酵素粉为淡红色、有光泽、且颜色均匀,酵素香气独特且绵密,具有葡萄与海棠果特有的混合果香味,并伴有发酵香味,酸味纯正、持久不刺激,组织形态松散无结块,符合中国生物发酵产业协会团体标准、植物酵素行业标准[26-27]。
2.5.2 理化指标 水分含量≤5%;总酸≥0.9%,符合上述标准[26-27]。
2.5.3 微生物指标 乳酸菌浓度≥(5.1±0.5)×108CFU/g;酵母菌浓度≥(7.5±0.5)×108CFU/g:大肠杆菌、金黄色葡萄球菌、沙门氏菌、霉菌等有害微生物未检出,符合上述标准[26-27]。
2.6 葡萄海棠酵素粉的体外抗氧化试验
由图10可知,葡萄海棠果酵素对DPPH、ABTS+、羟基自由基都具有一定的清除能力,而且其清除作用随着酵素浓度的增加而增强,当浓度达到200 mg/mL时,其抑制率分别可达到(85.22%±3.2%)、(67.71%±2.4%)和(72.08%±2.5%),其中对DPPH自由基的清除作用最强,其次是羟基自由基,对ABTS+自由基的清除作用相对弱一些。
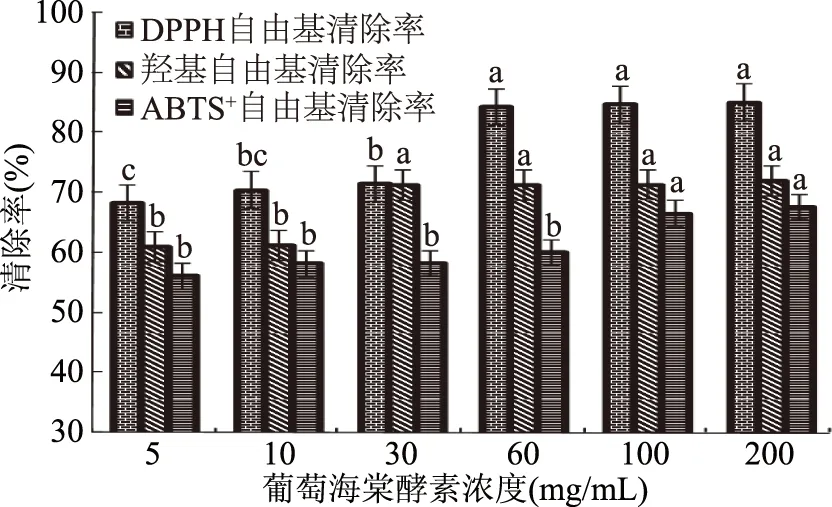
图10 不同浓度酵素对体外抗氧化能力的影响
2.7 葡萄海棠酵素粉的体外抑菌试验
由表4可以看出,葡萄海棠果酵素粉对金黄色葡萄球菌、大肠杆菌、白色念珠菌三种致病菌均有抑制作用,对金黄色葡萄球菌的抑制作用最强,其次是大肠杆菌,对白色念珠菌的抑制作用稍弱,随着葡萄海棠果酵素浓度的不断升高,对三种致病菌的抑制作用也在不断升高。
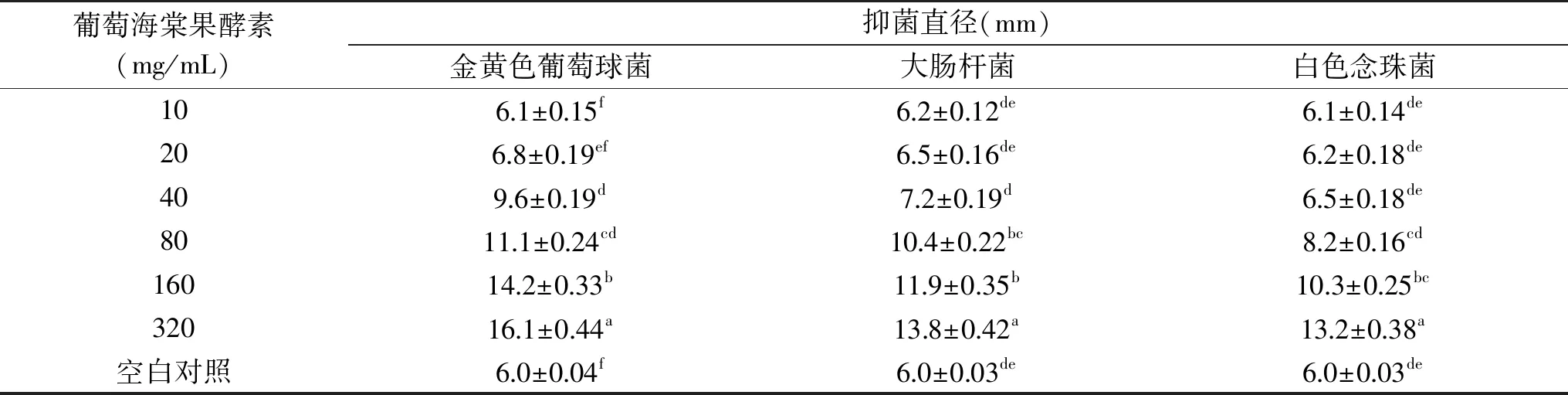
表4 不同浓度的葡萄海棠果酵素的抗菌活性
2.8 葡萄海棠果酵素的理化指标及功能成分分析
2.8.1 葡萄海棠果酵素的理化指标测试结果 对 pH、可滴定酸度、多酚、花青素的理化指标检测结果如表5。随着发酵时间的不断增加,葡萄海棠果酵素的pH,从最初的pH3.84到发酵结束时pH降低为3.45,发酵过程中益生菌发酵产生有机酸、乙酸等代谢产物,使反应体系逐渐走向成熟,多酚含量在52 h时达到(956±15) mg/L,比未发酵组的多酚含量有很大提升。发酵初期,由于葡萄与海棠果中本身富含葡萄糖、果糖,总糖含量较高,直至酵母菌发酵进入对数生长期,耗糖量也随之增加;发酵后期,乳酸菌代替酵母菌变为发酵液中的优势菌群,乙酸含量不断增加,乙醇减少。
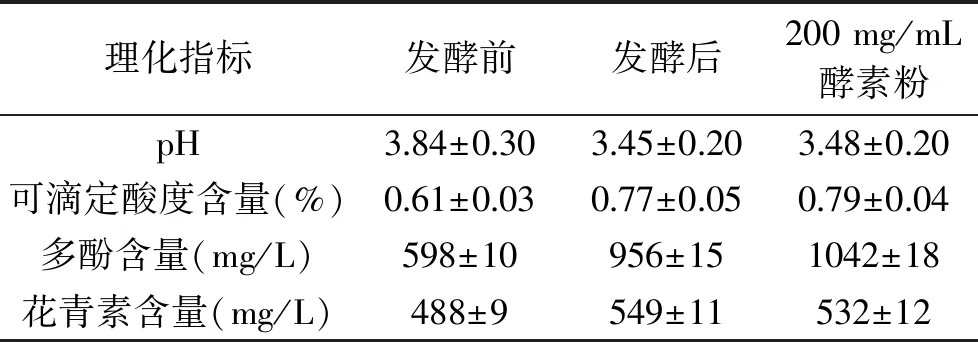
表5 发酵前后与制成粉制剂后理化指标对比
2.8.2 葡萄海棠酵素功能成分的测试结果 酵母菌和乳酸菌互相利用产生次代谢产物,从而提高酶活力与益生菌活菌数量,结果如表6所示,发酵结束时SOD酶活达到(485.25±12.5) U/mL。葡萄因本身含有黄酮类化合物,是天然的抗氧化活性物质,葡萄中单聚体酚类物质经益生菌的转化与利用,DPPH、ABTS+及羟基自由基清除率分别达到了84.68%、66.68%、71.94%。发酵时乳酸菌能为酵母菌提供碳源,如牛乳生产过程中添加的酵母菌和乳酸菌,酵母菌不能直接利用乳糖,而乳酸菌可将乳糖转化为半乳糖和葡萄糖,因此乳酸菌也为酵母菌提供了碳源;乳酸菌还可通过丙酮酸盐裂解酶将丙酮酸盐转化为甲酸盐,或者将柠檬酸盐分解为甲酸盐、乙酸盐、乳酸盐、双乙酰、乙酰甲基原醇、2,3-丁二醇等芳香物质,为发酵体系增加风味成分。有研究推测酵母菌与乳酸菌共生体系中存在一种适应反应机制,这种机制一旦被激活,酵母菌会产生“交叉保护”的现象,促使酵母菌对外界抵抗能力增强,如高渗透压、高温、较低pH等环境。随着发酵时间的推进,发酵体系中pH逐渐降低,而酵母菌活力并没有因此走向自溶或衰亡,而是与乳酸菌互相利用、达到稳定共生的平衡体系[28]。
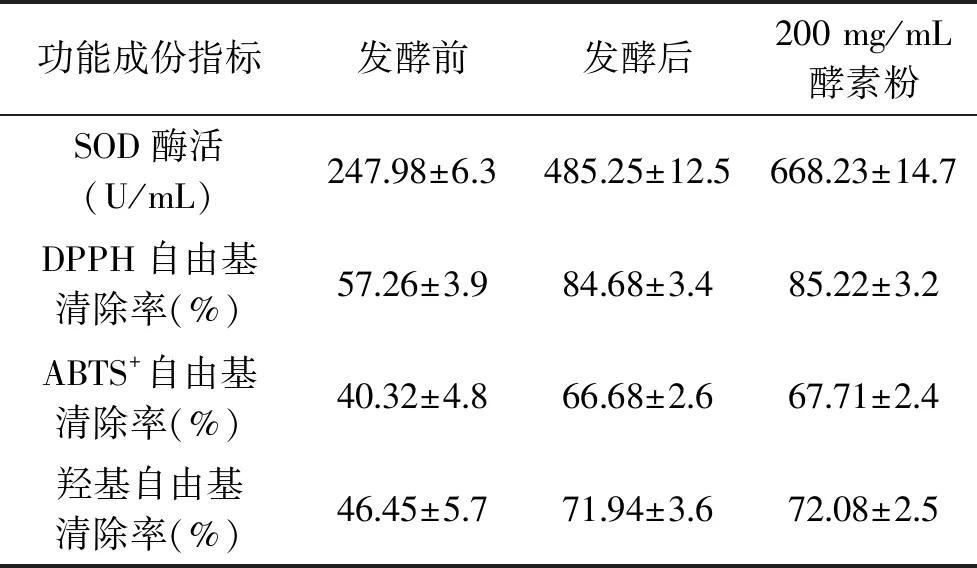
表6 发酵前、后与制成粉制剂后功能成分指标对比
3 结论
以葡萄、海棠果为原料,经复合发酵得到最佳工艺条件为:葡萄∶海棠果质量比5∶1,发酵液在温度25 ℃,初始pH3.8的条件下接种0.20%酵母菌,发酵24 h,然后在37 ℃条件下,接种0.50%乳酸菌,静置发酵28 h。得到的葡萄海棠果酵素SOD酶活力为485.25 U/mL,酵母菌浓度为7.7×108CFU/mL,乳酸菌浓度为5.2×108CFU/mL。发酵制得的酵素香气清爽、有发酵香味、酸味纯正、有淡红色光泽,且富含花青素,多酚等,有很好的抗氧化性能,且具有一定的抑菌效果。ABTS+自由基清除能力与其他自由基清除能力相比,清除率相对较低。酵素对金黄色葡萄球菌有较好的抑制作用。发酵工艺大大缩短了发酵时间,降低了生产成本,真空冷冻干燥使产品中益生菌有效保留,提高了产品品质。
