灵芝子实体和孢子粉纯化多糖体外抗氧化活性研究
2019-08-28刘宇琪郝利民鲁吉珂郑志强张黎明贾士儒
刘宇琪,郝利民,鲁吉珂,崔 燕,郑志强,张黎明,贾士儒,*
(1.天津科技大学,工业发酵微生物教育部重点实验室,天津 300457;2.军事科学院军需工程技术研究所,北京 100010;3.郑州大学生命科学学院,河南郑州 450001)
灵芝(Ganodermalucidum)是一种具有极高药用价值的灵芝属真菌,首载于《神农本草经》,具有扶正固本、延年益寿等功效[1]。灵芝多糖是灵芝活性成分之一,具有抗氧化、抗肿瘤、抗衰老等作用[2]。邢会军等[3]研究发现,灵芝多糖可以促进凋亡基因和抑制抗凋亡基因的表达来达到抑制胃癌细胞增殖的目的。Zhang等[4]研究了灵芝多糖对胰岛细胞的影响,体外实验发现灵芝多糖可以显著逆转四氧嘧啶对胰岛细胞造成的损伤,增加血清胰岛素的水平,降低血糖水平,同时抑制自由基的生成。
灵芝孢子(Ganodermalucidumspore)是由灵芝发育后期弹射出来的生殖细胞,也称担孢子,具有大量的遗传物质[5]。灵芝孢子具有多种化学成分,包括多糖、三萜类化合物、蛋白质、甾醇类、生物碱、脂肪酸、维生素、无机元素、腺苷等[6]。多糖包括以β-(1→6)-D-葡聚糖为主链的多糖、线性(1-3)-α-D-葡聚糖和以β-糖苷键链接的中性杂多糖[7]。唐庆久等[8]研究发现,灵芝孢子粉碱提多糖可以刺激小鼠骨髓巨噬细胞产生TNF-α、IL-1β和大量NO,明显增强对乳胶颗粒的吞噬功能。张丽霞等[9]的研究也证明了灵芝孢子粉多糖可以刺激小鼠腹腔巨噬细胞,提高吞噬能力。冯鹏等[10]发现灵芝孢子粉多糖可通过刺激免疫细胞,提高小鼠免疫系统功能,达到杀灭肿瘤细胞的目的,同时,灵芝孢子粉多糖还具有抗氧化能力。冯翠萍等[11]研究发现,灵芝孢子粉多糖对DPPH自由基和NaNO2具有一定清除能力,且多糖浓度越高,清除能力越强。
灵芝和灵芝孢子粉多糖的研究已有大量报道,但对同源灵芝子实体和孢子粉多糖的分离纯化及体外抗氧化活性的对比研究相对较少。本文对同源灵芝子实体和灵芝孢子粉粗多糖进行分离纯化和体外抗氧化活性的对比研究,以期为探究灵芝多糖的活性研究提供参考。
1 材料与方法
1.1 材料与仪器
灵芝子实体(Ganodormalucidum)、灵芝孢子粉(Ganodormalucidumspore powder) 安徽金寨乔康药业有限公司;2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;乙醇 天津市四通化工厂;氯仿 天津市元立化工有限公司;苯酚、浓硫酸、葡萄糖、氯化钠、葡萄糖醛酸、过硫酸钾、磷酸二氢钾、氢氧化钠、水杨酸、硫酸亚铁、铁氰化钾、三氯乙酸、氯化铁 均为分析纯。
WND-200型高速中药粉碎机 浙江省兰溪市伟能达电器有限公司;JA12002型电子天平 上海精科天平仪器厂;RE-3000型旋转蒸发仪 上海亚荣生化仪器厂;SH-D(III)型真空泵 河南予华仪器有限公司;ALPHA 1-4/LD型冷冻干燥机 德国CHRIS公司;BT102S型数控计滴自动部分收集器 保定雷弗流体科技有限公司;QL-902型漩涡振荡器 海门市其林贝尔仪器制造有限公司;UVmini-1240型紫外可见分光光度计 岛津国际贸易(上海)有限公司;TDA-8002型恒温水浴锅 天津市中环实验电炉有限公司。
1.2 实验方法
1.2.1 灵芝子实体粗多糖的提取 将灵芝子实体于60 ℃下烘干,粉碎。取适量灵芝子实体粉末按料液比1∶6 (W/V)加入95%乙醇浸泡24 h,以去除部分色素和醇溶性杂质。浸泡后减压抽滤,将滤渣于60 ℃下烘干备用。精确称量干燥后的子实体粉末,按料液比1∶20 (W/V)加入蒸馏水,90 ℃水浴提取2 h,提取2次,抽滤并合并滤液,真空浓缩至约50 mL。加入3倍体积的95%乙醇,使得乙醇终浓度为75%,4 ℃沉淀12 h,4000 r/min离心15 min,弃去上清液。用95%乙醇再次洗涤沉淀并离心,将沉淀冷冻干燥后得子实体粗多糖(GLP)[12]。
1.2.2 灵芝孢子粉粗多糖的提取 称取一定量灵芝孢子粉,按料液比1∶20 (W/V)加入蒸馏水,90 ℃水浴提取12 h,抽滤并合并滤液,将滤液真空浓缩至约50 mL。将灵芝孢子粉浸提液依照提取灵芝子实体多糖的方法进行乙醇沉淀、冷冻干燥,得到灵芝孢子粗多糖(GLSP)[13]。
1.2.3 DEAE-650离子交换柱分离 采用Sevage法[14]对GLP和GLSP除蛋白,去除蛋白和氯仿相,收集水相,重复此步骤至蛋白层不再出现。收集水相,采用AB-8大孔吸附树脂除色素。收集样品,冷冻干燥。称取除蛋白并脱色的多糖样品50 mg,充分溶解于5 mL蒸馏水中,上样于DEAE-650纤维素层析柱中,依次使用蒸馏水、0.2、0.4和0.6 mol/L的NaCl溶液进行梯度洗脱,流速为1.0 mL/min,自动收集器每5 mL收集1管。用苯酚-硫酸法测定管中的多糖含量。以收集的管数为横坐标,490 nm处吸光度值为纵坐标,绘制DEAE-650离子交换柱层析洗脱曲线。依据洗脱峰型,合并相同组分,浓缩,冻干。
1.2.4 多糖含量 本实验采用苯酚-硫酸法测定多糖含量[15]。
1.2.4.1 标准曲线的绘制 葡萄糖标准溶液(0.15 g/L)的制备:取葡萄糖(AR)于105~110 ℃下烘干至恒重,精确称取0.15 g葡萄糖,先取少量蒸馏水溶解,然后加水定容至1000 mL,4 ℃保存。
苯酚试剂(6%)的制备:称取6.0 g重蒸酚,用蒸馏水溶解并定容至100 mL,制成6%苯酚溶液。
分别吸取葡萄糖标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL于试管中并标号,将每个试管补水至总体积为2 mL,以2 mL蒸馏水为空白对照。分别向每支试管中加1.0 mL 6%苯酚试剂,混匀,再向每个试管加5 mL浓硫酸,混匀,室温下放置20 min,在490 nm下测定吸光度,以葡萄糖含量(mg)为横坐标,以OD490为纵坐标,绘制标准曲线(y=5.48762x-0.00457,R2=0.99798)。
1.2.4.2 多糖含量的测定 配制适当浓度的待测品溶液,取待测样品1 mL于试管中,加入1 mL蒸馏水,以2 mL蒸馏水为空白对照。分别向每支试管中加1 mL苯酚试剂,混匀,立即加5 mL浓硫酸,混匀,室温下放置20 min后测定波长490 nm下的吸光度,根据葡萄糖标准曲线计算多糖含量。
1.2.5 体外抗氧化活性的测定
1.2.5.1 ABTS+自由基清除能力的测定 参考林恋竹等[16]的方法并进行适当修改。将等体积7.4 mmol/mL的ABTS和2.6 mmol/mL的过硫酸钾溶液混合,室温避光下静置12~16 h,制成ABTS储备液。用pH7.4的磷酸缓冲液稀释储备液,使其在734 nm下的吸光度在0.70±0.02,制成ABTS工作液。取不同质量浓度的纯化多糖样品以及VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)各1 mL,加入ABTS工作液6 mL,混合均匀,室温下静置6 min,测定734 nm下的吸光度,以VC为阳性对照。根据式(1)计算ABTS自由基清除率:
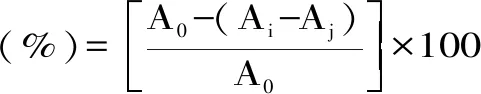
式(1)
式中:Ai为样品组吸光度;Aj为样品本底吸光度(以等体积蒸馏水代替ABTS工作液);A0为空白对照组吸光度(以等体积蒸馏水代替多糖样品溶液)。
1.2.5.2 DPPH自由基清除能力 DPPH自由基清除能力根据Gong等[17]的方法稍作修改。取不同浓度多糖样品及VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)各1 mL,分别加入1 mL 0.5 mmol/mL DPPH溶液、10 mL 60%乙醇,混合均匀,在室温下静置30 min,测定517 nm下的吸光度,以VC为阳性对照。根据式(2)计算DPPH自由基清除率:
式(2)
式中:Ai为样品组吸光度;Aj为样品本底吸光度(以等体积无水乙醇代替DPPH溶液);A0为空白对照组吸光度(以等体积蒸馏水代替多糖样品溶液)。
1.2.5.3 羟基自由基清除能力 根据Liu等[18]的方法稍作修改。取不同浓度样品及VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)各1 mL,加入5 mmol/mL FeSO4溶液2 mL,蒸馏水2 mL,5 mmol/mL水杨酸-乙醇溶液2 mL以及5 mmol/mL H2O2溶液2 mL,混合均匀,室温下放置30 min,测定510 nm下的吸光度,以VC为阳性对照,按式(3)计算羟基自由基清除率:
式(3)
式中:Ai为样品组吸光度;Aj为样品本底吸光度(以等体积蒸馏水代替H2O2溶液);A0为空白对照组吸光度(以等体积蒸馏水代替多糖样品溶液)。
1.2.5.4 还原能力 根据Fan等[19]的实验方法稍作修改。取不同浓度样品及VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)各1 mL,加入1%(W/V)铁氰化钾溶液1 mL、pH6.6的磷酸缓冲液1 mL,混合均匀,50 ℃水浴反应20 min,加入10%(W/V)三氯乙酸2 mL,3000 r/min离心10 min,取上清液2 mL加入蒸馏水2 mL、0.3%(W/V)三氯化铁0.4 mL,混合均匀,50 ℃水浴反应10 min,测定700 nm下的吸光度,以VC为阳性对照。根据式(4)计算还原能力:
还原能力=A1-A2
式(4)
式中:A1为样品组吸光度;A2为样品本底吸光度(以等体积蒸馏水代替三氯化铁溶液)。
1.3 数据处理
所有试验均进行3 次重复,结果表示为平均值±标准偏差(Mean±SD),采用Origin 8.5对结果进行分析。
2 结果与分析
2.1 GLP和GLSP DEAE-650离子交换树脂洗脱曲线
采用DEAE-650离子交换树脂对灵芝子实体粗多糖(GLP)和灵芝孢子粉粗多糖(GLSP)进行分离纯化,结果分别如图1和图2所示。用水和NaCl溶液洗脱,均得到两种组分,分别为水洗脱得到的多糖(GLP-1和GLSP-1)和0.2 mol/L NaCl洗脱得到的多糖(GLP-2和GLSP-2)。
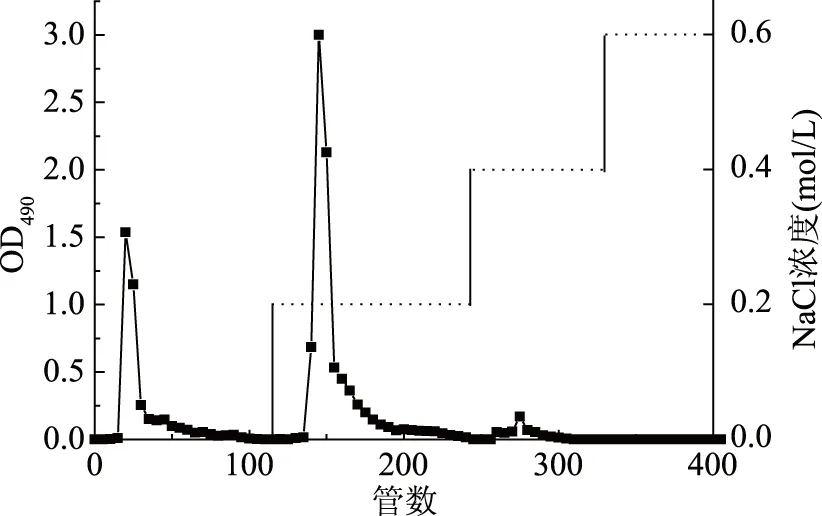
图1 灵芝子实体多糖(GLP)DEAE-650洗脱曲线
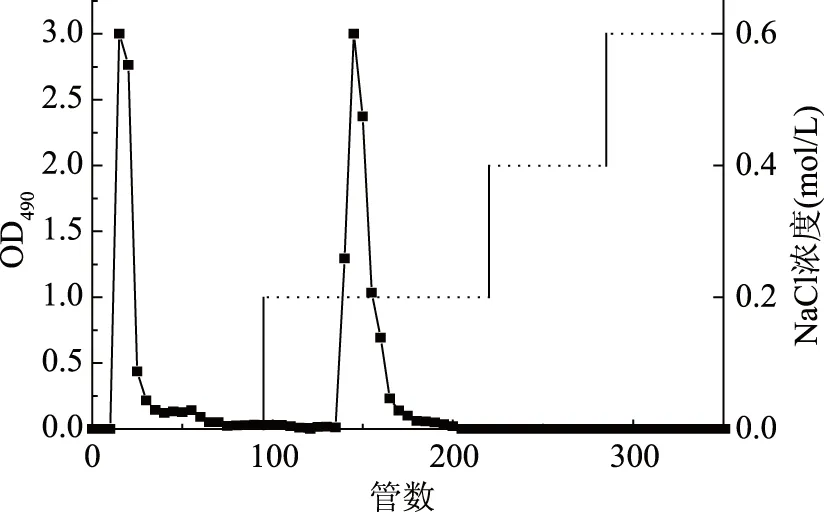
图2 灵芝子孢子粉多糖(GLSP)DEAE-650洗脱曲线
2.2 体外抗氧化活性分析
2.2.1 ABTS+自由基清除能力测定结果 无色的ABTS经过硫酸钾氧化后可以形成稳定的蓝绿色水溶性ABTS+自由基(ABTS+·),在734 nm下有特征吸收峰,抗氧化剂与ABTS+·反应可使之褪色,根据褪色情况可判断样品抗氧化能力[20]。
图3为四种纯化多糖样品(GLP-1、GLSP-1、GLP-2和GLSP-2)的ABTS+自由基清除能力结果。由图3可知,五种样品均有一定的ABTS+自由基清除能力,且在实验浓度范围内,多糖浓度越高,ABTS+自由基清除率越高,其中GLP-2对ABTS+自由基的清除能力最强。GLP-1的ABTS+自由基清除能力最低,在1.0 mg/mL时为63.16%,GLSP-1在1.0 mg/mL时ABTS+自由基清除能力为75.84%,GLSP-2在1.0 mg/mL时ABTS+自由基清除能力为80.27%。在0.2~1.0 mg/mL的浓度范围内GLP-2对ABTS+自由基的清除率几乎均在95%以上,与VC相当。
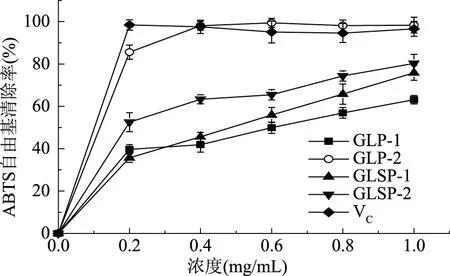
图3 GLP-1、GLP-2、GLSP-1、GLSP-2对ABTS+自由基的清除能力
2.2.2 DPPH自由基清除能力测定结果 DPPH自由基是一种相对稳定的自由基,其可以接收电子或氢自由基而成为稳定的分子,所以被广泛应用于测定自由基的清除能力[17]。DPPH自由基的醇溶液呈紫色,在517 nm下有最大吸收波长,且吸光度与浓度呈线性关系。向反应体系中加入具有清除自由基能力的样品,可以结合DPPH自由基,使之数量减少,溶液颜色变浅,吸光度减小,由此可判断DPPH自由基清除能力[21]。
图4为四种纯化多糖在0.2~1.0 mg/mL范围内对DPPH自由基清除能力的结果。四种纯化多糖对DPPH自由基的清除能力随浓度升高基本没有变化。四种纯化多糖对DPPH自由基的清除能力均低于VC,GLP-2的DPPH自由基清除能力略高于其他三种纯化多糖,且在0.4 mg/mL之后清除率基本不变,在1.0 mg/mL时,清除率为75.88%。GLP-1对自由基的清除能力随浓度的升高而有小幅波动,在1.0 mg/mL时清除率为60.57%。GLSP-1对DPPH自由基的清除能力与GLP-1相近,均在样品浓度范围内有小幅变化,在1.0 mg/mL时清除率为54.98%。GLSP-2在0.2~0.6 mg/mL的浓度范围内,对DPPH自由基清除能力没有明显变化,在0.6~1.0 mg/mL的浓度范围内的清除能力有小幅下降。
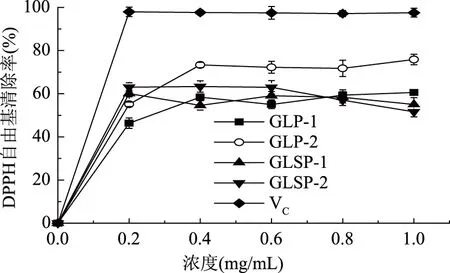
图4 GLP-1、GLP-2、GLSP-1、GLSP-2对DPPH自由基的清除能力
2.2.3 羟基自由基清除能力测定结果 羟基自由基(·OH)是免疫活动中产生的副产物,存在时间短,是最活泼的自由基之一,可以损伤生物大分子,如核酸、脂质或氨基酸,从而损害人类健康[22]。FeSO4和H2O2反应会生成·OH,水杨酸能够与之结合,生成紫色产物,在510 nm波长处有最大吸收。通过比色法测定样品对·OH的清除率,进而分析其抗氧化能力[23]。
图5为四种纯化多糖的羟基自由基清除能力。由图可以看出,除GLSP-1外,其他三种纯化多糖的羟基自由基清除能力均随着各样品浓度的增加而提高,在1.0 mg/mL时,GLP-1、GLP-2和GLSP-2的羟基自由基清除能力分别为64.28%、81.55%和61.99%。在0~0.6 mg/mL的样品浓度范围内,GLSP-1的羟基自由基清除能力逐步提高,在0.6 mg/mL时为56.50%,在0.6~1.0 mg/mL的浓度范围内,则由56.50%逐步下降至52.64%。这表明,在一定浓度范围内的GLSP-1对羟基自由基的清除能力随多糖浓度提高而提高,超出这一范围之后则清除能力有所下降。整体来看,GLP-1、GLSP-1和GLSP-2对羟基自由基的清除能力相差不大,GLP-2的羟基自由基清除能力要显著(p<0.05)高于其他三种纯化多糖。在实验范围内,四种纯化多糖的羟基自由基清除能力均低于VC,其中GLP-2最高,相较于其他三种多糖与VC更为接近。
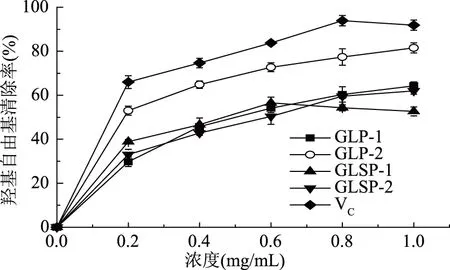
图5 GLP-1、GLP-2、GLSP-1、GLSP-2对羟基自由基的清除能力
2.2.4 还原能力测定结果 还原性通常与还原酮的存在有关,还原酮可以提供氢电子,中断自由基连锁反应来达到抗氧化的目的。还原酮还可以与一些过氧化物的前体物反应,阻止过氧化物的形成[24]。样品中的抗氧化剂可以将Fe3+还原为Fe2+,Fe2+可以与三氯化铁结合生成普鲁士蓝,普鲁士蓝在700 nm处有最大吸收峰。以Fe3+还原为Fe2+的量即可判断样品的还原能力。
由图6可知,四种纯化多糖均有一定还原能力,在实验浓度范围内均呈现一定的浓度依赖性。整体来看,除GLP-2外,GLP-1、GLSP-1和GLSP-2三种纯化多糖还原能力相差不大,在1.0 mg/mL时,这三种纯化多糖还原能力依次为0.283、0.471和0.291,均低于VC,而GLP-2还原能力整体均高于其他三种多糖,在1.0 mg/mL时其还原能力为0.728。
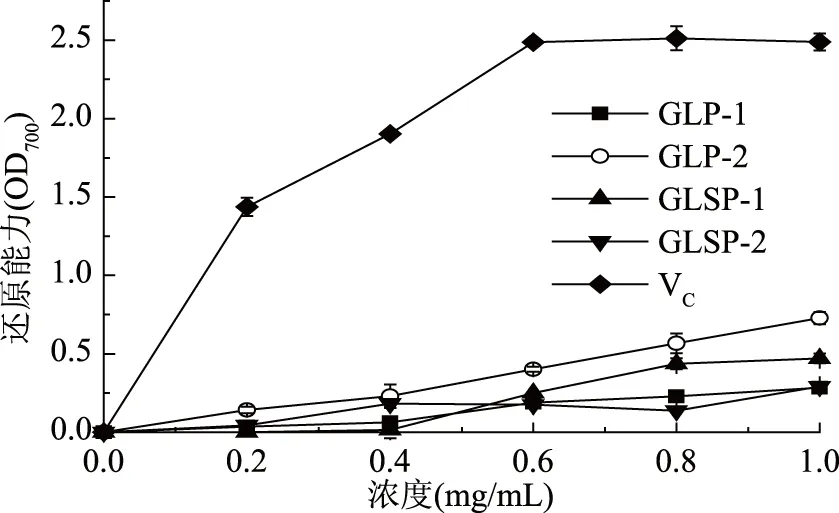
图6 GLP-1、GLP-2、GLSP-1、GLSP-2还原能力
3 讨论与结论
本文主要对灵芝子实体和灵芝孢子粉中的粗多糖进行了提取,并采用DEAE650离子交换柱利用水和不同浓度NaCl对其洗脱进行分离。从灵芝子实体粗多糖(GLP)和灵芝孢子粉粗多糖(GLSP)中均分离出两种多糖,分别为水洗脱得到的纯化多糖(GLP-1、GLSP-1)和0.2 mol/L NaCl洗脱得到的纯化多糖(GLP-2、GLSP-2)。4种纯化多糖均具有一定抗氧化能力,其中GLP-2的ABTS+自由基清除率、DPPH自由基清除率、羟基自由基清除率和还原能力均高于GLP-1、GLSP-1和GLSP-2,特别是其ABTS自由基清除率高达98.09%,与VC相当。对比Fan等[19]提取的灵芝粗多糖在浓度为1.5 mg/mL时,对DPPH自由基的最高清除率为63.7%,而GLP-2在浓度为0.4 mg/mL时,对DPPH自由基的清除率可达75.88%。同时,Tan等[25]提取的灵芝粗多糖在浓度为2 mg/mL时,对羟基自由基的清除率约为41.05%,而GLP-2在浓度为1.0 mg/mL时,对羟基自由基的清除率为81.55%,由此推测,纯化灵芝多糖的DPPH清除能力和羟基自由基清除能力可能高于灵芝粗多糖。
通过对灵芝子实体和孢子粉纯化多糖体外抗氧化活性的对比研究,可以看出,同源的灵芝子实体和孢子粉多糖的抗氧化活性存在着较大差异,这可能与多糖的组成、结构等的差异有关,未来应对多糖组成、结构等与其抗氧化活性之间的关系进行深入研究,为食药用菌多糖的研究与应用提供更多参考。
