OncoVee® MiniPDXTM模型指导驱动基因阴性的晚期非小细胞肺癌患者化疗的疗效分析
2019-08-28陈漪雯刘妮龙姜昊声GuoLin
陈漪雯 刘妮龙 姜昊声 贾 麟 Guo Lin 丁 罡
肺癌是中国发病率最高的恶性肿瘤,且多发现时已为晚期[1]。PDX模型已被证明可以预测临床结果,并被用于临床前药物评估、生物标志物识别、生物研究和个性化药物策略[2-3]。OncoVee®MiniPDXTM模型(以下简称MiniPDX模型)只需7天左右就可以完成药物敏感性测试,比PDX模型更快。本研究对10例晚期NSCLC患者进行了药物敏感性试验,采用两种最有效的药物治疗。然后将患者的预后与20例应用常规化疗的肺鳞癌患者进行比较。研究结果表明,药物敏感性指导下的化疗比常规化疗的总生存时间(OS)和无进展生存时间(PFS)明显提高,疗效更好。
1 材料与方法
1.1 组织标本采集
取上海国际医学中心2017年6月至2019年5月肿瘤科驱动基因阴性的晚期(Ⅳ期)NSCLC住院患者(年龄≤75岁,KPS评分高于70分、预计生存时间大于3个月)的新鲜组织标本。
1.2 随访
化疗期间每2个月随访1次,化疗结束每3个月随访1次。复查项目包括:病史、体格检查、胸部CT、颈腹部超声,必要时行脑核磁共振成像(MRI)、骨扫描。近期疗效评价:参照实体肿瘤评价标准(RECIST),分为完全缓解、部分缓解、病灶稳定和疾病进展。研究终点:总生存时间(OS),从治疗之日起至最后一次随访或死亡之日止。无进展生存时间(PFS),从治疗之日起至最后一次随访或肿瘤进展止。最后一次随访时间为2019年5月。
1.3 MiniPDX模型和药物敏感性测定
采用10例肺癌原发病灶(肺穿刺取得)建立MiniPDX模型。采用OncoVeeTM-MiniPDX法检测药物敏感性。简要地说,用汉克平衡盐溶液(HBSS)冲洗肺癌标本,去除非肿瘤组织和坏死的肿瘤组织。切片后,用胶原酶37 ℃消化肿瘤组织1~2小时,收集细胞,去除血细胞和成纤维细胞。然后,将肺癌细胞悬液转移到HBSS冲洗胶囊中。使用CellTiter-Glo®荧光细胞活力测定法,基于相对荧光单位(RFU)评估抗肿瘤活性。增殖率计算公式为:肿瘤细胞相对增殖率(%)=(Ⅴ药物处理组d7-Ⅴ对照组d0)/(Ⅴ对照组d7-Ⅴ对照组d0) ×100%(Ⅴ药物处理组d7:第7天给药组荧光值;Ⅴ对照组d7:第7天对照组荧光值;Ⅴ对照组d0:第0天对照组荧光值)。
1.4 统计分析
数据以平均标准差(SD)表示。采用非配对t检验分析正态分布连续变量。采用Kaplan-Meier法对OS和PFS进行分析。皮尔森卡方检验是用于分析临床病理的变量之间的相关性和药物敏感性。所有统计分析均使用SPSS 20.0软件。所有分析均以P<0.05为差异有统计学意义。
2 结果
MiniPDX模型得出驱动基因阴性的晚期NSCLC患者的药物敏感性模式细胞活力测定显示,培美曲塞、吉西他滨、白蛋白结合紫杉醇、多西他赛、长春瑞滨、依托泊苷、卡铂、顺铂治疗肺癌的细胞平均增殖率分别为46.1%、59.8%、43.0%、59.7%、69.9%、78.1%、55.3%、48.2%。药物敏感性差异较大,提示需要个体化治疗。
在延长驱动基因阴性的NSCLC患者生存期方面,MiniPDX引导化疗优于常规化疗。队列包括19例男性和11例女性,全组患者平均年龄64.5岁(42~75岁)。MiniPDX引导化疗组的患者包括男性6例(60%),女性4例(40%),平均年龄66岁(51~75岁)。常规化疗组的患者包括男性13例(65%),女性7例(35%),平均年龄63.8岁(42~74岁)。MiniPDX引导化疗组与常规化疗组具有相似的人口统计学和基线特征(表1)。采用Kaplan-Meier法分析显示(图1):MiniPDX引导化疗组患者中位OS明显延长(18.2个月;95% CI 17.4~19.0个月),高于常规化疗组(16.1个月;95% CI 14.7~17.5个月)(P=0.004)。MiniPDX引导化疗组患者中位PFS也显著延长(7.4个月;95% CI 7.1~7.7个月),优于常规化疗组(5.4个月;95% CI 4.5~6.2个月)(P=0.000)。

表1 两组患者临床病理特征比较(例,%)
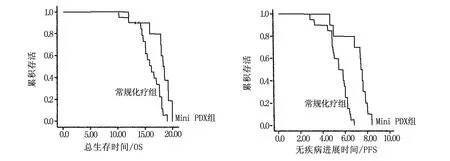
图1 Kaplan-Meier法 生存函数图
3 讨论
由于缺乏能够可靠预测新型药物对癌症患者疗效的临床前模型,癌症药物开发一直受到阻碍。近年来,PDX模型在预测各种肿瘤的化学敏感性方面比传统模型更受欢迎[4]。在此,我们提出了优化的MiniPDX模型在指导驱动基因阴性的NSCLC患者辅助化疗中的临床前和临床证据。此外,在前瞻性比较PDX引导化疗与常规化疗的疗效时,我们发现PDX引导化疗显著提高了驱动基因阴性的晚期NSCLC患者的生存结局。
大多数转化性癌症研究需要有效的临床前模型。在传统细胞系的帮助下,用于药物筛选的人类癌症模型始于上世纪70年代。虽然方便易用,这些基于细胞系的研究缺乏特定癌症类型的临床应用预测价值。临床前PDX模型克服了传统细胞系模型的局限性,现在更常用。这些模型可以提供药物敏感性,模拟癌症患者对细胞毒性药物的临床反应[5]。此外,由于PDX模型与个体患者肿瘤的病理特征和遗传特征具有良好的相关性,它们正成为改善药物开发过程的首选临床前工具。然而,建立PDX模型的时间较长,限制了其在恶性肿瘤中的应用,更不用说在PDX模型中,肿瘤异种移植形成需要几个移植周期,这可能会改变原移植肿瘤的性质。报道显示,最终形成的肿瘤异种移植瘤随后具有更强的侵袭性表型,表现更像转移性肿瘤。大多数肺癌患者在晚期被诊断,因此需要立即开始抗肿瘤治疗。从这个角度来看,MiniPDX模型是更合适的选择。
目前,培美曲塞、吉西他滨、白蛋白结合紫杉醇、多西他赛、长春瑞滨、依托泊苷、卡铂和顺铂是治疗非小细胞肺癌最有效的八种细胞毒药物[6]。这些药物的单一或联合化疗已显示出改善非小细胞肺癌患者的中位生存率。在本研究中,使用MiniPDX模型分别检测8种化疗药物的疗效,并对其中两种最有效的药物进行前瞻性处方,观察到预后改善。这种个性化治疗为临床治疗提供了科学依据,避免了临床经验指导用药的副作用。除了细胞毒化疗药物外,一些针对VEGF的靶向药物或免疫点抑制剂也被在治疗驱动基因阴性的NSCLC患者中有用[7]。因此,我们的MiniPDX模型可以在未来的临床前测试这些药物的有效性。
我们的结果表明,MiniPDX模型是指导驱动基因阴性的NSCLC患者化疗方案选择的有效工具,与常规化疗相比,pdx引导化疗能显著提高驱动基因阴性的NSCLC患者的生存率。然而,需更大样本研究的进一步证实。
