千岛湖水体氮的垂向分布特征及来源解析
2019-08-28金赞芳岑佳蓉胡宇铭郦林军李非里
金赞芳,岑佳蓉,胡宇铭,郦林军,李非里
千岛湖水体氮的垂向分布特征及来源解析
金赞芳,岑佳蓉,胡宇铭,郦林军,李非里*
(浙江工业大学环境学院,浙江 杭州 310032)
选取千岛湖水深0.2, 5, 10, 20, 30和40m处水样进行分析,利用氮氧同位素和稳定同位素模型(SIAR)研究千岛湖水体氮(N)的垂向分布特征,分析水体N的来源并计算各N源的贡献率.结果表明,硝酸盐(NO3-)和溶解性有机氮(DON)是千岛湖水体总溶解氮(TDN)的主要形式,分别占溶解态N的57.9%和39.7%.千岛湖水体δ15N-NO3-和δ18O-NO3-的平均值分别为4.5‰和4.3‰.上层水体(0~10m)中,硝化作用和浮游植物的同化作用共同控制水体N的形态组成和氮氧同位素值(δ15N-NO3-和 δ18O-NO3-)的变化.中层水体(10~30m)中,硝化作用是主要的生物地球化学过程,使得水体NO3-含量增加而δ18O-NO3-值减小.底层水体(30~40m)受到硝化作用、底泥N释放和反硝化作用的共同影响.化肥是千岛湖水体NO3-的最主要来源,在S1和S2处的贡献率分别为51.9%和30.6%.新安江上游的农业面源污染使得S1处化肥贡献率远高于S2.土壤N是仅次于化肥的第二大水体NO3-来源,在S1和S2处的贡献率分别为17.8%和27.8%.此外,底泥对底层水体NO3-的贡献不可忽视.
硝酸盐;垂向分布;氮同位素;氧同位素;稳定同位素模型
水体富营养化,特别是作为饮用水源的湖泊和水库的富营养化已成为我国乃至世界的突出环境问题之一[1-2].对于深水湖泊和水库,其水温随外部环境的季节变化而呈现季节性分层,并影响水体的理化特征和生物活动,从而影响水体N的垂向分布[3-5].因此,为控制深水湖泊和水库的N污染,水体N的垂向分布特征探究是必不可少的.
近年来,由于同位素测试技术的发展和成本的降低,氮氧同位素(δ15N-NO3-和δ18O-NO3-)被广泛应用于确定水体N的污染源及其生物地球化学过程[6-8].降雨、土壤N、化肥、生活污水及有机肥和底泥释放等不同来源的硝酸盐(NO3-)具有不同的δ15N-NO3-和δ18O-NO3-值域,从而可以判断水体N的混合过程.在解析N的生物化学过程中,δ15N-NO3-和δ18O-NO3-也得到了较好的应用[9-11].随着氮氧同位素解析NO3-来源研究的深入,应用稳定同位素模型(SIAR)可实现NO3-来源的定量分析[12-15].
千岛湖(新安江水库)是浙江省库容量最大的深水水库, 库容17.8×109m3[16].预计2020年建成的千岛湖配水工程将为杭州大部分地区及工程沿线区域提供饮用水[17].然而,千岛湖水体N污染长期存在,其总氮(TN)平均浓度为0.93~1.04mg N /L,超过了Ⅱ类和Ⅲ类水体的要求,是千岛湖水体的首要污染物[18].千岛湖是典型的深水水库,水体分层影响水库水质变化.然而,目前对千岛湖水体营养盐的研究大多关注千岛湖的表层水体,鲜有研究关注营养盐的垂向分布并对其进行源解析.本文以千岛湖各深度水体为研究对象, 通过对千岛湖水体水温、DO、叶绿素a、N的主要赋存形式和NO3-氮氧同位素的分析,确定水体N的垂向分布特征及其影响因素,明析水体NO3-的来源并探讨N的转化,同时应用SIAR模型计算各硝酸盐源的贡献率,以期为控制千岛湖水体N污染和保障杭州市人民用水安全提供科学依据.
1 材料与方法
1.1 研究区域概况
千岛湖(29°11′N~30°02′N, 118°34′E~119°15′E)位于浙江省淳安县,属于亚热带季风气候,年平均降雨量为1636.5mm,降雨主要集中在4~10月.新安江是千岛湖最大的入库河流,约占入库地表径流量的70%[19].根据《淳安县2015年土地利用变化情况分析报告》,林地是淳安县主要的土地利用方式,占全县总面积的69%,其次为水库水面(11%)、园地(10%)、耕地(4%)、居住及工矿用地(2%)及其他(4%).
1.2 样品采集与分析
在2017年10月和11月,分别在S1和S2处进行分层水样采集(图1).在水深0.2, 5, 10, 20, 30和40m处采集水样,现场测定水温(雷磁JPB-607A)和DO(雷磁JPB-607A),随后存储在500mL聚乙烯样品瓶中并及时运回实验室进行处理.水样经0.45 μm滤膜过滤后,滤膜用于测定叶绿素a[20],过滤后水样用于测定TDN(HJ 636-2012),离子色谱仪(戴安ICS-900)测定NO3-、NO2-、NH4+和Cl-.氮氧同位素用细菌反硝化法测定[21],利用特定的反硝化菌,使得NO3-转化为N2O,纯化后使用质谱仪(Delta V-Precon)测定δ15N-NO3-和δ18O-NO3-值,δ15N-NO3-和δ18O-NO3-值的测定误差分别为±0.3‰和±0.5‰.10月水样的δ18O-H2O采用TC-EA高温裂解制备出CO后通过同位素分析仪(Picarro L2140-i)测定同位素,误差范围为±0.1‰.同位素的相对比值用表示:
(‰) = [(sample-standard)/standard]×1000 (1)
式中:sample为样品的15N/14N或18O/16O的比值.standard为标准大气氮(AIR)的15N/14N和维也纳标准平均海水(VSMOW)的18O/16O.

图1 千岛湖采样点分布示意
1.3 SIAR模型
SIAR模型用于定量分析各NO3-来源对千岛湖水体NO3-的贡献率.SIAR模型在计算源的贡献率时,将同位素分馏考虑在其中,且可解析3个以上的源[22].其表达式如下:
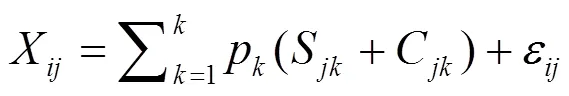
S~(μ,2)
C~(λ,2)
ε~(0,2)
式中:X表示第个样品的第种同位素值(= 1, 2, 3, ...,and= 1, 2, 3, ...,);S表示第种源的第种同位素值(= 1, 2, 3, ...,);μ和ω分别是正态分布的平均值和方差;p是第个源的贡献率,由模型计算得到;C是同位素在第源上的分馏系数;λ和τ是正态分布的平均值和标准差;ε为残差,表示各混合物之间未量化的变异,平均值为0,标准差为σ.在千岛湖水体中,降雨、生活污水及有机肥、化肥和土壤N是4个主要的水体NO3-外源,底泥是千岛湖水体NO3-来源的内源.
2 结果与分析
2.1 水温、DO和叶绿素a的分层特征
受热力学控制,千岛湖作为一个大型深水水库,上下层水体间发生一定程度的增温与冷却, 使水温在垂直方向上呈现明显的温度分层现象,其中温度急剧变化的区域称为温跃层.由图2可以看出,2017年10月、11月间,2个采样点水温存在明显的分层现象.千岛湖表层水(0~10m)水温在垂直方向基本稳定,水体在此区域垂向混合完全.表层水10月的水温在24~26℃之间变化,11月的水温在21~23℃之间变化,水温随气温变化而变化.中层(10~30m)水体,水温随水体深度的增加快速下降,10月份平均水温以1.19℃/m的速率下降,11月份平均水温以0.95℃/m的速率下降,因此10~30m是千岛湖水体的温跃层.底层(30~40m)水体,10月和11月2个采样点的水温无显著的时空变化,且水温的垂直变化较小,到40m深处时,水温基本稳定在10.5℃.
千岛湖DO在水体垂直方向上变化显著,呈现明显的分层现象.表层(0~10m)水体,10月、11月水中DO基本饱和,变化范围为7.1~8.4mg/L.中层(10~ 30m)水体DO变化显著,在10~20m水深之间,DO随深度的增加迅速降低,S1和S2的平均下降速率分别为0.36和0.49mg/(L·m).在20~30m水深之间,S2点DO随着深度的增加而升高,S1点则呈现相反的变化趋势.底层(30~40m)水体,DO逐渐趋于稳定.
叶绿素a是表征浮游植物生物量的主要指标.在千岛湖表层(0~10m)水体中,10和11月水体的叶绿素a的含量分为3.29和1.38μg/L.10月水体叶绿素a含量显著高于11月.在10m水深以下,叶绿素a的含量随水深的增加而减小,在水深10~20m之间快速减小,随后趋于稳定,其含量稳定在0.22μg/L左右.

图2 千岛湖水体水温、溶解氧(DO)和叶绿素a的垂直分布特征
2.2 TDN的主要赋存形式
NO3-是水体中主要的TDN,占TDN的57.9%.由图3可知,S1和S2的NO3-浓度在空间上无明显差异,而在时间上变化明显.11月水体NO3-平均浓度为0.63mg N/L,高于10月水体NO3-的平均浓度(0.46mg N/L).在垂向变化上,10月的变化较11月明显.在0~10m之间,10和11月水体NO3-基本均随水深的增加而减小,而在10~20m之间均随水深增加而增加.在20m以下,11月水体NO3-基本保持稳定,而10月水体NO3-先减小后增加.
DON也是水体TDN的主要形式,占TDN的39.7%.在垂向分布上,总体上DON的最大值出现在水深0.2m处,在水深40m处DON含量较小.DON的垂向变化总体上呈现出随水深增加而减小的趋势.NH4+在千岛湖水体中含量较小,平均值为23.3μg N/L,变化范围为9.3~44.2μg N/L,占TDN的2.5%. NO2-在千岛湖水体中基本未检出.
2.3 硝酸盐氮氧同位素
如图4, 10月S1的15N-NO3-值在4.1‰~5.1‰之间,平均值为4.4‰,S2的15N-NO3-值在3.9‰~ 5.7‰之间,平均值为4.3‰.11月S1的15N-NO3-平均值为5.0‰,变化范围为4.5‰~5.2‰. S2的平均15N-NO3-值为4.2‰,范围为3.9‰~5.8‰.11月S1的平均15N-NO3-值要显著高于S2和10月S1 处的平均15N-NO3-值.在表层(0~10m)水体,S1和S2总体变化较小,S1的15N-NO3-值高于S2.在中层(10~30m)水体,11月S1处15N-NO3-值在20~30m之间随着深度的增加显著降低.在底层(30~40m)水体,15N-NO3-值空间分布显著变化,S1和S2的15N-NO3-值随水深增加而显著增加,且10月和11月S1的15N-NO3-值在40m基本重合,平均值为5.1‰,S2的15N-NO3-值在40m也基本重合,平均值为5.8‰.

图4 测定的δ15N-NO3-和δ18O-NO3-值以及理论δ18O-NO3-值的垂向分布特征
10月,S1的18O-NO3-值的变化范围为2.1‰~ 5.7‰,平均值为3.6‰,S2的18O-NO3-值在2.8‰~ 5.5‰之间变化,平均值为4.5‰.11月S1的18O- NO3-值在3.2‰~5.3‰之间变化,平均值为4.5‰,S2的18O-NO3-值在3.5‰~5.9‰之间变化,平均值为4.8‰.总体来看,表层(0~10m)水体的18O-NO3-值要高于其他水深的18O-NO3-值.在中层(10~30m)水体,18O-NO3-值随着深度的增加逐渐减小.在底层(30~40m)水体,18O-NO3-值较低.
3 讨论
3.1 水温分层对DO、叶绿素a和N在垂直剖面上的影响
在深水湖泊和水库中,水温分层对水体理化指标和生物活动具有一定影响[3-5,16,23].在S1和S2点,10月和11月水体温跃层在水深10~30m之间.稳定的热力分层阻碍了水层之间的物质交换,使得水体DO和叶绿素a在垂向分布上变化明显,从而影响N在垂直剖面上的变化.
表层(0~10m)水体中,DO在垂直方向上随深度的增加而略微降低,总体含量较高(7.1~8.4mg/L),高含量的DO主要来自于自然复氧以及浮游植物的光合作用[3,16].在表层水中,叶绿素a含量也较高,表明该水深区间浮游植物生物量较高.在水深10~20m, DO随深度的增加迅速降低,这可能是由于:水温突变引起的热力分层,阻碍了上下水团的交换;该层光照不足,浮游植物呼吸作用大于光合作用,消耗大量氧气;微生物分解生物残渣消耗氧气[3,16].一般在水深20~30m,浮游植物减少使得水体有机物减少,从而减少了微生物分解有机质的活动,水体耗氧量减少,使得水体DO值有所回升.S1点水深20m处并未出现该段水体DO的最低值,因为S1位于新安江汇入中心湖区的位置,而新安江给千岛湖带来了大量的营养盐和有机质,使得微生物在水深20m以下持续分解有机物,DO含量持续降低,直至降至最低值后再随深度的增加而升高,根据何剑波[16]的研究,S1点DO的最低值出现在26~29m处.
DO主要通过影响水体微生物的活性和微生物的种群结构而影响硝化和反硝化的速率[24].水体中高的DO含量有利于水体硝化作用的进行,当DO> 5mg/L时,DO对硝化作用无限制,而当DO<1mg/L,硝化作用将会受到很大程度的抑制[25].低的DO含量会促进反硝化作用的进行,反硝化作用的DO上限为2mg/L,但有研究发现DO含量在2~6mg/L之间时,仍有较小速率的反硝化作用存在,这可能是由于好氧反硝化细菌的存在[26].浮游植物通过同化作用吸收水体中的NO3-和NH4+,并向水体释放DON,从而影响水体中N的赋存形态[27].此外,浮游植物残渣通过微生物的矿化作用和硝化作用,转化为溶解性N,对水质产生影响.
河流和降雨冲刷土壤带来的土壤有机N和表层水体浮游植物产生的有机N(同化作用)是千岛湖水体有机N的主要来源,因此0.2m处的表层水体DON含量较高.剧烈的氨化作用和硝化作用使表层水体DON含量随水深增加迅速降低,导致5m处的表层水体DON含量较低.在水深5~20m,水温、DO和叶绿素a均随水深增加而降低.在水深20~40m,水温、DO和叶绿素均维持在较低水平.较低含量的DO和低水温使得微生物代谢活动减弱,氨化和硝化速率均降低,水体DON含量随水深增加轻微减少.与此同时,水体NO3-在垂向的变化趋势和DON相比,呈现一定的差异.在表层水体(0~10m)中,同化作用、氨化作用和硝化作用使得NO3-随水深的增加而略微降低.在水深10~20m,低水平的叶绿素a表明水体同化作用降低,氨化作用和硝化作用使得NO3-增加. 20~40m水深的水体氨化和硝化速率均降低,水体NO3-含量随水深增加轻微减少.研究区域水体DO含量大于2mg/L,反硝化作用不明显.当水深逐渐增加(>40m)直至接近水底,DO含量不断减小,水体反硝化作用占据主导地位,将NO3-还原成N2.千岛湖表层和上部中层水体(0~20m)中较高含量的叶绿素a和DO有利于同化作用和硝化作用的进行,硝化作用和浮游植物的同化作用优先吸收NH4+,以至于0~20m水体中NH4+浓度极低. 20m以下水层中, 硝化作用占主导地位,水体中NH4+保持在极低水平.可见,千岛湖水体溶解性无机N以NO3-为主.
3.2 δ15N-NO3-和δ18O-NO3-解析NO3-的主要来源
如图5所示,其降水、化肥、土壤N和生活污水及有机肥的δ15N-NO3-和δ18O-NO3-值域来自参考文献[10,28-29],底泥的δ15N-NO3-和δ18O-NO3-值域来自参考文献[30].由图5可知,S1和S2不同深度水样的δ15N-NO3-和δ18O-NO3-值主要落在化肥、土壤N和生活污水及有机肥区间内.千岛湖水体δ15N- NO3-和δ18O-NO3-值的变化范围在杭嘉湖地区的4个水库(青山水库、对河口水库、四岭水库和里畈水库)之间,表明本研究区域和这些水库有相同的NO3-源[15].Cl-是一种惰性离子,水体中的Cl-主要来源于人为污染源(生活废水、粪肥等).一般认为,水体中高的NO3-/Cl-值与低的Cl-表明水体中的NO3-主要来源于化肥,而低的NO3-/Cl-值与高的Cl-表明生活污水及有机肥等人为污染源是主要的NO3-来源[15,31].

图5 S1和S2点的δ15N-NO3-和δ18O-NO3-值关系图
在本研究中,水体中的Cl-均较低,表明生活污水及有机肥并不是千岛湖水体NO3-的主要来源(图6).千岛湖水体的NO3-/Cl-值和Cl-又与对河口水库、四岭水库和里畈水库相似[15],结合δ15N-NO3-和δ18O-NO3-值分析得出化肥、土壤N和降水对千岛湖水体NO3-的影响更为突出.

图6 S1和S2点的NO3-/Cl-与Cl-关系
土地利用方式对水体NO3-来源影响显著[15,29].在千岛湖流域,林地是最主要的土地利用方式,其次为园地、耕地和农村居住区.千岛湖林业和农业生产中化肥的使用量为310.29kg N/(hm2×a),有机肥的使用量为115.86kg N/(hm2×a)[32].千岛湖流域处于丘陵地带,在高海拔地区主要以林业为主,而在缓坡地主要以果园等经济林为主,水土流失严重,地表径流携带大量土壤氮和施用在经济林中的化肥流入千岛湖.为满足千岛湖流域大量生态移民的生活需求,开垦出了大量耕地且主要集中在沿湖岸和河岸地区,耕地中大量施用化学肥料,并伴有小部分有机肥,使得大量N素随降水形成的地表径流进入千岛湖,是千岛湖水体N的重要来源.为保护千岛湖水质安全,流域内基本无工业区以及生活污水直排,但由于千岛湖地区旅游业迅速发展,大量游客进入湖区,使得生活污水对水体有一定影响[18].因此,化肥、生活污水及有机肥、土壤N和降水是千岛湖水体N的主要外源.这些外源N在水体中经过一系列反应,部分在湖泊底泥中累积,使得底泥具有较高的N含量.由于本文研究对象为各深度水体,较深处水体可能受到底泥N释放的影响,因此底泥N释放是水体N的一个重要内源[33-34].在水深40m处,S2处水体δ15N- NO3-值明显增高,这可能是受到底泥N释放的影响(图4).
3.3 δ15N-NO3-和δ18O-NO3-解析NO3-的转化
各形态N的转化和各N源的混合作用是影响水体N含量和NO3-同位素组成的主要因素,其中硝化作用是水体N转化的一个重要途径.千岛湖水体δ18O-NO3-值较低.根据Xue等[10]总结的硝化作用产生的NO3-的δ18O-NO3-值范围为-10‰~10‰,本研究中所有样品水样δ18O-NO3-小于10‰,说明千岛湖水体存在强烈的硝化作用.在NO3-形成期间, NO3-中的1个氧原子来自DO(δ18O-O2=23.5‰),2个氧原子来自水,有等式:δ18O-NO3-=2/3(δ18O-H2O)+ 1/3(δ18O-O2)[10].在千岛湖水体中,δ18O-H2O在-8.0‰~-7.2‰之间变化,平均值为-7.5‰,根据上述等式可得理论δ18O-NO3-值为2.5‰~3.0‰,平均值为2.9‰(图4).千岛湖水体实际的δ18O-NO3-值要高于理论的δ18O-NO3-值,这是由于受到了来自于降水的高δ18O-NO3-值的NO3-的影响.在表层水中,浮游植物生物量较高,其同化作用能够引起较大的同位素分馏,使得剩余NO3-中的δ15N和δ18O增加,这也是表层水体δ18O-NO3-值较高的原因[9].
在水深10~20m,实际δ18O-NO3-值随深度增加而降低,S1的实际δ18O-NO3-值甚至要低于理论δ18O-NO3-值,而NO3-的含量随水深增加而增加,DO则快速减少(图2,图3),表明该水深区间发生了较强的硝化作用.水体DO含量的减少使得18O-O2在硝化作用中的利用率减小,更多18O-H2O参与硝化作用,实际δ18O-NO3-值偏低[35].在水深20~30m,10月S1处实际δ18O-NO3-值小于理论δ18O-NO3-值,且11月δ18O-NO3-值在此水深区间持续降低,表明硝化作用在此区间仍较强.随着水体分层的增强,由于水体下层DO的缺乏,硝化作用发生的最适场所向上迁移,温跃层更适合水体硝化作用的发生[36].在千岛湖水体中,10月和11月的硝化作用主要发生在温跃层.在10月,S1和S2的δ18O-NO3-值在10~20m之间随水深的增加快速下降,平均δ18O-NO3-值从10m的5.2‰下降到20m的2.5‰.而在11月,S1和S2的δ18O-NO3-值在20~30m之间变化较大,平均δ18O- NO3-值从20m的5.1‰下降到30m处的3.4‰.10月与11月δ18O-NO3-值的变化差异可能是由于10月水体分层相比11月更加明显,硝化作用发生的最适环境向上迁移.δ15N-NO3-的值在10~30m之间没有出现明显下降,这与其他几个研究类似[36].反硝化作用是自然水体中去除N的主要过程,在反硝化过程中,NO3-在反硝化细菌的作用下最终还原为N2O和N2而从水中逸出,NO3-被消耗,使得剩余NO3-中的δ15N-NO3-和δ18O-NO3-增加,δ15N-NO3-/δ18O-NO3-大约为2:1[11].在S1和S2点,40m处δ15N-NO3-值(5.1‰~5.8‰)比0~30m水体的δ15N-NO3-值(3.8‰~ 5.2‰)都高,这可能是由于反硝化作用的存在.然而,在水深30~40m,S1点的δ18O-NO3-值随深度的增加而增加,而S2点的δ18O-NO3-值随着深度的增加轻微减小,且水体NO3-含量随深度的增加缓慢增加,这与反硝化作用使得NO3-含量下降而δ18O-NO3-值增加的理论不符,表明在底层水体中还存在其他反应影响水体NO3-的含量以及其氮氧同位素值.由于底层水体与底部沉积物较接近,沉积物中含有大量含N物质,且其δ15N值较高,释放到上覆水中,发生硝化作用.这一过程一方面使得底层水δ15N-NO3-值升高,而另一方面,由于底部缺少DO,使得更多18O-H2O参与硝化反应,底部水体δ18O-NO3-值降低[35].
在底层水体中,δ15N-NO3-和δ18O-NO3-受到底泥N释放、硝化作用和反硝化作用的共同影响.S1处较低的DO含量限制了硝化作用的进行,使得δ18O-NO3-主要受到反硝化作用的影响而升高,而S2处DO对硝化反应的抑制较小,使得δ18O-NO3-主要受到硝化作用的影响而降低.
3.4 NO3-来源的贡献率
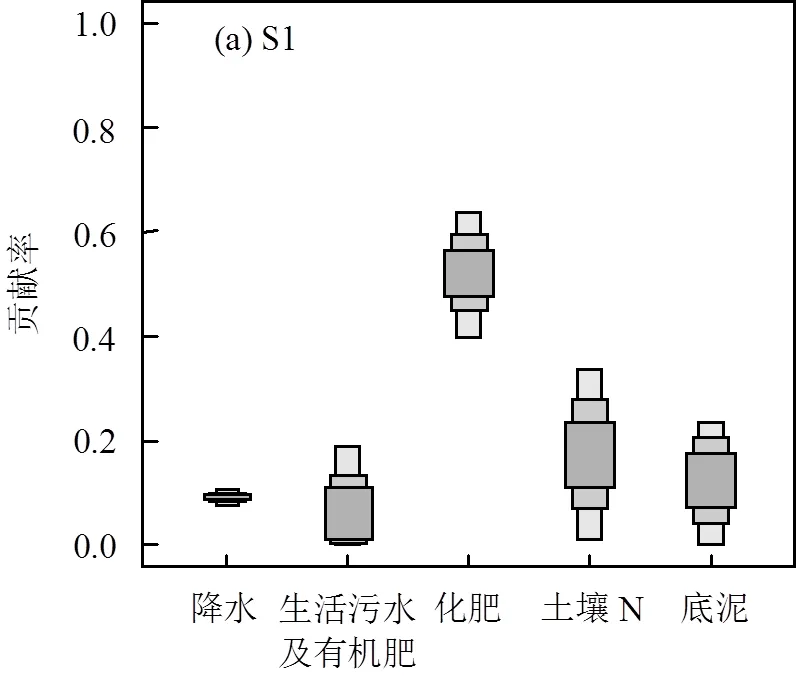
通过SIAR模型计算千岛湖水体4个外源(降水、生活污水及有机肥、化肥和土壤N)和底泥对水体NO3-的贡献率(由于分层数据少,不做分层NO3-的贡献率计算).由于水体中NH4+含量较小,硝化作用反应完全,硝化作用产生的分馏可忽略,且反硝化作用不显著,因此C=0.计算结果如图7所示,S1处各N源的贡献率依次为:化肥(51.9%)>土壤N(17.8%)>底泥(12.3%)>降水(9.1%)>生活污水及有机肥(8.9%).在S2处,各N源的贡献依次为:化肥(30.6%)>土壤N(27.8%)>底泥(15.1%)>降水(14.0%)>生活污水及有机肥(12.5%).
在千岛湖水体中,化肥是水体NO3-最主要的来源,S1处化肥对水体的贡献显著高于S2处,这是由于S1处于新安江汇入千岛湖的位置,新安江作为千岛湖最主要的入湖径流,沿岸及其支流周围分布大量农田,农田中施用的化肥随农田径流进入新安江,使得新安江水体N水平较高,是千岛湖水体N的重要来源.因此千岛湖流域需要采取有效措施减少农业面源污染,可以通过使用缓释N肥、深施N肥提高N肥的利用效率,或通过建造生态拦截沟渠阻断N进入水体并在一定程度上对N进行回收.土壤N是千岛湖水体NO3-的另一重要来源,且S2处土壤N的贡献率明显高于S1处,这是由于S2位于湖区中心,湖区周围的山体周边开垦出的缓坡地和耕地土壤侵蚀严重.因此应合理规划土地利用方式,从而减少水土流失.在S1和S2处,底泥对水体NO3-的贡献率分别为12.3%和15.1%,表明底泥N释放对千岛湖水体N的影响不可忽视.然而,由于千岛湖水深较深,底泥N释放对底层水体影响较大,而对上层和中层水体影响较小,其对水体N相对较高的贡献率主要作用在底层水体,特别是水体底部(水深40m以下水体).因此,就千岛湖主要水体(上层、中层)而言,底泥对水体N的贡献较小.S2处降雨的贡献要高于S1处降雨的贡献,表明S1处受到更多外源性N输入,这与S1受到新安江上游大量N输入有关.生活污水及有机肥对千岛湖水体NO3-的贡献最小,且对S2的贡献高于S1,这可能是由于S2处于湖区中心,游客大量出入千岛湖,增加了千岛湖水体N负荷.
4 结论
4.1 水体的热力分层影响千岛湖水体DO、叶绿素a和N的垂向分布特征.在表层水体(0~10m),浮游植物的同化作用和硝化作用使得水体溶解态N主要以DON和NO3-的形式存在,分别占溶解态N的57.9%和39.7%.千岛湖水体δ18O-NO3-值为2.1‰~ 5.9‰且DO含量大于2mg/L,表明硝化作用是水体N最主要转化过程,在0~40m水深区间均存在,且在10~30m水深区间处于主导地位.而在底层水体(30~ 40m)中,反硝化作用受到硝化作用和底泥N释放的影响.
4.2 千岛湖N污染严重,水体δ15N-NO3-值为3.9‰~5.8‰.化肥是千岛湖水体N最主要的来源,其对S1和S2处的贡献率分别为51.9%和30.6%,且新安江带来的农业面源污染对千岛湖水体N具有重要影响.土壤N对千岛湖水体N的贡献仅次于化肥,分别为17.8%(S1)和27.8%(S2).此外,底泥N释放对千岛湖底层水体也具有一定影响.
[1] Yao X L, Zhang Y L, Zhang L, et al. A bibliometric review of nitrogen research in eutrophic lakes and reservoirs [J]. Journal of Environmental Sciences, 2017,66(4):274-285.
[2] 石效卷.中国饮用水水源环境安全[J]. 中国环境管理干部学院学报, 2012,22(1):1-6. Shi X J. The safety of drinking water sources in China [J]. Journal of EMCC, 2012,22(1):1-6.
[3] 吴志旭,刘明亮,兰 佳,等.新安江水库(千岛湖)湖泊区夏季热分层期间垂向理化及浮游植物特征[J]. 湖泊科学, 2012,24(3):460-465. Wu Z X, Liu M L, Lan J, et al. Vertical distribution of phytoplankton and physico-chemical characteristics in the lacustrine zone of Xin'anjiang Reservoir ( Lake Qiandao) in subtropic China during summer stratification [J]. Journal of Lake Sciences, 2012,24(3):460- 465.
[4] 邱晓鹏,黄廷林,曾明正.溶解氧对湖库热分层和富营养化的响应—以枣庄周村水库为例[J]. 中国环境科学, 2016,36(5):1547-1553. Qiu X P, Huang T L, Zeng M Z. Responses of dissolved oxygen on thermal stratification and eutrophication in lakes and reservoirs—An example in Zhoucun Reservoir in Zaozhuang City [J]. China Environmental Science, 2016,36(5):1547-1553.
[5] 夏品华,林 陶,李存雄,等.贵州高原红枫湖水库季节性分层的水环境质量响应[J]. 中国环境科学, 2011,31(9):1477-1485. Xia P H, Lin T, Li C X, et al. Features of the water column stratification and the response of water quality of Hongfeng reservoir in Guizhou, China [J]. China Environmental Science, 2011,31(9): 1477-1485.
[6] Xu S, Kang P, Sun Y. A stable isotope approach and its application for identifying nitrate source and transformation process in water [J]. Environmental Science and Pollution Research International, 2015, 23(2):1133-1148.
[7] Li D, Jiang X, Zheng B. Using δ15N and δ18O Signatures to evaluate nitrate sources and transformations in four inflowing Rivers, North of Taihu Lake [J]. Water, 2017,9(5):345-360.
[8] Yue F J, Li S L, Liu C Q, et al. Tracing nitrate sources with dual isotopes and long term monitoring of nitrogen species in the Yellow River, China [J]. Scientific Reports, 2017,7(1):506-515.
[9] Swart P K, Evans S, Capo T, et al. The fractionation of nitrogen and oxygen isotopes in macroalgae during the assimilation of nitrate [J]. Biogeosciences, 2014,11(21):6147-6157.
[10] Xue D, Botte J, Baets B D, et al. Present limitations and future prospects of stable isotope methods for nitrate source identification in surface- and groundwater [J]. Water Research, 2009,43(5):1159-1170.
[11] Wenk C B, Zopfi J, Blees J, et al. Community N and O isotope fractionation by sulfide-dependent denitrification and anammox in a stratified lacustrine water column [J]. Geochimica et Cosmochimica Acta, 2014,125:551-563.
[12] Yang L, Han J, Xue J, et al. Nitrate source apportionment in a subtropical watershed using Bayesian model [J]. Science of the Total Environment, 2013,463-464(5):340-347.
[13] Meghdadi A, Javar N. Quantification of spatial and seasonal variations in the proportional contribution of nitrate sources using a multi- isotope approach and Bayesian isotope mixing model [J]. Environmental Pollution, 2018,235:207-222.
[14] Zhang Y, Shi P, Li F, et al. Quantification of nitrate sources and fates in rivers in an irrigated agricultural area using environmental isotopes and a Bayesian isotope mixing model [J]. Chemosphere, 2018,208: 493-501.
[15] 金赞芳,张文辽,郑 奇,等.氮氧同位素联合稳定同位素模型解析水源地氮源[J]. 环境科学, 2018,39(5):2039-2047. Jin Z F, Zhang W L, Zheng Q, et al. Contribution of nitrogen sources in water sources by combining nitrogen and oxygen isotopes and SIAR [J]. Environmental Science, 2018,39(5):2039-2047.
[16] 何剑波.千岛湖水温、溶解氧及叶绿素a垂向特征研究[D]. 杭州:浙江工业大学, 2014. He J B. Vertical characteristics of water temperature, dissolved oxygen and Chlorophyll a in Qiandaohu Lake [D]. Hangzhou: Zhejiang University of Technology, 2014.
[17] 周 骅,徐锋杰,曹 彧.浅谈大型线性水利工程政策处理的工作机制—以杭州市第二水源千岛湖配水工程为例[J]. 浙江水利科技, 2017,213:40-48. Zhou Y, Xue F J, Cao Y. The Working Mechanism of large-scale linear hydraulic engineering policy—the water supply project of Qiandao Lake in the second water source of Hangzhou as an example [J]. Zhejiang Hydrotechnics, 2017,213:40-48.
[18] 张红举,彭树恒,周 娅,等.千岛湖现状污染负荷分析与限制排污总量研究[J]. 水资源保护, 2014,30(4):53-56. Zhang H J, Peng S H, Zhou Y, et al. Analysis of current pollutant loads and investigation of total pollutant discharge limits in Qiandao Lake [J]. Water Resources Protection, 2014,30(4):53-56.
[19] Zhou Y, Zhang Y, Jeppesen E, et al. Inflow rate-driven changes in the composition and dynamics of chromophoric dissolved organic matter in a large drinking water lake [J]. Water Research, 2016,100:211-221.
[20] 国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002:670-671. National Environmental Protection Administration, Editorial Board for Water and Wastewater Monitoring and Analysis Methods. Water and wastewater monitoring and analysis methods [M]. Fourth edition. Beijing: China Environmental Science Press, 2002:670-671.
[21] Casciotti K L, Sigman D M, Hastings M G, et al. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method [J]. Analytical Chemistry, 2002,74(19): 4905-4912.
[22] Parnell A C, Inger R, Bearhop S, et al. Source Partitioning Using Stable Isotopes: Coping with Too Much Variation [J]. PLOS ONE, 2010,5(3):e9672.
[23] 黄廷林,曾明正,邱晓鹏,等.温带季节性分层水库浮游植物功能类群的时空演替[J]. 中国环境科学, 2016,36(4):1157-1166. Huang T L, Zeng M Z, Qiu X P, et al. Phytoplankton functional groups and their spatial and temporal distribution characteristics in a temperate seasonally stratified reservoir [J]. China Environmental Science, 2016,36(4):1157-1166.
[24] 黄 健.间歇曝气条件下河流内源氮转化及微生物机制[D]. 合肥:安徽大学, 2018. Huang J. Research on transformation of endogenous nitrogen and mechanism of microorganism by intermittent aeration in polluted river [D]. Hefei: Anhui University, 2018.
[25] 陈藜藜.珠三角典型富营养化状态湖库的氮形态研究[D]. 广州:暨南大学, 2015. Chen L L. Research on nitrogen forms in typical entrophication lakes and reservoirs in the Pearl River Delta region [D]. Guangzhou: Jinan University, 2015.
[26] 司圆圆,陈兴汉,许瑞雯,等.好氧反硝化细菌脱氮研究进[J]. 山东化工, 2018,47(4):157-158. Si Y Y, Chen X H, Xu R W, et al. Progress on the studies of aerobic denitrifier [J]. Shandong Chemical Industry, 2018,47(4):157-158.
[27] Bronk D A, Glibert P M, Ward B B. Nitrogen Uptake, Dissolved Organic Nitrogen Release, and New Production [J]. Science, 1994, 265(5180):1843-1846.
[28] Michener R, Lajtha K. Stable isotopes in ecology and environmental science [M]. Oxford, UK: Blackwell, 2008,375-449.
[29] Jin Z, Zheng Q, Zhu C, et al. Contribution of nitrate sources in surface water in multiple land use areas by combining isotopes and a Bayesian isotope mixing model [J]. Applied Geochemistry, 2018,93:10-19.
[30] Wang Z J, Yue F J, Li S L, et al. Nitrate dynamics during impoundment and flood periods in a subtropical karst reservoir: Hongfeng Lake, Southwestern China [J]. Environmental Science Processes & impacts, 2018,20:1736-1745.
[31] Yue F J, Li S L, Liu C Q, et al. Tracing nitrate sources with dual isotopes and long term monitoring of nitrogen species in the Yellow River, China [J]. Scientific Reports, 2017,7(1):506-515.
[32] 孔樟良.建德市不同农作系统肥料结构的调查与分析[J]. 农学学报, 2015,5(7):81-86. Kong Z L. Investigation and analysis of fertilizer structure of different farming systems in Jiande City [J]. Journal of Agriculture, 2015,5(7): 81-86.
[33] 张 扬.不同盐度、底泥及扰动条件下再生水补水景观水体水质变化[D]. 西安:西安建筑科技大学, 2017. Zhang Y. Effect of different salinity, sediment and change rule on water quality variations of the pond replenished by reclaimed water [D]. Xian: Xi’an University of Architecture and Technology, 2017.
[34] 文帅龙,吴 涛,杨 洁,等.冬季大黑汀水库沉积物-水界面氮磷赋存特征及交换通量[J]. 中国环境科学, 2019,39(3):1217-1225. Wen S L, Wu T, Yang J, et al. Distribution characteristics and exchange flux of nitrogen and phosphorus at the sediment-water interface of Daheiting Reservoir in winter [J]. China Environmental Science, 2019,39(3):1217-1225.
[35] Buchwald C, Casciotti K L. Oxygen isotopic fractionation and exchange during bacterial nitrite oxidation [J]. Limnology and Oceanography, 2010,55(3):1064-1074.
[36] Bardhan P, Naqvi S W A, Karapurkar S G, et al. Isotopic composition of nitrate and particulate organic matter in a pristine dam reservoir of western India: implications for biogeochemical processes [J]. Biogeosciences, 2017,14(4):1-25.
The vertical distribution of nitrogen and the nitrogen sources in Qiandao Lake.
JIN Zan-fang, CEN Jia-rong, HU Yu-ming, LI Lin-jun, LI Fei-li*
(College of Environment, Zhejiang University of Technology, Hangzhou 310032, China)., 2019,39(8):3441~3449
Water samples were collected at the depths of 0.2, 5, 10, 20, 30 and 40m in Qiandao Lake. Concentrations of nitrogenous species and dual isotopes of nitrate (δ15N-NO3-and δ18O-NO3-) were analyzed to identify the vertical distribution of nitrogen and the main nitrate sources. The results showed that nitrate (NO3-) and dissolved organic nitrogen (DON) were the major nitrogenous species, accounting for 57.9% and 39.7% of total dissolved nitrogen, respectively. The values of δ15N-NO3-ranged from 3.8‰ to 5.8‰ with a mean of 4.5‰, and the values of δ18O-NO3-varied from 2.1‰ to 5.9‰, with a mean of 4.3‰ in Qiandao Lake. In the upper water (0~10m),nitrification and assimilation of phytoplankton were the main biogeochemical processes. In the middle water (10~30m), nitrification was the dominant biogeochemical process with the increasing concentrations of nitrate and the decrease of δ18O-NO3-values. The bottom water (30~40m) was affected by nitrification, nitrogen release from sediment and denitrification. The contributions of external sources (precipitation, sewage/manure, nitrogen fertilizer and soil nitrogen) and endogenous nitrogen source (sediment) were calculated by SIAR. It was showed that nitrogen fertilizer was the most important nitrate source in Qiandao Lake, accounting for 51.9% in S1 and 30.6% in S2. The agricultural non-point source pollution from Xinan River resulted in the higher contribution of nitrogen fertilizer in S1than that in S2. The effect of soil nitrogen was also significant for the NO3-in Qiandao Lake, contributing 17.8% in S1and 27.8% in S2. There was more serious soil erosion in S2in central lake which is surrounded by mountains with more cultivated land on hillside. In addition, the results suggested that the endogenous nitrogen source (sediment) can’t be neglected in the bottom water of Qiandao Lake.
nitrate;vertical distributions;nitrogen isotopes;oxygen isotopes;SIAR
X524
A
1000-6923(2019)08-3441-09
金赞芳(1976-),女,浙江湖州人,教授,博士,主要研究方向为流域氮循环.发表论文50余篇.
2019-01-28
国家自然科学基金资助项目(41673097,41373122,41273129)
* 责任作者, 教授, lifeili@zjut.edu.cn
