掺氮碳量子点对光合细菌生长过程的影响
2019-08-28周岳陵岳正波胡馥鹏
周岳陵,岳正波,胡馥鹏,王 进
掺氮碳量子点对光合细菌生长过程的影响
周岳陵,岳正波,胡馥鹏,王 进*
(合肥工业大学资源与环境工程学院,安徽 合肥 230009)
以柠檬酸为碳源、乙二胺为修饰剂,一步水热合成了掺氮碳量子点(N-CQDs).通过分析光合色素、蛋白质和丙二醛等生理指标,研究了N-CQDs对光合细菌生长的影响.结果表明N-CQDs抑制了的生长并呈现浓度-效应关系;光合色素分析表明N-CQDs促使菌体的类胡萝卜素含量提高,菌绿素含量降低;光谱分析表明N-CQDs导致了胞内物质(如光合色素、蛋白质等)的泄漏.N-CQDs较强的光诱导电子转移能力导致培养体系中产生过量自由基,自由基引发一系列脂质过氧化反应,进而导致生物膜的破裂、物质外泄和细菌衰亡.光照下N-CQDs对表现出较高的毒性.研究结果对于认识N-CQDs的光致毒性及其生态环境效应具有一定的参考价值.
掺氮碳量子点;光合细菌;光合色素;细胞毒性
近年来,随着碳纳米材料的大量开发与使用,其不可避免地被释放到环境中,增加了生物与其接触的机会.碳纳米材料的毒性效应和环境风险受到研究者的广泛关注[1-3].研究证实多壁碳纳米管[4]、单壁碳纳米管[5]和富勒烯[6]等碳纳米材料对微生物和高等生物具有一定的生态毒性风险.
碳量子点(CQDs)泛指一类粒径小于10nm,在光激发下能发荧光的新型碳纳米材料.由于其光吸收和光诱导电子转移能力以及粒径小、水分散性良好等特性,CQDs已被证实在众多领域具有非常好的应用前景.但是,CQDs具有丰富的表面官能团和活跃的物化特性,其进入环境后可能会对环境微生物造成负面影响,对生态系统和人类健康造成危害.因此,有必要对CQDs潜在的生物毒性和生态效应进行评估.
关于CQDs的生物毒性研究涉及的实验对象有细胞[7-8]、细菌[9-11]、藻类[12]、斑马鱼[13]、老鼠[14]等,研究的生物种类较为有限,得到的实验结果也不尽相同.CQDs的细胞毒性通常存在浓度依赖性,浓度越高,细胞毒性越明显,但同种CQDs对不同类型的细胞可能表现出不同的毒性[7].Biswas等[8]也发现CQDs对不同的细菌具有不同的毒性表现.除细胞和细菌外,研究发现,CQDs对环境中的生产者藻类也具有显著的生物毒性,当CQDs浓度达到一定数值时,通常会抑制藻类的生长及其光合作用[12].尽管有研究表明CQDs对鱼类和鼠类等动物未表现出明显的致毒效应[13-14],但对于环境中日渐增多的CQDs,其潜在的生态毒性和环境影响应当引起我们足够的重视.
近些年来,虽然有关CQDs的生物毒性研究已广泛开展,但对于CQDs光感特性与生物毒性之间的认识有限.考虑到CQDs的光电活性,其在光照环境下对环境微生物的影响可能更大.本文以光敏感性的常见环境微生物光合细菌()作为研究对象,探讨CQDs对生长过程的影响及其潜在环境效应,从而丰富CQDs对环境微生物影响的认识,为进一步理解CQDs的生态效应以及评估其生态风险提供参考.
1 材料与方法
1.1 菌株及培养基
光合细菌()由中国科学技术大学盛国平教授馈赠.培养基为HCH培养基[15].
1.2 N-CQDs的制备
在50mL聚四氟乙烯内衬的不锈钢反应釜中加入1.0g柠檬酸、10mL超纯水以及0.3mL乙二胺,混合均匀后于200℃反应5h.自然冷却后将反应液离心10min(8000r/min).上清液用3500Da的透析袋透析2d,得到N-CQDs储备液,浓度为14.4mg/L(以碳计).
1.3 R. acidophila培养方案
以50mL透明玻璃瓶为反应器,培养体积为40mL.每瓶接种4mL的母液(OD660= 1.5).按照实验设计加入N-CQDs,鼓氩气5min后用丁基橡胶塞与铝盖封瓶,放置于光照培养箱(光强4500lux,32℃)静置培养.N-CQDs添加量分别为0,1.8,3.6和7.2mg/L(以碳计).每组设定3个平行.每隔一定时间抽取菌液用于测定OD660、光合色素、蛋白质和丙二醛等生理指标.
1.4 测试方法
光合色素的提取:取5mL菌液,离心收集菌体(12000r/min,30min),5mL蒸馏水洗涤3次.菌体悬浮于5mL丙酮-甲醇(7:2,v/v)溶液中超声浸提10min (300W,60%),离心收集上清液(12000r/min,10min).重复上述浸提过程2次,合并提取液用于光谱分析.类胡萝卜素(Car)和菌绿素(Bchl)含量按Jessen和Beer-Lambert-Bouguer定律进行计算[16].
利用场发射透射电镜(JEM-2100F,日本)对N-CQDs形貌观测表征.利用紫外-可见分光光度计(UV1750,日本岛津)、荧光分光光度计(F4600,日本日立)对N-CQDs和培养液进行光谱表征.培养液中蛋白质与丙二醛含量分别采用南京建成生物工程研究所的总蛋白测试盒(A045-2-2)和丙二醛测试盒(A003-1-2)测试.数据处理及分析采用Microsoft Excel 2007和Origin 8.0软件.
蛋白质(Protein)的含量按公式(1)计算.

式中:P为样品的Protein浓度,g/L;ODT、ODC和ODS分别为样品、对照和标准品的OD值;S为标准品的浓度,g/L.
丙二醛(MDA)的含量按公式(2)计算.

式中:M为样品的MDA含量,nmol/mL;ODT、ODC、ODS和ODB分别为样品、对照、标准品和空白的OD值;S为标准品的浓度,nmol/mL;ƒ为样品的稀释倍数.
2 结果与讨论
2.1 N-CQDs表征
图1a表明N-CQDs在340nm处有特征吸收峰,当激发波长为340nm时,荧光发射峰为460nm.图1b表明N-CQDs的荧光发射与激发波长有关,表现出激发光依赖性.荧光发射峰半峰宽较小,说明粒径分布较为均匀.TEM结果进一步证实N-CQDs粒径小于10nm,尺寸分布均匀,颗粒分散性良好,无团聚(图1c).

2.2 N-CQDs对R. acidophila的生长抑制
如图2所示培养初期,N-CQD对其生长繁殖过程无显著影响.但培养至第7d,N- CQD处理组的OD660值均低于对照组,且N-CQDs的浓度越大,OD660值越小.当培养至衰亡期(第9d)时,N-CQDs处理组的OD660值下降更快.黄淮青等[9]发现葡萄糖基荧光碳点(CDs)与调整期(2h)的酵母菌共培养时,对数期(10h)时酵母数量随着CDs的浓度增大而减少,这与本研究的现象一致.欧阳少虎在研究氧化石墨烯(GO)和氧化石墨烯量子点(GOQD)对小球藻的毒性时发现,两者均表现为先促后抑.在培养的前48h,这2种碳材料均促进了藻类的生长分裂,而72h后两者表现出抑制作用[17].N-CQDs对的生长存在抑制,同时会加速细菌衰亡过程.这主要是由于纳米材料在被内化的过程中,会促进亲代与子代细胞壁的分裂,但经细菌内化后,可能会使菌体细胞逐渐出现结构受损、氧化应激增加、细胞代谢被干扰等不良反应,从而导致菌体的衰亡[17].
如图2和表1所示,光照培养7d后对照组的生物量最高,各反应组生物量随N-CQDs添加量的增大而降低,当N-CQDs浓度为7.2mg/L时,生物量下降9.2%.因此,N-CQDs对的生长过程存在抑制效果,主要体现为降低适应期的细菌基数,加速细菌衰亡,继而使生物量降低,且这一效应存在浓度依赖现象.
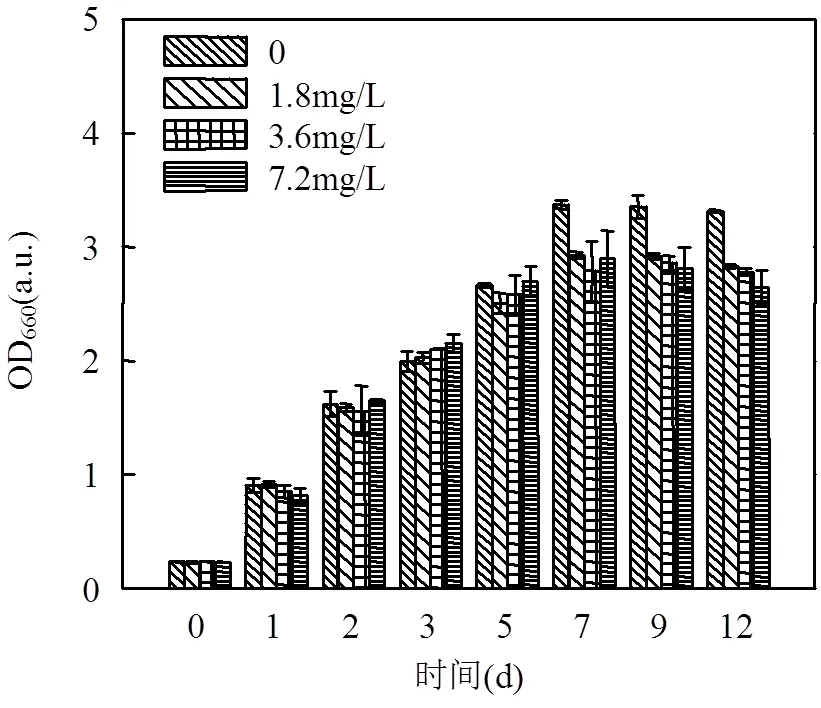
图2 N-CQDs对R. acidophila培养过程的影响
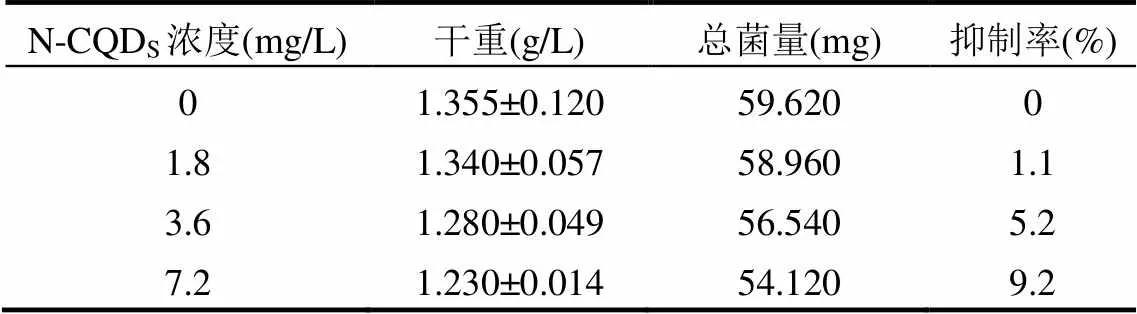
表1 培养7d时R. acidophila的干重
2.3 N-CQDs对光合色素的影响
图3a表明各实验组均有类胡萝卜素(Car)和菌绿素(Bchl)吸收峰,说明N-CQDs并未影响中光合色素的种类.图3b表明Car含量随N-CQDs浓度的增大而增加,而Bchl含量则随N-CQDs浓度的增大而降低.Car作为一类辅助色素,能够捕获和传递光能,还可以保护光化学反应中心,防止光损伤与自由基氧化.研究表明,盐藻和雨生红球藻在响应环境胁迫时,会合成和积累大量类胡萝卜素[18-20].本研究中Car含量增加是自身对N-CQDs胁迫的响应.Bchl作为光化学反应的主要色素,其含量与活性影响到细菌的生长代谢过程.环境胁迫将破坏光合作用系统,致使叶绿素含量不断下降[21].细胞内的高氧化应激压力也会影响生物体内叶绿素a的合成[22].环境逆境下,细胞体内产生的多种活性氧(H2O2,O2-,-OH*,1O2*等)会导致机体的氧化损伤[23],并且叶绿体是主要的靶器官[24].欧阳少虎[17]发现GOQD会引起小球藻叶绿素a含量降低,他认为可能是GOQDs抑制了叶绿素的合成.而本研究中,Bchl含量的降低,可能是N-CQDs破坏了光化学反应中心的结构,导致Bchl的流失和分解.光合色素分析结果表明N-CQDs对表现出胁迫作用,而细菌通过合成Car来削弱此作用.

2.4 培养液光谱分析
2.4.1 紫外-可见吸收光谱 对照组的初始培养液无特征吸收峰,而N-CQDs处理组则在340nm处出现特征峰.培养12d,各实验组于390nm处出现一个强吸收峰,且在500nm~600nm间有4个吸收峰,这些吸收峰与活细胞光谱的主要吸收峰相对应(图4a),可能是色素泄漏造成的.程茜茹等[25]发现沼泽红假单胞菌的Bchl在光照下容易降解为一种相对稳定的中间物质,该物质在390nm处具有强吸收峰.N-CQDs处理组上清液中390nm处的吸收强度随N-CQDs浓度的增大而增大,说明Bchl的降解加剧.而Bchl的降解通常涉及到羟基自由基以及脂质过氧化物[21].N-CQDs可能引起了过度的脂质过氧化反应,导致细胞膜的损伤,致使更多的胞内物质(如Bchl a)泄漏到培养基中.而Bchl降解产物的增多,可能是处理组Bchl含量偏低的原因之一.

2.4.2 三维荧光光谱 图5为对照组和添加7.2mg/ L的N-CQDs处理组不同时期培养液的三维荧光光谱分析结果.培养第3d,对照组培养液出现新的荧光峰(ex/em=400/465nm)(图5b),此峰为聚羧酸类腐殖酸物质,说明此时对照组代谢旺盛.而处理组中N-CQDs峰(ex/em=350/450nm)迅速消失,说明N-CQDs能够被细菌吸附或内化.这可能是由于N-CQDs粒径小于10nm,极易被内化进入菌体内.但此体系中并未出现ex/em=400/ 465nm荧光峰(图5f),说明N-CQDs处理组细菌的代谢可能受到限制.N-CQDs处理组第3d检测到色素的荧光峰(ex/em=390/615nm和ex/em=390/675nm) (图5f).这说明胞内色素发生外泄,光反应中心可能遭到破坏[26].培养至第7d,对照组未检测到的色素荧光峰,表明其生长状态良好,物质外流较少;而N-CQDs处理组中的色素荧光峰进一步增强,说明胞内物质在持续泄漏.
至第12d,细菌进入衰亡期,各实验组中均检测到色素荧光峰(图5d和h).表2显示随着N-CQDs的浓度增加,细胞色素的荧光峰强度相应增大,进一步证明N-CQDs处理组的细菌衰亡程度更严重.荧光光谱分析结果表明光照培养下N-CQDs对存在胁迫作用,并且整个生长过程一直存在细菌胞内物质的持续泄漏.因此,N-CQDs对的损伤是一个持续的过程.

表2 色素荧光特征峰的强度

图5 不同时刻培养液的三维荧光光谱图
2.5 N-CQDs对培养液中蛋白质和丙二醛的影响

图6 培养液中的蛋白质和丙二醛含量
丙二醛(MDA)是细胞膜脂质过氧化反应的产物,其含量变化能够反映细胞膜脂质的过氧化程度.脂质过氧化反应会持续引发细胞膜的损伤,进而产生不可逆的破坏,导致细胞死亡,胞内物质外泄[27].培养液中蛋白质和丙二醛的含量均随N-CQDs浓度的增大而增高(图6).蛋白质的大量外泄表明N- CQDs导致了菌体细胞膜的受损[28-29].Travlou等[30]研究氮掺杂CQDs的抗菌活性时发现,氨基和酰胺基在水溶液中的质子化会使N-CQDs与细菌脂质膜发生静电相互作用,从而破坏细胞膜.N-CQDs的氮元素掺杂可能加剧了CQDs的毒性.当添加7.2mg/L的N-CQDs时,实验组的MDA含量为对照组的2.3倍.张倩[31]在研究碳纳米材料的毒性作用时,检测到氧化石墨烯(GO)暴露下的微藻的丙二醛含量的显著升高,发现GO能够诱导氧化胁迫,造成微藻细胞的膜脂质过氧化.MDA含量的变化也能够间接反应机体细胞受自由基攻击的严重程度.由于氨基和酰胺基的强给电子能力,N-CQDs能够诱发大量活性氧(O2-、OH-、HO2-)的产生[30].这些活性氧会导致的氧化损伤,从而对脂质、蛋白质、核酸等造成损害,最终导致细胞死亡.
2.6 N-CQDs对R. acidophila的毒性分析
本研究发现N-CQDs对光合细菌的毒性存在浓度依赖性.培养7d时1.8,3.6,7.2mg/L的N-CQDs使得生物量分别下降了1.1%,5.2%和9.2%(表1).其中生物量抑制率(%)与N-CQDs浓度(mg/L)存在线性相关关系(2=0.97).董微等[32]研究也发现碳量子点对酵母菌的毒性表现出浓度依赖性.虽然碳量子点已被证实具有细胞毒性,但大部分研究表明碳量子点的毒性较小.当细胞抑制率(活力或数量)为10%时,碳量子点的浓度通常大于38mg/L(表3).而本研究中,当N-CQDs的浓度为7.2mg/L时,其对的抑制率已达到9.2%.因此,在光照下,N-CQDs可能表现出较高的毒性.

表3 碳量子点的细胞毒性
CQDs具有优良的光电性质,既能作为电子供体也能成为电子受体.在持续光照下,CQDs通常会产生光生电子-空穴对,形成的空穴和电子被分离且分别迁移到CQDs表面,能够将吸附在其表面的羟基和水分子氧化成羟基自由基(·OH),这些小分子具有很强的氧化能力,可以破坏或者降解有机物.研究表明CQDs能够促进羟基自由基和超氧自由基的生成[40-43].这些自由基容易攻击细胞膜上的多不饱和脂肪酸,造成脂质过氧化,导致细胞膜失去功能.同时能够直接和蛋白质、核酸等作用,导致细胞的病变或死亡.Biswas等[8]发现石墨烯量子点(GQDs)暴露下细菌出现物理损伤以及明显的氧化应激行为.本研究中当N-CQDs被添加到培养基中,在光照下,体系内会持续产生大量的自由基,从而引发一系列脂质过氧化反应,丙二醛含量随N-CQDs的浓度增大而增高.而膜结构中丰富的多不饱和脂肪酸分子,有利于脂质过氧化链式反应的发生,这些连锁反应对细胞膜造成大量的损伤,最终破坏膜的完整性,导致大量膜蛋白和胞内色素的泄漏.N-CQDs对环境微生物的胁迫作用和光致毒性等,值得进一步关注.
3 结论
以柠檬酸和乙二胺为原料水热合成制得粒径小于10nm发蓝色荧光的N-CQDs.N-CQDs对光合细菌的生长具有氧化胁迫作用,因此抑制了其生长过程并导致胞内蛋白及光合色素等泄漏.添加7.2mg/L的N-CQDs对的生物量抑制率达9.2%,反映细胞膜脂质过氧化反应的MDA浓度则是无添加对照组的2.3倍.
[1] 闾晓萍,黄 绚,杨 坤.碳纳米材料的生物毒性效应研究及展望 [J]. 环境污染与防治, 2011,33(5):87-94. Lv X P, Huang X, Yang K. Advance and perspectives of the bio- toxicity of carbon nanomaterial [J]. Environmental Pollution Control, 2011,33(5):87-94.
[2] 吕小慧,陈白杨,朱小山.氧化石墨烯的水环境行为及其生物毒性 [J]. 中国环境科学, 2016,36(11):3348-3359. Lv X H, Chen B Y, Zhu X H. Fate and toxicity of graphene oxide in aquatic environment [J]. China Environmental Science, 2016,36(11): 3348-3359.
[3] 李佳昕,张 娴,张爱清,等.碳纳米材料的水环境行为及对水生生物毒理学研究进展 [J]. 生态毒理学报, 2017,12(5):12-25.Li J X, Zhang X, Zhang A Q, et al. A review of aquatic environmental behavior of carbon nanomaterials and its toxicological effects on aquatic organisms [J]. Asian Journal of Ecotoxicology, 2017,12(5): 12-25.
[4] 王玉琳,闻 韵,王晓慧,等.多壁碳纳米管长期作用对活性污泥系统的影响 [J]. 环境科学研究, 2014,27(12):1486-1492. Wang Y L, Wen Y, Wang X H,et al.Long-term effects of multi- walled carbon nanotubes on activated sludge system [J]. Research of Environmental Science, 2014,27(12):1486-1492.
[5] 朱小山,朱 琳,田胜艳,等.三种碳纳米材料对水生生物的毒性效应 [J]. 中国环境科学, 2008,28(3):269-273. Zhu X S, Zhu L, Tian S Y, et al. Toxicity effect of three kinds of carbon nanomaterials on aquatic organisms [J]. China Environmental Science. 2008,28(3):269-273.
[6] 朱小山,朱 琳,郎宇鹏,等.富勒烯及其衍生物对斑马鱼胚胎发育毒性的比较 [J]. 中国环境科学, 2008,28(2):173-177. Zhu X S, Zhu L, Lang Y P,et al. Developmental toxicity in zebrafish embryos after exposure to three fullerene aggregates (nC60) and fullerol [J]. China Environmental Science, 2008,28(2):173-177.
[7] Arul V, Edison T N J I, Lee Y R,et al. Biological and catalytic applications of green synthesized fluorescent N-doped carbon dots using[J]. Journal of Photochemistry and Photobiology B: Biology, 2017,168:142-148.
[8] Biswas A, Khandelwal P, Das R,et al. Oxidant mediated one-step complete conversion of multi-walled carbon nanotubes to graphene quantum dots and their bioactivity against mammalian and bacterial cells[J]. Journal of Materials Chemistry B, 2017,5(4):785-796.
[9] 黄淮青,曾 萍,韩宝福,等.荧光碳点的合成及对酿酒酵母的毒性研究 [J]. 无机化学学报, 2012,28(1):13-19. Huang H Q, Zeng P, Han B F,et al. Preparation of fluorescent carbon dots and its cytotoxicity for[J]. Chinese Journal of Inorganic Chemistry, 2012,28(1):13-19.
[10] Bagheri Z, Ehtesabi H, Hallaji Z,et al. Investigation the cytotoxicity and photo-induced toxicity of carbon dot on yeast cell [J]. Ecotoxicology and Environmental Safety, 2018,161:245-250.
[11] 刘文娟,靳竞男,马家恒,等.荧光碳点纳米材料对大肠杆菌的毒性研究 [J]. 化学与生物工程, 2015,32(9):26-30. Liu W J, Jin J N, Ma J H,et al. Toxic effect of photoluminescent carbon dots nanomaterial on[J]. Chemistry & Bioengineering, 2015,32(9):26-30.
[12] Xiao A, Wang C, Chen J,et al. Carbon and metal quantum dots toxicity on the microalgae[J]. Ecotoxicology and Environmental Safety, 2016,133:211-217.
[13] Kang Y, Li Y, Fang Y,et al. Carbon quantum dots for Zebrafish fluorescence imaging [J]. Scientific Reports, 2015,5(11835):1-12.
[14] Wang K, Gao Z, Gao G,et al. Systematic safety evaluation on photoluminescent carbon dots [J]. Nanoscale Research Letters, 2013,8(122):1-9.
[15] 何春华.光合细菌的分离鉴定和生长条件优化及应用初探 [D]. 哈尔滨:哈尔滨工业大学, 2009. He C H. Research on separation, identification, growth conditions of photosynthetic bacteria and application pre-test [D]. Harbin: Harbin Institute of Technology, 2009.
[16] 卓民权,赵春贵,程茜茹,等.紫细菌光合色素指纹图谱的建立与色素分析 [J]. 微生物学报, 2012,52(6):760-768. Zhuo M Q, Zhao C G, Cheng X R,et al. Fingerprinting analysis of photopigments in purple bacteria [J]. Acta Microbiologica Sinica, 2012,52(6):760-768.
[17] 欧阳少虎.三种碳纳米材料对小球藻的毒性效应及其机理研究 [D]. 天津:南开大学, 2016. OuYang S H. The toxic effects and mechanisms of three carbonaceous nanomaterials on[D]. Tianjin: Tianjin University, 2016.
[18] Lamers P P, van de Laak C C W, Kaasenbrood P S,et al. Carotenoid and fatty acid metabolism in light-stressed[J]. Biotechnology & Bioengineering, 2010,106(4):638-648.
[19] Lemoine Y, Schoefs B. Secondary ketocarotenoid astaxanthin biosynthesis in algae: a multifunctional response to stress [J]. Photosynthesis Research, 2010,106(1/2):155-177.
[20] 李 莹.强光胁迫下雨生红球藻积累次生类胡萝卜素过程中的光合作用变化和光保护机制 [D]. 武汉:华中师范大学, 2005. Li Y. Photosynthetic acclimation and photoprotective mechanism of(Chlorophyceae) during the accumulation of secondary carotenoids at elevated irradiation [D]. Wuhan: Central China Normal University, 2005.
[21] Gomes M P, Le Manac'H S G, Maccario S,et al. Differential effects of glyphosate and aminomethylphosphonic acid (AMPA) on photosynthesis and chlorophyll metabolism in willow plants [J]. Pesticide Biochemistry and Physiology, 2016,130:65-70.
[22] Perreault F, Popovic R, Dewez D. Different toxicity mechanisms between bare and polymer-coated copper oxide nanoparticles in[J]. Environmental Pollution, 2014,185:219-227.
[23] Li Z, Wakao S, Fischer B B,et al. Sensing and responding to excess light [J]. Annual Review of Plant Biology, 2009,60(1):239-260.
[24] Han D, Wang J, Sommerfeld M,et al. Susceptibility and protective mechanisms of motile and non motile cells of(chlorophyceae) to photooxidative stress [J]. Journal of Phycology, 2012,48(3):693-705.
[25] 程茜茹,赵春贵,卓民权,等.沼泽红假单胞菌光合色素的分离、组成分析与光稳定性 [J]. 微生物学通报, 2014,41(1):26-34. Cheng Q R, Zhao C G, Zhuo M Q,et al. Separation, characterization and light stability of photosynthetic pigments from[J]. Microbiology China, 2014,41(1):26-34.
[26] 殷高方,赵南京,胡 丽,等.基于色素特征荧光光谱的浮游植物分类测量方法 [J]. 光学学报, 2014,34(9):312-317. Yin G F, Zhao N J, Hu L,et al. Classified measurement of phytoplankton based on characteristic fluorescence of photosynthetic pigments [J]. Acta Opitica Sinica, 2014,34(9):312-317.
[27] Ledford H K, Niyogi K K. Singlet oxygen and photo-oxidative stress management in plants and algae [J]. Plant Cell and Environment, 2005,28(8):1037-1045.
[28] 姜国飞,李旭飞,吕 艳,等.Cu/ZnO-RGO的抗菌性能及应用 [J]. 中国环境科学, 2018,38(8):3121-3128. Jiang G F, Li X F, Lv Y,et al. Antibacterial properties and application of Cu/ZnO-RGO nanocomposites [J]. China Environmental Science, 2018,38(8):3121-3128.
[29] 陈绪松,李 栋,刘志杰,等.等离子体射流灭活液体中铜绿假单胞菌的研究 [J]. 微生物学通报, 2017,44(4):865-871. Chen X S, Li D, Liu Z J,et al. Inactivation ofin suspension using atmospheric pressure plasma jet [J]. Microbiology China, 2017,44(4):865-871.
[30] Travlou N A, Giannakoudakis D A, Algarra M,et al. S- and N-doped carbon quantum dots: surface chemistry dependent antibacterial activity [J]. Carbon, 2018,135:104-111.
[31] 张 倩.氧化石墨烯对4种微藻的致毒效应研究 [D]. 青岛:中国海洋大学, 2015. Zhang Q. Toxicity of water dispersible graphene oxide (GO) to four species of algae [D]. Qingdao: Ocean University of China, 2015.
[32] 董 微,王 莹,宋有涛,等.荧光碳点与CdTe量子点对毕赤酵母的毒性比较 [J]. 分析试验室, 2012,31(11):1-4. Dong W, Wang Y, Song Y T,et al. Comparison of cytotoxicity of fluorescent carbon dots and CdTe quantum dots for pichia pastoris [J]. Chinese Journal of Analysis Laboratory, 2012,31(11):1-4.
[33] Jiang K, Sun S, Zhang L,et al. Red, green, and blue luminescence by carbon dots: full-color emission tuning and multicolor cellular imaging [J]. Angewandte Chemie-international Edition, 2015,54(18): 5360-5363.
[34] Gong X, Lu W, Paau M C,et al. Facile synthesis of nitrogen-doped carbon dots for Fe3+sensing and cellular imaging [J]. Analytica Chimica Acta, 2015,861:74-84.
[35] Wei J, Zhang X, Sheng Y,et al. Simple one-step synthesis of water-soluble fluorescent carbon dots from waste paper [J]. New Journal of Chemistry, 2014,38(3):906-909.
[36] Deng J, Lu Q, Mi N,et al. Electrochemical synthesis of carbon nanodots directly from alcohols [J]. Chemistry-A European Journal, 2014,20(17):4993-4999.
[37] Sahu S, Behera B, Maiti T K,et al. Simple one-step synthesis of highly luminescent carbon dots from orange juice: application as excellent bio-imaging agents [J]. Chemical Communications, 2012, 48(70):8835-8837.
[38] Jaiswal A, Ghosh S S, Chattopadhyay A. One step synthesis of C-dots by microwave mediated caramelization of poly(ethylene glycol) [J]. Chemical Communications, 2012,48(3):407-409.
[39] Zhai X, Zhang P, Liu C,et al. Highly luminescent carbon nanodots by microwave-assisted pyrolysis [J]. Chemical Communications, 2012, 48(64):7955-7957.
[40] Di J, Xia J, Huang Y,et al. Constructing carbon quantum dots/Bi2SiO5ultrathin nanosheets with enhanced photocatalytic activity and mechanism investigation [J]. Chemical Engineering Journal, 2016,302: 334-343.
[41] Di J, Xia J, Chen X,et al. Tunable oxygen activation induced by oxygen defects in nitrogen doped carbon quantum dots for sustainable boosting photocatalysis [J]. Carbon, 2017,114:601-607.
[42] Sharma S, Umar A, Mehta S K,et al. Solar light driven photocatalytic degradation of levofloxacin using TiO2/Carbon-dot nanocomposites [J]. Chemical Engineering Journal, 2018,42(9):7445-7456.
[43] Zhang J, Yan M, Yuan X,et al. Nitrogen doped carbon quantum dots mediated silver phosphate/bismuth vanadate Z-scheme photocatalyst for enhanced antibiotic degradation [J]. Journal of Colloid and Interface Science, 2018,529:11-22.
致谢:光合细菌由中国科学技术大学盛国平教授馈赠,在此表示感谢.
Effect of nitrogen-doped carbonquantum dots on the growth of photosynthetic bacteria.
ZHOU Yue-ling, YUE Zheng-bo, HU Fu-peng, WANG Jin*
(School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China)., 2019,39(8):3396~3403
Nitrogen-doped carbon quantum dots (N-CQDs) were formed by one-step hydrothermal synthesis, using citric acid as carbon source and ethylene diamine as modifierin this study. The effects of N-CQDs on the growth of photosynthetic bacteriawere investigated by analyzing the physiological indexes of photosynthetic pigment, protein and malondialdehyde. The results showed that N-CQDs inhibited the growth ofand showed a concentration-effect relationship. Additionally, N-CQDs increased the content of carotenoid inwhile it decreased the content of bacteriochlorophyll. Furthermore, spectra analysis results showed that N-CQDs led to the leakage of intracellular sbustances such as photosynthetic pigment and protein. The strong light-induced electron transfer ability of N-CQDs resulted in excessive free radicals in the culture system of, which led to a series of lipid peroxidation reactions, which in turn led to the rupture of biofilms, material leakage and bacterial death. N-CQDs had a high toxicity onunder light. The results of this study are valuable for understanding the phototoxicity and ecological effects of N-CQDs.
N-CQDs;photosynthetic bacteria;photosynthetic pigment;cytotoxicity
X171.5
A
1000-6923(2019)08-3396-08
周岳陵(1994-),男,湖南衡阳人,硕士研究生,主要研究方向为环境生态修复.发表论文1篇.
2019-02-20
国家自然科学基金资助项目(41772361);中央高校基本科研项目(JZ2017YYPY0246)
* 责任作者, 教授, sophiawj@hfut.edu.cn
