灞河流域DOM荧光光谱特征及其对细菌组成的影响
2019-08-28郭梦京周孝德
袁 博,吴 巍,郭梦京,郑 兴,周孝德
灞河流域DOM荧光光谱特征及其对细菌组成的影响
袁 博,吴 巍,郭梦京,郑 兴,周孝德*
(西安理工大学,西北旱区生态水利国家重点实验室,陕西 西安 710048)
为了探讨溶解性有机质(DOM)来源组成对细菌群落结构和多样性的影响,以及细菌群落结构在控制DOM组成及降解中的作用,本研究基于三维荧光光谱-平行因子分析(EEM-PARAFAC)技术研究了灞河水体枯水期(12月)DOM的荧光组分特征及空间分布变化;采用高通量测序技术分析了水体中细菌群落特征.结果表明:灞河水体DOM荧光组分中含有3个腐殖质类组分(C1:240,320/400nm;C2:260-295/478-504nm;C5:240/480nm)和2个蛋白类组分(C3:240,272~284/350~360nm;C4:255~275/326~336nm),5组分之间相关性较好,表明这2类荧光组分具有相似的来源属性;灞河水体门水平中相对丰度最高的为变形菌门(Proteobacteria,54.22%),其次为拟杆菌门(Bacteroidetes,19.40%)、厚壁菌门(Firmicutes,12.28% )、蓝藻菌门(Cyanobacteria,6.46%)和放线菌门(Actinobacteria,3.13%);河流水体中的营养盐含量、水温、电导率及pH值均对细菌群落组成有一定影响.DOM各组分与浮游菌群表现出一定相关关系,且腐殖类和蛋白类组分沿河流纵向梯度对比明显,不同细菌群落对DOM的质量和不稳定性可能有不同的反应.本研究可为河流生物地球化学过程对微生物种群组成和功能影响的研究提供一定的基础数据.
溶解性有机质;细菌群落结构;高通量测序;环境影响因子
浮游细菌是水体生源物质地球化学循环的重要参与者,其多样性是评价水体受污染程度的重要指标[1].天然水体中浮游细菌的群落特征具多样性,其组成特征在水生态系统中具有时空异质性,可能驱动细菌群落在生物地球化学循环中的功能作用发生变化[2-3].溶解性有机质(DOM)作为参与水生态系统中生物地球化学循环的关键成分,是水生植物及微生物矿质营养和有机营养的源泉,也是驱动水体中微生物群落结构与生产方式变化的重要因子之一[2,4].水生态系统中DOM的生物化学循环过程是在一个包含超过50个细菌门的多元化异养微生物环境中进行的,这些菌群的丰度受到包括DOM的含量、来源、分子组成等多种因素的影响,这些参数通常控制细菌生长的群落增长速率和生物量生产,进而影响自然细菌群落的结构和系统发育组的丰度[4-5].
河流作为探索微生物群落结构与DOM特性之间作用关系的理想系统,DOM的空间变化和微生物群落组成在河流纵向呈现很大的梯度特征[6].近年来,随着新一代高通量DNA测序技术和基因组学技术的快速发展,对河流生态系统中微生物群落动态也取得了丰硕研究成果[7].水体微生物的时空分布呈现出明显的异质性特征,驱动因子包括环境条件(水文、光照、温度、降水、营养状况等)和人类活动(土地利用方式、水利工程、污水排放等)[8-9].此外,河流微生物的生境地理异质性也是一个重要的驱动因素[10].然而,当前对淡水中DOM,浮游细菌多样性和动态的研究大多局限于其各自的组成特征,来源解析和影响因素方面[3],且都是环境地理学差异较小的平原河流或者河流的某些区段,鲜有对整条河流上从DOM来源组成对细菌群落和多样性的影响以及细菌群落结构在控制DOM组成及降解中的作用方面开展研究.
灞河流域地处陕西省西安市东南部,西安市第二大河流,受乡村、城镇和城市等典型人类扰动作用的影响,其下游地区已成为典型的城市化河流.随着城市扩张和经济发展和国内对城市河流生态安全的关注,目前灞河流域水环境研究主要集中于生态系统风险及健康评价[11]、非点源污染控制[12]、抗生素及抗性基因[13]和污染源解析[14]等方面.鲜有从生物地球化学循环和分子生物学角度对灞河水体细菌群落变化特征和DOM的关系进行研究.基于此,本研究采用三维荧光和平行因子分析联用检测技术,探究人类活动影响下灞河流域DOM荧光变化特征;采用微生物高通量测序技术识别灞河水体中细菌群落组成和结构特征,分析DOM的空间变化和细菌群落结构组成特征及其对水环境的影响,以期为灞河流域的饮用水源地生态治理和水环境保护提供科学依据.
1 研究区域、材料与方法
1.1 样品采集与理化指标分析
灞河流域(109°00′~109°47′E,33°50′~34°27′N,图1),发源于秦岭北麓蓝田县灞源乡九道沟,河流全长104.1km,主要支流有浐河、兰桥河、辋川河等[15],流域面积2581km2,河床平均比降6.0‰;浐河是灞河下游最大支流,全长66.4km,流域面积752.8km3,河床平均比降19.8‰.流域属暖温带半湿润大陆性季风气候,多年平均气温13.3℃,年平均蒸发量776mm,降水分布由北部秦岭山区向南部川道平原逐渐增加,其中河流源区年平均降水量830mm,河口区域年平均降水量720mm.

图1 灞河流域采样点位示意
本研究于2017年12月分别采集灞河流域主要干,支流共17个点位的表层水样.其中S1~S10, S12~S13位于灞河干流及上游支流口,由于下游支流浐河流量较小,仅在浐河咸宁桥以下到浐河入灞河口的城市河段采集S14,S16,S17共3个点,在西安市第三、第五污水处理厂出水口(S15,S11)分别采集样品,所有采样点均以GPS定位.在每个采样点位的河流断面,依据水流向的左、中、右采集水样.使用有机玻璃采水器采集水样,每个采样点采集3次,将3次样品混合作为该采样点样品,混合水样装入4L聚乙烯水样瓶.
现场采用多参数水质测定仪(YSI EXO)测定水温()、pH值、溶解氧(DO)、电导率(EC)、氧化还原电位(ORP)等基础指标,于4℃的保温箱内保存送回实验室24h内进行分析.实验室分析中,未过滤水样用于测量总氮(TN)、总磷 (TP),其中总磷采用总磷分析仪(IL 500,Hach)测定,总氮参照《地表水环境质量标准》(GB3838-2002)测定[16].经过0.45μm醋酸纤维滤膜过滤后的水样保存于4℃冰箱备用,采用流动分析仪(SKALAR San++,荷兰)测定氨氮(NH4+-N)、硝酸盐(NO3−-N)、亚硝酸盐(NO2−-N), DOC含量采用TOC分析仪(Elementar Vario TOC,德国)测定.用于高通量测序的水样通过0.22μm孔径滤膜过滤,将过滤后的滤膜放入-80℃冰箱保存,用于后续DNA提取.
1.2 样品采集与理化指标分析
利用三维荧光光谱仪(Horiba Fluoromax- 4spectrofluorometer,HORIBA,法国)进行荧光光谱分析[17],配以1cm石英比色皿.激发波长(λ):200~ 500nm,发射波长(λ):230~550nm.仪器激发光源为150W氙灯,光电倍增电压:400V,激发和发射狭缝宽度均为5nm,响应时间:0.5s,扫描速度2400nm/min.以Millipore®超纯水(18.2MΩ.cm)作为空白,对过滤后的水样进行荧光扫描,系统自动扣除拉曼和瑞利散射.UV254的测定采用紫外可见分光光度计(Agilent8453,美国),以1cm比色皿Millipore®超纯水做空白,同时测定溶液在254和355nm处的吸光度,利用其差值消除悬浮物吸光度值测定的影响.
1.3 DNA的提取和高通量测序
利用E.Z.N.A.Water DNA Kit (Omega Bio-tek, Norcross,GA,USA)说明书步骤提取水样中微生物的DNA,采用1%琼脂糖凝胶电泳检测抽提的DNA[18].对16S rRNA基因的V4~V5高变区片段进行PCR扩增,引物序列[19]为515F (5′-GTGCCAGCMGCC- GCGG-3′)和907R (5′-CCGTCAATTCMTTTRAG- TTT-3′).细菌扩增反应条件为:95℃预变性2min,接着进行25个循环,包括95℃变性30s,55℃退火30s, 72℃延伸30s;操作结束后在72℃延伸5min,于4℃保存样本.每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences, Union City,CA,USA)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测.根据电泳初步定量结果,将PCR产物用Quanti FluorTM-ST蓝色荧光定量系统(Promega,USA)进行定量检测,按照每个样本的测序量要求,进行相应比例的混合.测序在北京诺禾致源生物信息科技有限公司的HiSeq2500PE250平台进行.
1.4 统计分析
DOM荧光组分分析:在Matlab 2014b中使用DOMFluor工具箱对采样点的数据进行平行因子分析(PARAFAC),利用折半分析法来验证分析结果的可靠性,各组分的丰度以最大荧光强度Fmax(RU, Raman单位)来表示[20].利用Uparse(v7.0.1001)对所有样品的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs.使用Qiime软件(Version 1.9.1)计算Observed-species、Chao1、Shannon、Simpson、ACE、Goods-coverage、PD_ whole_tree指数.用Qiime软件(Version 1.9.1)计算Unifrac距离,构建UPGMA样品聚类树.使用R软件(Version 2.15.3)绘制PCA、PCoA和NMDS图.NMDS分析使用R软件的vegan软件包.使用R软件进行Beta多样性指数组间差异分析,分别进行有参数检验和非参数检验.利用SPSS(22.0版本)进行细菌群落多样性与环境因子的Pearson相关性分析和主成分分析;采用CANOCO (4.5版本)对环境因子与细菌门分类群落进行冗余分析(RDA)研究.
2 结果与讨论
2.1 灞河DOM空间分布特征和荧光组分的识别表征
灞河水体中DOC含量与其他河流类似[21-23](图2a),其均值为3.37mg/L,其中源区、上游、中游和下游分别为1.87,2.17,2.68,4.91mg/L.从源头开始,在灞河蓝田县城以下DOC逐渐增加,上、中游DOC浓度相对较低且稳定,在灞河湿地公园以下DOC浓度快速升高,高出上游约126%.DOC中的SUVA254的均值为1.95L/(mg·m),河流纵向梯度上在中、下游河段增加较快,但其变化趋势没有DOC明显.灞河水体从源头到河口均不同程度的出现了代表类腐殖质和类蛋白质的荧光物质,与源区和上游相比,中游和下游沿岸接纳了蓝田县和西安市大量工业废水和生活污水,人为影响较大,大量DOM进入河流内造成中下游水体营养盐升高,微生物活动活跃,浮游动植物死亡分解后产生大量类蛋白物质,导致下游的类腐殖酸物质和类蛋白物质均较高,使其DOM兼具了陆源与生物来源的双重特性.分别采用F(355)和F(280)来表征类腐殖质组分和类蛋白组分的相对浓度[24](图2b),其中F(355)表示陆生源对水体DOM 组成的贡献,F(280)表示自生源对水体DOM 组成的贡献.灞河F(355)相对浓度自源区向下依次为(209.95±82.18), (306.18±94.49), (278.59±67.9), (890.64±54.1)R.U.;而F(280)自源区向下依次为(115.91±22.37), (192.72±30.53), (282.76±22.41)和(724.29±383.41) R.U.,两值在不同区段均差异极显著(<0.01),灞河水体DOM中类蛋白类浓度自上而下呈现逐渐增高的趋势,DOM中腐殖类组分比重逐渐增加;而类腐殖质组分浓度呈现先降低后逐渐升高的趋势,这主要是因为在河流源区,冬季落叶腐烂分解产生腐殖酸随融雪作用通过土壤淋溶和地下水等方式进入河流使得源区DOM中类腐殖质类物质含量较多.随着DOM随水流的纵向输移、稀释和光降解作用,上游农村河段较源头水体中类腐殖质物质浓度有所降低,但总体相差不大.中游由于蓝田县城周边的人类活动和农业生产的增加,生活污水和农业灌溉等非点源排入,大量营养物质进入河流水体,使得河流初级生产力增加,腐殖质浓度又呈升高趋势.下游污水厂出水口以下DOM中类蛋白类组分增强[25],这主要是因为河流进入城市后形成的景观湖使得水流变缓,水深增加,以藻类为代表的内源代谢过程增强所致.

图2 各采样点DOM样本的Fn(355)和Fn(280)
根据PARAFAC模型区分DOM三维荧光光谱,灞河流域共有5个荧光组分(图4和表1),包括3个腐殖质类组分和2个蛋白质类组分.组分C1(240, 320/ 400nm)的2个荧光峰对应于传统寻峰法对应的A/C峰,是典型的陆源腐殖质成份,与长江溶解性有机质组分中的H1非常接近[22].组分C2 (260~295/478~504nm)主要反映了长波激发类腐殖质的荧光性质,荧光峰对应传统的A/M峰,该组分在其他淡水河流及水库中均有发现,一般是分子量较高的芳香氨基酸,荧光特征与富里酸接近[25].组分C3 (240, 272~284/350~360nm)与色氨酸荧光峰(220~230, 270~280/350nm)接近,表明该组分为一个类色氨酸.组分C4 (255~275/326~336nm)与酪氨酸(270/320nm)接近,但发射峰的波长有所红移,表明C4主要为类酪氨酸组分,同时也含有一些类色氨酸的信号.组分C5 (240/480nm)的单个荧光峰的发射峰比C1更长一些,反映了该组分对应于DOM中的高分子量和芳香类腐殖类物质,广泛存在于河流中游湿地和上游森林环境中.


图4 采用平行因子法识别的5个荧光组分
C1,C2和C5主要来自于陆源土壤径流,枯叶腐烂释放及地下水渗流等过程;C3与C4是由微生物和浮游植物作用所产生,主要受到外源生活废水和农业非点源影响.C3与C4荧光强度的顺序为下游城市段>中游城镇段>上游农村段>源头林区段,表明下游城市段中类蛋白物质含量相对较高,这主要和城市河段中人类活动导致的点源污染较多,污水处理厂主要分布在下游城市河段有关;中游主要是农业生产区和城镇生活区,DOM主要通过地表径流、生活污水直排和农业非点源输入河道,给微生物提供了充足的营养来源,代谢活动较为活跃,这有助于提高DOM中类蛋白质的贡献比例,源头林区段DOM主要是树叶等凋落腐烂分解所产生.

表1 5种荧光峰位置及指示意义
2.2 水体细菌OTU聚类、群落丰度与多样性分析

各采样点的OTU聚类结果(图5a)测序文库的覆盖率均在98%以上,表明各个采样点的测序结果足以代表样本的真实情况.每个采样点的有效序列数(用于OTU聚类等后续分析的有效数据)均在20000以上,本次测序产生的OTUs是将所有样品的有效序列进行统计,以97%的一致性将序列聚类而成[31-32],对OTUs的代表序列进行物种注释.稀释曲线(图5b)表明各采样点在有效测序数达到45000时,曲线已渐进平缓,检测出的细菌种类大都停留在2000个左右,表明用于OTU聚类的测序数满足要求[33],且聚类产生的OTUs可以用于后续物种注释.灞河流域17个水样的高通量测序共得到1392466条高质量基因序列.为了研究样品的物种组成多样性,对所有样品的有效序列进行聚类,以97%相似度划分,得到7532条OTUs,单个水样的OTU数量为1988~3111,平均值为2650.各样本文库的覆盖率 (Coverage)范围均在98.5%以上,能够代表灞河水体细菌群落的真实情况.
对多样性指数进行分析(图6a),Chao1指数的平均值为2866,最大值出现在S11采样点(3459),最小值出现在S1采样点(1779); Shannon 指数的平均值为7.58,最大值出现在S16采样点(8.12),最小值出现在S4采样点(6.61).基于多序列比对计算得出各采样点的Shannon指数和Simpson指数,结果表明,各采样点的Shannon指数为河口>中上游城镇段>下游城市段>源区; Simpson指数为中上游城镇段>河口>下游城市段>源区; Chao1指数为河口>下游城市段>中上游城镇段>源区; ACE指数为河口>下游城市段>中上游城镇段>源区.总体来看,Shannon指数、Simpson指数、Chao1指数和ACE指数为河口>下游城市段>上中游城镇段>源区,单因素方差分析表明不同采样点Shannon指数不存在显著差异(=0.257),Simpson指数、Chao1指数和ACE指数差异性显著(<0.01).

描述灞河源头到河口微生物物种组成的多样性对于了解各种河流纵向尺度上水体中微生物多样性的模式至关重要,可以考察不同河段的微生物生境多样性,有利于了解整个灞河流域的微生物生产力差异.选用Weighted Unifrac距离指标来衡量不同河段采样点间的相异系数(图6b).河流源头(S1)与河口(S13)相异系数较大(0.532),浐、灞河交汇口之前(S10)与浐河城市段(S14)以及第三污水处理厂出水(S15)与第五污水处理厂出水(S11)相异系数较小,分别为0.076和0.094,下游河段微生物的多样性降低,但其生产力提高.
2.3 灞河水体细菌群落结构变化特征
对17个灞河水样进行高通量分析得到6232条OTUs,在界、门、纲、目、科、属和种分类水平上未能进行分类的OTU 比例分别为3.61%,4.03%, 5.04%,7.07%,8.10%,27.64%和80.92%,表明在种分类水平上灞河水体存在大量未知类型细菌.图7为门水平上的细菌分类,相对丰度最高的是变形菌门(Proteobacteria,54.22%),其次为拟杆菌门(Bacteroidetes, 19.40%)和厚壁菌门(Firmicutes, 12.28% ),三者占总基因序列的比例达到了85.91%.研究表明大多数的Proteobacteria门对DOM具有很强的代谢能力,使其在氮磷负荷较重的河流水体中占据主导地位[34]. Proteobacteria中丰度最高的是β-变形菌纲(Beta- proteobacteria,26.64%),其次为γ-变形菌纲(Gamma- proteobacteria,12.84%),ε-变形菌纲(Epsilon- proteobacteria,6.90%)和α-变形菌纲(Alpha- proteobacteria,5.90%). Bacteroidetes门是一个系统发育复杂且变化程度较高的群体,可以将复杂的有机高分子转化为简单化合物,在水体生态系统中起着重要的作用[35].Bacteroidetes中丰度最高的是拟杆菌纲(Bacteroidia,7.94%),其次为黄杆菌纲(Flavobacteriia,7.02%);Firmicutes门中丰度最高的是梭菌纲(Clostcridia,5.69%),其次为芽孢杆菌纲(Bacilli,3.55%)和丹毒丝菌纲(Erysipelotrichia, 2.78%).此外,相对丰度较高的依次为蓝藻菌门(Cyanobacteria,6.46%),放线菌门(Actinobacteria, 3.13%),疣微菌门(Verrucomicrobia,0.97%),梭杆菌门(Fusobacteria, 0.62%), Parcubacteria (0.37%),螺旋体菌门(Saccharibacteria,0.17%)和柔膜菌门(Tenericutes, 0.13%),其它门类别的平均相对丰度均小于0.1%.系统发育树表明位于同一河段的细菌组成可能较为相似,河源区(S1)中Bacteroidetes明显高于Proteobacteria,下游河段Cyanobacteria丰度增加明显,可能与下游景观橡胶坝建设形成的湖泊水体停留时间较长有关,而中游城镇河段采样点中和污水排放有关的细菌门类Firmicutes则占据优势.
图8为细菌群落的属水平分类,选取属水平下相对丰度>1%的优势细菌重新进行相对丰度的计算,以更显著地表明不同河段水体中优势细菌的丰度差异性(图8).其中归属于Others的细菌主要有气单孢菌属()、极地单胞菌属()、不动杆菌属()、阿克曼菌属()等.河源区(S1)的主要优势类群为拟杆菌属()、副状杆菌属()和无害梭菌属([]__group),平均丰度分别为26.14%、7.61%和5.01%;河口区(S13)的主要优势类群为_、和,平均丰度分别达到16.88%、7.89%和5.87%;值得注意的是,在每个采样点均有检出,其中S9的最高,其次是S3;、、、和分别在S4、S14、S3、S11和S1丰度最高.
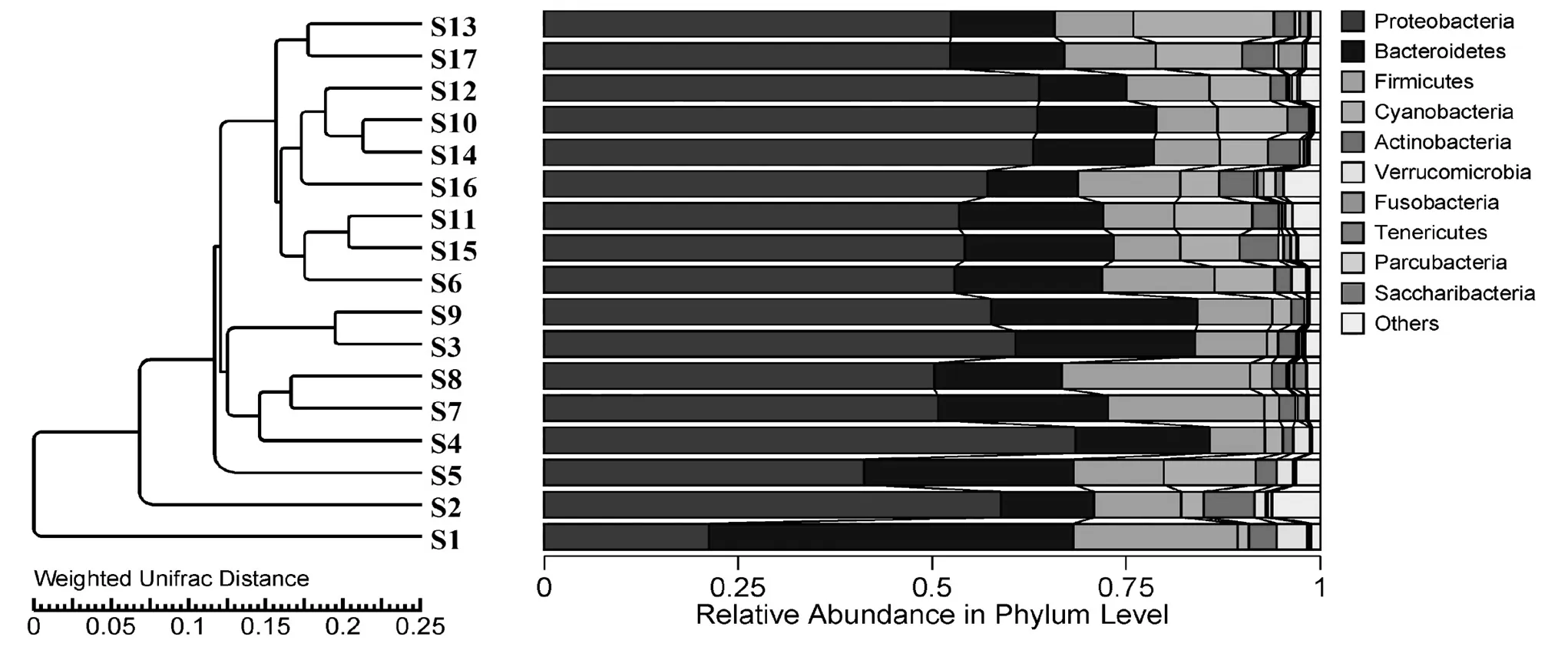
图7 UPGMA聚类树与门水平优势灞河水体细菌

图8 属水平优势细菌丰度

选取门、纲、目、属水平下相对丰度>1%的优势细菌与不同河段进行差异显著性分析(表2).单因素方差分析表明,不同优势细菌在河段之间的差异显著性不同.1类门水平优势细菌Proteobacteria (=0.011)、2类纲水平优势细菌Betaproteobacteria (=0.010)和Bacteroidia (=0.011)在河源区、城镇段和城市段之间差异不显著(³0.01).3类门水平优势细菌(Bacteroidetes、Firmicutes和Cyanobacteria)、2类纲水平优势细菌(Gamma-proteobacteria和Cyanobacteria)、3类目水平优势细菌(Burkholderiales、Bacteroidales和Pseudomonadales)和3 类属水平优势细菌(和)在不同河段之间差异非常显著(<0.01).
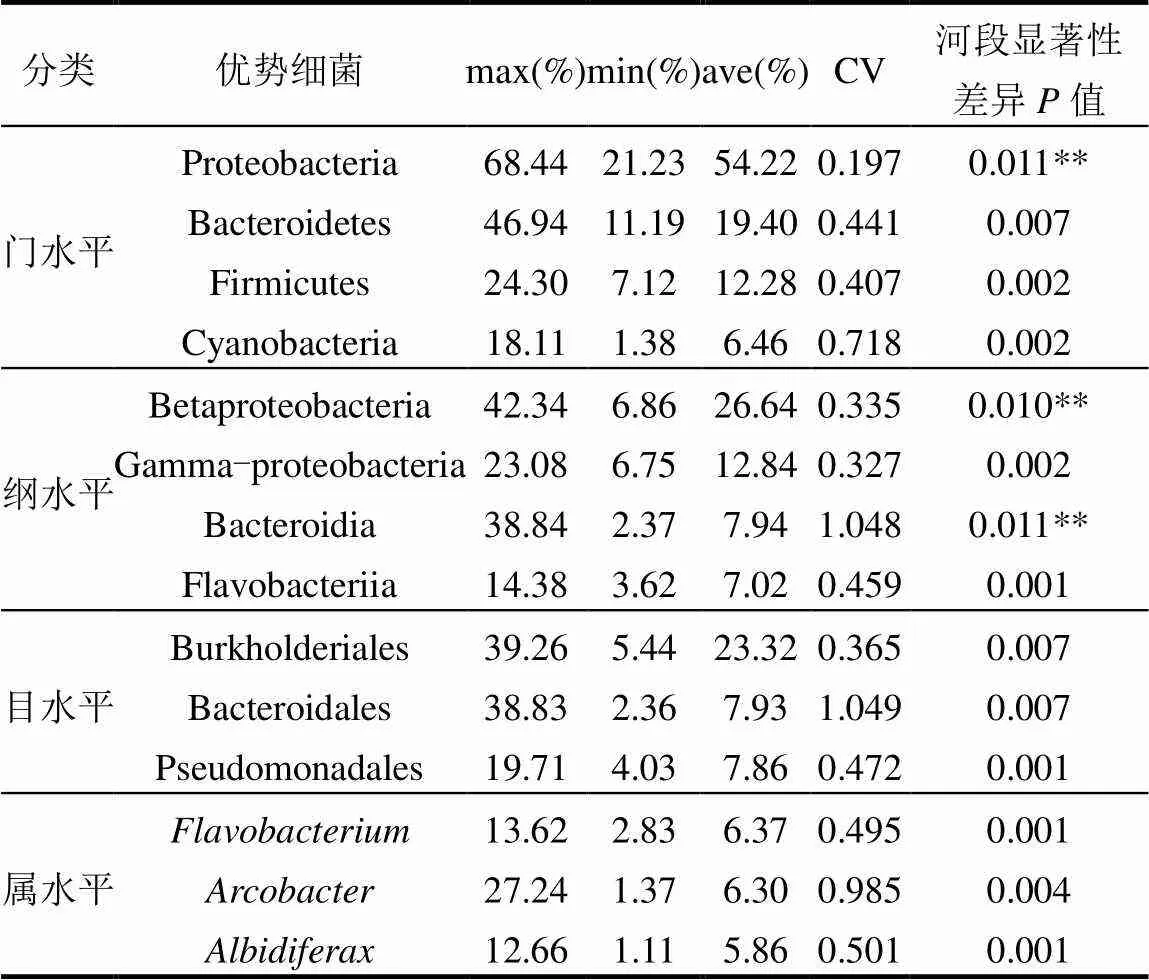
表2 不同分类水平下优势细菌差异显著性
注:**³0.01.
浮游细菌是生源物质循环转化和生态系统能量流动的关键物种,在水生生态系统中起着重要作用.国内外大多数研究表明,Proteobacteria, Bacteroidetes和Actinobacteria等3个门类细菌是主导河流、湖泊等淡水水体中的优势细菌门类[35];黄河水体中微生物的研究表明,水体中细菌群落的季节差异性显著,水电梯级开发对微生物群落变化影响剧烈,种群分布的生物地理学特征明显[36];南明河的研究表明TN和TP是细菌群落特征变化主要水质因子[37].另外,河流的源流特征和流量变化也会影响细菌随流输运的能力,对某些类型细菌如Firmicutes影响明显[38-39].赣江丰水期细菌群落特征研究表明,暴雨径流中Firmicutes会取代Actinobacteria和Proteobacteria成为丰度最高的菌群[38,40];Jeon等[41]研究发现,沙尘细菌的优势群落为Firmicutes (53%)和Actinobacteria (18%); 英国Thames河的研究[42]表明,受河流的水流特性及输运能力的影响,细菌门类在河流的上、下游会发生结构性变化.本次研究区从灞河上游到灞河河口,Proteobacteria虽然一直是相对丰度最高的门分类群落,但下游河段中Cyanobacteria的相对丰度在逐渐增加,与以上研究结果相类似;但Cyanobacteria的丰度位于Bacteroidetes和Firmicutes之后,这主要是由于冬季温度较低,抑制了Cyanobacteria细菌的生长和繁殖,而冬季灞河流量较小,中游水体中未经处理的生活及粪便污水排放贡献增加,导致Firmicutes和Bacteroidetes丰度较高.Vannote等[43]提出了河流连续体概念,认为河流生态群落能够改变自己的结构和功能牲,使之适应具有连续梯度的非生物环境.本次研究区上、下游河流长度约为107km,较短的距离使各采样点间的生物多样性及群落结构差异不显著.
2.4 浮游细菌与水环境因子的相关性
为探究环境因子对水体中微生物种群分布的影响,对主要门分类种群(平均丰度大于0.5%)和水质因子进行冗余分析(图9),第一主轴对门水平细菌群落方差变化的解释量为46.3%,第二主轴的解释量为16.3%.其中DO、pH值和TP与第一主轴呈显著正相关;水温()、NO3--N、TN、EC和Chl-a与第一主轴呈显著负相关;除了ORP与第二主轴呈现弱负相关外,其余环境指标均与第二主轴呈正相关.可见,水环境中的营养盐水平、水温、电导率及pH值均对灞河冬季水体中细菌群落有一定影响.
第一大门分类种群Proteobacteria受温度影响较大,且与NO3--N呈较强正相关关系,相关系数均大于0.850; 而第二大门分类种群Bacteroidetes则恰好相反,与温度、NO3--N、DOC、TN等环境因子呈较强的负相关关系;第三大门类种群Firmicutes与DO呈现显著正相关性(<0.05),相关系数为0.881,且与pH和TP呈正相关.Cyanobacteria和Actinobacteria门类种群与DO、pH值和TP呈现负相关关系,Verrucomicrobia门类种群与DO呈现正相关,与温度和NO3--N呈现负相关.
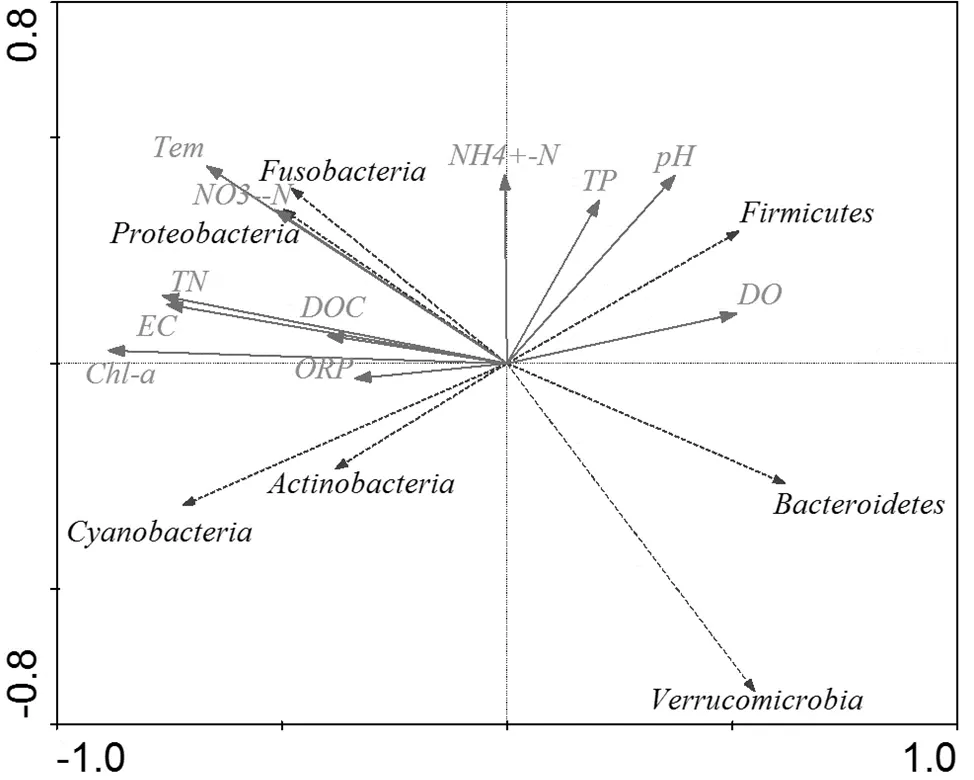
图9 浮游细菌与环境因子的RDA图
河流水体细菌群落结构受多种环境及水质因子的影响,不同研究中得到结论差别较大(表3).就单次采样结果而言,水质指标对细菌群落结构的空间变化产生主要影响.如Liu等[44]对东江研究发现氮营养盐是影响细菌群落的主要因素;唐婧等[37]对南明河细菌群落研究发现TN和TP是其主要影响因子.地中海间歇性河流的研究表明河流水文破碎影响了河流环境特征(如氧化还原势和DOC质量),促使细菌群落选择性分布[45].在淡水系统中,溶解性无机氮(DIN)对细菌群落结构产生影响,特定细菌系统构型与DIN之间存在明显相关关系.Gao等[46]发现溪流水体生物膜的Beta-proteobacteria和Gamma- proteobacteria多存在于DOC和NO3--N浓度高的区域,而Alpha-proteobacteria则在DOC和NO3--N负荷低的环境中更丰富.相比之下,不同形态的P则对细菌群落的丰度或组成影响不大,尽管之前的观测表明夏季浮游生物群落在河流受到P的限制强烈.从我们的研究结果来看,在灞河流域水体中,NO3--N是驱动细菌群落变化的更重要因素,这与之前的研究结果类似.然而,需要指出的是,土地利用、河流生态水文过程及人类活动均会对微生物群落特征产生重要影响,需要对复杂因素进行更深入分析和辨明.
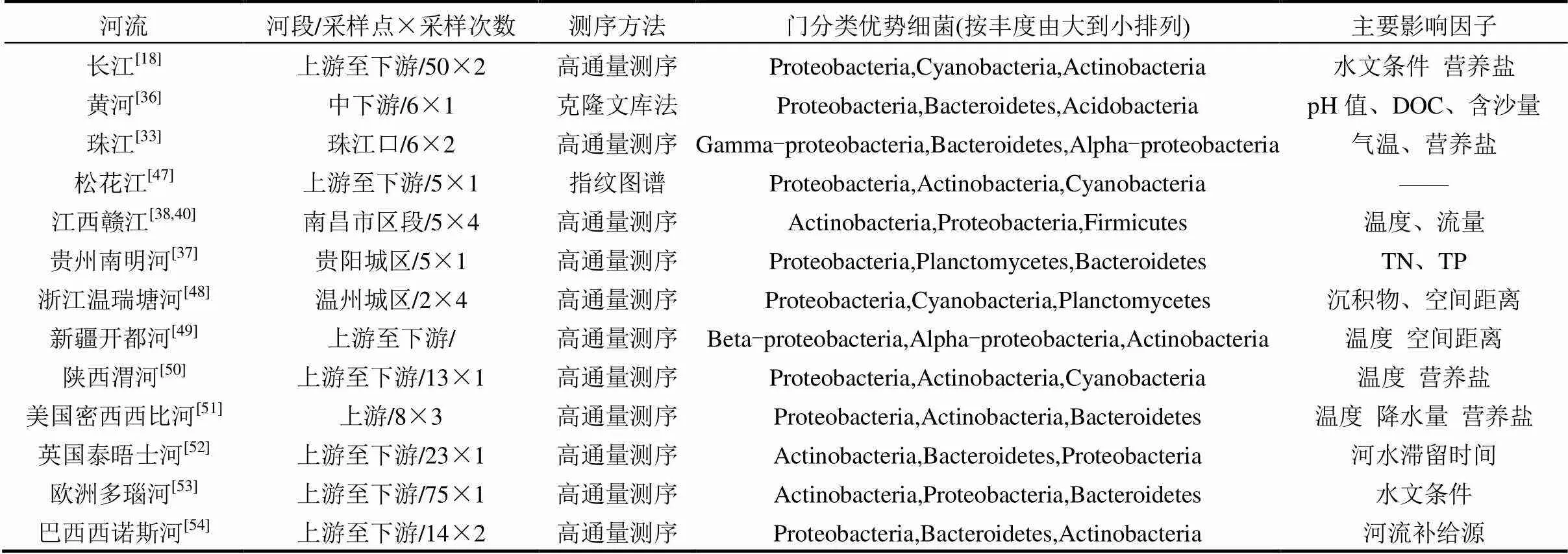
表3 国内外河流基于16S rRNA方法的细菌群落及影响因子研究结果
注:——表示文献中未进行细菌群落影响因子的研究.

表4 灞河水体DOM不同荧光组分之间的相关性
注:**<0.01.
2.5 DOM荧光组分与水体细菌群落结构的相关性
进一步探究DOM各荧光组分对灞河水体细菌群落结构的影响可以发现,第一主成分中所包含的类腐殖质组分(C1,C2和C5)以及类蛋白质组分(C3和C4)之间表现出正相关关系(表4),而DOM各组分与Beta-proteobacteria和Chloroplast菌群表现出弱正相关关系,与Bacteroidia和Clostridia菌群则表现出弱负相关关系(图10),且对上游和中游点位的影响比较明显.DOM荧光组分之间正相关性暗示第一主成分中类腐殖质和类蛋白质组分可能具有相同的来源,而类腐殖质荧光组分C1和C2具有典型的“陆生源”性质,在河流水体陆源DOM生物地球化学转化和光解动力学过程中Beta-proteobacteria和Chloroplast菌群对其有一定促进作用[34],因此第一主成分主要反映了由灞河流域外源输入的DOM荧光组分(含腐殖质类和蛋白质类),其贡献率为41.8%.第二主成分中Alpha-proteobacteria、Beta-proteobacteria和Chloroplast之间表现为正相关关系,而DOM各组分与其他菌群均表现出弱负相关关系.第二主成分中,随着采样点分布变化,Beta-proteobacteria、Alpha-proteobacteria和Chloroplast等细菌呈纵向梯度变化.因此第二主成分主要反映了灞河流域在河流纵向梯度上细菌的群落结构变化特征,其贡献率为15.5%.

图10 浮游细菌与DOM组分的主成分分析载荷图
已有研究表明,河流的生物地球化学过程对微生物种群组成和功能有重要影响[4].通常认为DOM的浓度和组成、细菌群落结构以及其他因素以复杂的方式相互作用以促进胞外酶活性,从而驱动DOM的水解,并最终在水生生态系统中通过异养细菌使DOM矿化[45].河流中的DOM通常以陆生有机物质为主,其稳定性相对较高.浮游生物生成的DOM富含蛋白质和不稳定多糖,而陆生DOM含有腐殖质和结构多糖,如纤维素和木质素,陆生DOM对微生物矿化作用具有相对较高的抗性.DOM组成及来源对细菌的影响不仅体现在细菌的丰度、形态类型、细胞大小以及附着细菌与自由活动细菌比例上的变化,还体现在细菌群组内不同群体之间相对贡献上.此外,DOM还与一些细菌群落具有较强相关性,特别是当与Beta-proteobacteria共存时,它们群落的丰度随着DOM浓度的增加而增加.Beta-proteobacteria通常包括快速生长的大细胞,这些细胞可快速影响不稳定的DOM组分的光解和生物动力学过程.藻类的裂解产物可能富含不稳定的有机化合物,细菌系统中的一些已知菌属则会利用某些浮游植物的分泌物来促进其细胞生长和菌群的发育[55-56].因此,从灞河上游到下游水域,Beta-proteobacteria数量的增加可能部分与浮游植物群落季节性变化所产生的DOM的生物可利用性或来源的变化有关.
然而,相关研究同时也表明,仅仅依靠DOM组成和浓度对细菌多样性进行预测的效果并不理想,因为不同的菌群对DOM的质量和不稳定性有不同的反应.Cottrell和Kirchman[49]发现特定细菌对DOM使用上的差异,在Proteobacteria和Cytophaga- like细菌的系统分类中,Cytophaga-like细菌擅长使用生物聚合物和高分子量的DOM,如果这些菌群使用DOM的方式或对DOM的反应存在系统性差异,或者这些菌群始终由DOM利用率不同的少数菌属所主导,则DOM的变化可能影响这些系统发育群的丰度.然而,目前尚不清楚细菌对DOM使用在这个系统发育水平上是否具有普遍性,因为这些菌群每一个都包含不同分类水平,这些分类水平下的子群落变化可能随时间和空间而差异很大,因此,细菌各分类水平下菌群变化对DOM不同组分的作用机制有待进一步探索.
3 结论
3.1 灞河水体DOM荧光组分中含有3个腐殖质类组分和2个蛋白类组分,5各组分之间相关性较好.从河流源区到河口,DOM在纵向河流梯度有明显的降解程度和来源的空间差异,下游城市河段缓流水体DOC浓度升高并趋于稳定,微生物及光解过程对下游水体有机质的降解能力逐步增强.
3.2 灞河水体中相对丰度最高的是变形菌门(Proteobacteria,54.22%),其次分别为拟杆菌门(Bacteroidetes,19.40%)、厚壁菌门(Firmicutes, 12.28%)、蓝藻菌门(Cyanobacteria,6.46%)和放线菌门(Actinobacteria,3.13%).在属分类水平上,黄杆菌属(,6.37%)与弓形杆菌属(, 6.30%)是灞河水体中优势类群.在属和种分类水平上,灞河水体存在大量未知类型细菌.
3.3 河流水体细菌群落结构受水体中营养盐水平、水温、电导率及pH值影响明显.DOM各组分与浮游菌群有一定相关关系,且沿河流纵向梯度变化明显,不同菌群对DOM的质量和稳定性有不同反应.
[1] Bai Y, Qi W, Liang J, et al. Using high-throughput sequencing to assess the impacts of treated and untreated wastewater discharge on prokaryotic communities in an urban river [J]. Applied and Environmental Microbiology, 2014,98:1841-1851.
[2] Akkanen J, Lyytikäinen M, Tuikka A, et al. Dissolved organic matter in pore water of freshwater sediments: effects of separation procedure on quantity, quality and functionality [J]. Chemosphere, 2005,60(11): 1608-1615.
[3] Lepane V, Künnis-Beres K, Kaup E, et al. Dissolved organic matter, nutrients, and bacteria in Antarctic soil core from Schirmacher Oasis [J]. Journal of Soils and Sediments, 2018,18:2715-2726.
[4] Sulzberger B, Durisch-Kaiser E. Chemical characterization of dissolved organic matter (DOM): a prerequisite for understanding UV-induced changes of DOM absorption properties and bioavailability [J]. Aquatic Sciences, 2009,71:104-126.
[5] Ruiz-González C, Niño-García J P, Del Giorgio P A. Terrestrial origin of bacterial communities in complex boreal freshwater networks [J]. Ecology Letters, 2015,18:1198-1206.
[6] Wang L, Zhang J, Li H L, et al. Shift in the microbial community composition of surface water and sediment along an urban river [J]. Science of the Total Environment, 2018,627:600-612.
[7] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010,7:335-336.
[8] Drury B, Rosi-Marshall E, Kelly J J. Wastewater treatment effluent reduces the abundance and diversity of benthic bacterial communities in urban and suburban rivers [J]. Applied and environmental microbiology, 2013,79:1897-1905.
[9] Ibekwe A M, Map J, Murinda S E. Bacterial community composition and structure in an Urban River impacted by different pollutant sources [J]. Science of the Total Environment, 2016,566:1176-1185.
[10] Lundgaard A S B, Treusch A H, et al. Nitrogen cycling and bacterial community structure of sinking and aging diatom aggregates [J]. Aquatic Microbial Ecology, 2017,79:85-99.
[11] 徐志嫱,刘 维,张建丰,等.基于流域不同特征的浐灞河生态系统健康评价[J].西北农林科技大学学报(自然科学版),2011,39(8):215- 223. Xu Z Q, Liu W, Zhang J F, et al. Ecosystem health assessment based on the different characteristics of Chanba river basin, Xi’an [J]. Journal of Northwest A & F University (Natural Science Edition), 2011,39(8):215-223.
[12] 秦耀民,李怀恩.基于降雨事件监测的非点源污染对灞河水质的影响[J].中国环境科学, 2014,34(5):1173-1180. Qin Y M, Li H E. Impact of nonpoint source pollution on water quality of the Bahe River based on rainfall events monitor [J]. China Environmental Science, 2014,34(5):1173-1180.
[13] Jia J, Guan Y J, Cheng M Q, et al. Occurrence and distribution of antibiotics and antibiotic resistance genes in Ba River, China [J]. Science of the Total Environment, 2018,642:1136-1144.
[14] 邢 萌,刘卫国.西安浐河、灞河硝酸盐氮同位素特征及污染源示踪探讨[J].地球学报, 2008,29(6):783-789. Xing M, Liu W G. Nitrogen Isotopic Characteristics of Nitrate and Contamination Source Tracing of the Chanhe River and the Bahe River in Xi'an [J]. Acta Geoscientia Sinica, 2008,29(6):783-789.
[15] 胡 胜,曹明明,邱海军,等.CFSR气象数据在流域水文模拟中的适用性评价--以灞河流域为例[J].地理学报, 2016,71(9):1571-1586. Hu S, Cao M M, Qiu H J, et al. Applicability evaluation of CFSR climate data for hydrologic simulation: A case study in the Bahe River Basin [J]. Journal of Geographical Sciences, 2016,71(9):1571-1586.
[16] 国家环境保护总局.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002:88-284.The State Environmental Protection Administration. Water and wastewater monitoring and analysis method [M]. Beijing: China Environmental Science Press, 2002:88-284.
[17] Hosen J D, Mcdonough O T, Febria C M, et al. Dissolved Organic Matter Quality and Bioavailability Changes Across an Urbanization Gradient in Headwater Streams [J]. Environmental Science & Technology, 2014,48(14):7817-7824.
[18] Liu T, Zhang A N, Wang J W, et al. Integrated biogeography of planktonic and sedimentary bacterial communities in the Yangtze River [J]. Microbiome, 2018,6(16):2-14.
[19] Shan J, Ji R, Yu Y, et al. Biochar, activated carbon, and carbon nanotubes have different effects on fate of14C-catechol and microbial community in soil [J]. Scientific Reports, 2015,5:16000.
[20] Wünsch, Urban, Murphy K, Stedmon C A. The One-Sample PARAFAC Approach Reveals Molecular Size Distributions of Fluorescent Components in Dissolved Organic Matter [J]. Environmental Science & Technology, 2017,51:11900-11908.
[21] Ejarque E, Freixa A, Vazquez E, et al. Quality and reactivity of dissolved organic matter in a Mediterranean river across hydrological and spatial gradients [J]. Science of the Total Environment, 2017,599-600:1802-1812.
[22] 甘淑钗,吴 莹,鲍红艳,等.长江溶解有机质三维荧光光谱的平行因子分析[J].中国环境科学, 2013,33(6):1045-1052. Gan S C, Wu Y, Bao H Y, et al. Characterization of DOM (dissolved organic matter) in Yangtze River using 3-D fluorescence spectroscopy and parallel factor analysis [J]. China Environmental Science, 2013, 33(6):1045-1052.
[23] 梁 俭,江 韬,魏世强,等.夏、冬季降雨中溶解性有机质(DOM)光谱特征及来源辨析[J].环境科学, 2015,36(3):888-897. Liang J, Jiang T, Wei S Q, et al. Absorption and Fluorescence Characteristics of Dissolved Organic Matter (DOM) in Rainwater and Sources Analysis in Summer and Winter Season [J]. Environmental Science, 2015,36(3):888-897.
[24] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010,7(5):335-336.
[25] Yang X F, Zhou Z B, Raju M N, et al. Selective elimination of chromophoric and fluorescent dissolved organic matter in a full-scale municipal wastewater treatment plant [J]. Journal of Environmental Sciences, 2017:150-161.
[26] Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis [J]. Limnology and Oceanography, 2005,50: 686-697.
[27] Hur J, Cho J. Prediction of BOD, COD, and total nitrogen concentrations in a typical urban river using a fluorescence excitation- emission matrix with PARAFAC and UV absorption indices [J]. Sensors, 2012,12:972-986.
[28] 王福利,郭卫东.秋季南海珠江口和北部湾溶解有机物的光降解[J]. 环境科学学报, 2010,30(3):606-613. Wang F L, Guo W D. Photodegradation of DOM in the Pearl River Estuary and the Beibu Gulf of the South China Sea in Autumn [J]. Acta Scientiae Circumstantiae, 2010,30(3):606-613.
[29] Hudson N, Baker A, Reynolds D. Fluorescence analysis of dissolved organic matter in natural, waste and polluted waters - a review [J]. River research and applications, 2007,23(6):631-649.
[30] Ishii S K L, Boyer T H. Behavior of Reoccurring PARAFAC Components in Fluorescent Dissolved Organic Matter in Natural and Engineered Systems: A Critical Review [J]. Environmental Science & Technology, 2012,46:2006-2017.
[31] 薛银刚,刘 菲,孙 萌,等.太湖竺山湾春季浮游细菌群落结构及影响因素[J].环境科学, 2018,39(3):1151-1158. Xue Y G, Liu F, Sun M, et al. Community Structure and Influencing Factors of Bacterioplankton in Spring in Zhushan Bay, Lake Taihu [J]. Environmental Science, 2018,39(3):1151-1158.
[32] Amato K R, Yeoman C J, Kent A, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes [J]. The ISME Journal, 2013,7(7):1344-1353.
[33] Sun F L, Wang Y S, Wu M L. Spatial heterogeneity of bacterial community structure in the sediments of the Pearl River estuary [J]. Biologia, 2011,66(4):574-584.
[34] Kirchman D L, Dittel A I, Findlay S E G, et al. Changes in bacterial activity and community structure in response to dissolved organic matter in the Hudson River, New York [J]. Aquatic Microbial Ecology, 2004,35:243-257.
[35] Kolmakova O V, Gladyshev M I, Rozanov A S, et al. Spatial biodiversity of bacteria along the largest Arctic river determined by next-generation sequencing [J]. Fems microbiology ecology, 2014,89: 442-450.
[36] Xia N, Xia X, Liu T, et al. Characteristics of bacterial community in the water and surface sediment of the Yellow River, China, the largest turbid river in the world [J]. Journal of Soils and Sediments, 2014, 14(11):1894-1904.
[37] 唐 婧,徐小蓉,商传禹,等.南明河城区河段细菌多样性与环境因子的关系[J].微生物学报, 2015,55(8):1050-1059. Tang Q, Xu X R, Shang C Y, et al. Association of bacterial diversity in city area of Nanming river with environmental factors [J]. Acta Microbiologica Sinica, 2015,55(8):1050-1059.
[38] 王 鹏,陈 波,李传琼,等.赣江南昌段丰水期细菌群落特征[J].中国环境科学, 2016,36(8):2453-2462. Wang P, Chen B, Li C Q, et al. Bacterial communities in Nanchang section of the Ganjiang River in wet season [J]. China Environmental Science, 2016,36(8):2453-2462.
[39] Read D S, Gweon H S, Bowes M J, et al. Catchment-scale biogeography of riverine bacterioplankton [J]. The ISME Journal, 2015,9(2):516-526.
[40] 刘君政,王 鹏,肖汉玉,等.城市河流细菌群落特征及影响因素--以鄱阳湖流域赣江南昌段为例[J].湖泊科学, 2018,30(3):741-752.Liu J Z, Wang P, Xiao H Y, et al. Characteristics of aquatic bacterial community and the influencing factors in an urban river——A case study of Nanchang section of the Ganjiang River, Lake Poyang Basin [J]. Journal of Lake Sciences, 2018,30(3):741-752.
[41] Jeon E M, Kim H J, Jung K, et al. Impact of Asian dust events on airborne bacterial community assessed by molecular analyses [J]. Atmospheric Environment, 2011,45(25):4313-4321.
[42] Teira E, HernándezRuiz M, Barberlluch E, et al. Bacterioplankton responses to riverine and atmospheric inputs in a coastal upwelling system (Ría de Vigo, NW Spain) [J]. Marine Ecology Progress, 2016: 542.
[43] Vannote R L, Minshall G W, Cummins K W, et al. The river continuum concept [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980,37(1):130-137.
[44] Liu Z, Huang S, Sun G, et al. Phylogenetic diversity,composition and distribution of bacterioplankton community in the Dongjiang River,China [J]. FEMS Microbiology Ecology, 2012,80(1):30-44.
[45] Stefano F, Eusebi V, Casamayor E O, et al. Stream Hydrological Fragmentation Drives Bacterioplankton Community Composition [J]. PloS one, 2013,8(5):64109.
[46] Gao XQ, Olapade OA, Leff LG. Comparison of benthic bacterial community composition in nine streams [J]. Aquatic Microbial Ecology, 2005,40:51-60.
[47] 丁 珵,常玉梅,杨 琦,等.我国东北典型河流冰封期细菌多样性的研究--以松花江为例[J]. 环境科学学报, 2012,32(6):1415-1423. Ding C, Chang Y M, Yang Q, et al. Bacterial biodiversity in the river in Northeast China during the freezing seasons: A case in Songhua River [J]. Acta Scientiae Circumstantiae, 32(6):1415-1423.
[48] 孙玉平,于恒国,周 钦,等.典型富营养化城市河流--浙江温瑞塘河的浮游植物群落类型与季节变化[J]. 湖泊科学, 2018,30(2): 375-384. Sun Y P, Yu H G, Zhou Q, et al. Seasonal variation of phytoplankton communities in Wenruitang River-A typical eutrophic urban river, Zhejiang Province [J]. Journal of Lake Sciences, 2018,30(2):375-384.
[49] Hu Y, Bai C R, Cai J, et al. Co-occurrence Network Reveals the Higher Fragmentation of the Bacterial Community in Kaidu River Than Its Tributaries in Northwestern China [J]. Microbes and Environments, 2018,33(2):127-134.
[50] Wang X, Gu J, Gao H, et al. Abundances of Clinically Relevant Antibiotic Resistance Genes and Bacterial Community Diversity in the Weihe River, China [J]. International Journal of Environmental Research & Public Health, 2018,15(4):708.
[51] Staley C, Gould T J, Wang P, et al. Species sorting and seasonal dynamics primarily shape bacterial communities in the Upper Mississippi River [J]. Science of the Total Environment, 2015,505: 435-445
[52] Savio D, Sinclair L, Ijaz U Z, et al. Bacterial diversity along a 2600km river continuum [J]. Environmental Microbiology, 2015,17(12):4994- 5007.
[53] Valter D O L F, Margis R, Mark I A. The Source of the River as a Nursery for Microbial Diversity [J]. PLoS ONE, 2015,10(3):e120608.
[54] Ruiz-González C, Proia L, Ferrera I, et al. Effects of large river dam regulation on bacterioplankton community structure [J]. Fems Microbiology Ecology, 2013,84(2):316-331.
[55] Fortunato C S, Crump B C. Bacterioplankton community variation across river to ocean environmental gradients [J]. Microbial Ecology, 2011,62:374-382.
[56] Cottrell M T, Kirchman D L. Natural assemblages of marine proteobacteria and members of the Cytophaga - Flavobacter cluster consuming low- and high-molecular weight dissolved organic matter [J]. Applied and Environmental Microbiology, 2000,66:1692-1697.
Fluorescence spectroscopic characteristics of DOM and its effects on bacterial composition in Bahe River basin.
YUAN Bo, WU Wei, GUO Meng-jing, ZHENG Xing, ZHOU Xiao-de*
(State Key Laboratory of Eco-hydraulics in Northwest Arid Region, Xi'an University of Technology, Xi'an 710048, China)., 2019,39(8):3383~3395
In order to explore the effects of dissolved organic matter (DOM) composition and source on bacterial community structure and diversity, and the role of bacterial community structure in controlling DOM composition and degradation, the fluorescence components and spatial distribution of DOM in Bahe River during dry season (December) were examined using three-dimensional fluorescence spectroscopy combined with parallel factor analysis (EEM-PARAFAC). The results showed that the DOM fluorescent components of Bahe River were divided into five components by PARAFAC, including three humus components (C1:240,320/400nm; C2:260~295/478~504nm; C5:240/480nm) and two protein components (C3:240,272~284/350~360nm; C4:255~275/326~336nm). A relatively strong correlation was observed among the five components, respectively. It was shown that these two types of fluorescent components had similar source properties. Proteobacteria (54.22%), Bacteroidetes (19.40%), Firmicutes (12.28%), Cyanobacteria (6.46%) and Actinobacteria (3.13%) were the dominant phylum in Bahe River. The nutrient concentration, water temperature, electrical conductivity and pH of river water had effects on the bacterial community. The correlation between fluorescent components (humic-like and proteinic-like) of DOM and the bacterioplankton community was significant along the longitudinal gradient of the river. Different bacterial communities may have different responses to the quality and instability of DOM, which can provide information on the effects of biogeochemical processes of rivers on the composition and function of the microbial population.
dissolved organic matter;bacterial community structure;high throughput sequencing;environmental factors
X172
A
1000-6923(2019)08-3383-13
袁 博(1986-),男,陕西洛南人,西安理工大学博士生,主要研究方向为水工程生态环境效应与生物地球化学循环.
2019-01-11
国家自然科学基金资助项目(91747206,41807156);陕西省教育厅重点实验室资助项目(18JS073)
* 责任作者, 教授, zhouxd@mail.xaut.edu.cn
