基于PMS的Cr(VI)-染料复合废水协同处理效果及机理
2019-08-28张成武李天一秦传玉
闫 松,张成武,李天一,秦传玉*
基于PMS的Cr(VI)-染料复合废水协同处理效果及机理
闫 松1,2,张成武1,2,李天一1,2,秦传玉1,2*
(1.吉林大学地下水资源与环境教育部重点实验室,吉林 长春 130012;2.吉林大学新能源与环境学院,吉林 长春 130012)
通过投加过一硫酸盐(PMS)探讨其协同处理偶氮染料金橙II(AO7)及Cr(VI)的可行性、影响因素及机理.结果表明,体系可以在有效去除AO7的同时降低Cr(VI)浓度,120min时降解率分别达到97.9%及22.1%;随着初始pH值降低AO7降解及Cr(VI)去除效率逐渐升高;AO7的降解主要是由于Cl-与PMS反应产生的氧化性物质HClO以及PMS投加创造的酸性条件使得Cr(VI)具有强氧化性的共同作用,其中起主导作用的是HClO;Cr(VI)的转化是由于自身与AO7发生氧化还原反应导致.本研究可以为复合污染废水的处理提供理论依据.
染料废水;复合污染;过一硫酸盐;Cr(VI);协同处理
印染废水成分复杂,不仅含有大量难降解的偶氮染料,还有以氯化钠为主的无机盐[1]以及滚筒剥铬产生的含铬物质,是典型的含盐含铬有机废水.对于Cr(VI)或染料废水的单独处理技术已经相对成熟,而对于Cr(VI)-染料复合污染的协同处理研究报道较少,相对于生物法[2-4]及物理吸附法[5-6]耗时长、处理效果差等缺点,化学法展现出了见效快且效果好等优点;有学者利用零价铁还原Cr(VI)同时零价铁与氧气反应在有配体存在下生成高活性自由基降解染料,但该方法成本较高且容易生成大量铁泥[7-8];利用光催化二氧化钛也可以同时降解染料及Cr(VI)[9-10],但Cl-会竞争TiO2表面的活性吸附位点从而影响光催化氧化,且会改变TiO2的空间结构使TiO2失活[11-13].因此寻找一种低成本且在Cl-存在下仍可以有效处理Cr(VI)-染料复合污染的方法具有重要意义.
近年来有文献报道Cl-可以活化过一硫酸盐(PMS)产生活性物质降解污染物[14-16];同时过渡金属离子如Fe2+、Co2+、Mn2+、Ce3+等[17-18]可以活化PMS产生硫酸根自由基(SO4·—),Cr(VI)作为一种过渡金属已被报道可以活化H2O2产生羟基自由基(×OH)[19],而PMS与H2O2具有相似的结构且氧化还原电位相近(分别为+1.82V(PMS)和+1.77V (H2O2))[20],因此考虑Cr(VI)是否具有活化PMS降解污染物的潜力,从而通过在含盐含铬染料废水中添加PMS达到同时去除染料和Cr(VI)的目的.
本文通过添加氯化钠、重铬酸钾、代表性偶氮染料AO7来模拟含盐含铬染料废水,加入PMS研究该体系协同处理偶氮染料AO7及Cr(VI)的可行性、影响因素及反应机理.
1 实验部分
1.1 实验试剂
过硫酸氢钾(KHSO5×0.5KHSO4×0.5K2SO4),金橙II(上海阿拉丁生化科技股份有限公司);重铬酸钾(99.8%,天津市光复科技发展有限公司);氯化钠,氢氧化钠,硫酸,磷酸(分析纯,北京化工厂);二苯碳酰二肼(分析纯,国药集团化学试剂有限公司);叔丁醇,硫酸铵(化学纯,国药集团化学试剂有限公司);乙醇(分析纯,天津天泰精细化学品有限公司);甲醇(分析纯,西陇科学股份有限公司).
1.2 实验仪器
HZK-210电子天平(福州华志科学仪器有限公司), YSI pH100pH计(美国黄泉仪器有限公司), HJ- 6A数显恒温磁力搅拌器(金坛市医疗仪器厂), EVOLUTION 201紫外分光光度计(Thermo Fisher Scientific - Shanghai), SPECTRONIC 200E可见分光光度计(Thermo Fisher Scientific - Shanghai), Thermo TSQ三重串联四级杆质谱仪.
1.3 实验方法
所有实验通过使用250mL锥形瓶在室温(25±2)℃下进行;向特定浓度的AO7水溶液中依次加入一定量的重铬酸钾及氯化钠,置于磁力搅拌器上搅拌,转速控制在500r/min左右;加入所需量的PMS进行反应,在反应期间不控制pH值;在特定的时间间隔取出样品并立即分析.每组实验重复三次,最终结果取平均值.
1.4 分析方法
Cr(VI)浓度测定采用二苯碳酰二肼分光光度法[21]; AO7浓度测定采用直接分光光度法,于484nm处有特征吸收峰;AO7中间产物采用LC-MS测定,采取手动进样,洗脱液为乙腈,流速为0.2mL/min,采用负离子扫描模式在/为40~200范围内获得MS光谱.应用Excel2010、OriginPro8.0进行数据分析处理与作图.
2 结果及分析
2.1 不同组分体系降解AO7效果
对比不同组分体系中AO7的降解率及Cr(VI)的去除率,结果如图1所示.PMS单独降解AO7在120min内效率仅为3.2%,几乎不降解;PMS/Cr(VI)、PMS/Cl-以及PMS/Cr(VI)/Cl-体系均可以降解AO7, 120min时降解率分别达到58.8%、88.9%及97.9%;反应结束后Cr(VI)转化为毒性更低的Cr(III),PMS/ Cr(VI)及PMS/Cr(VI)/Cl-体系Cr(VI)去除率可分别达到35.9%及22.1%.
由上述结果可知,PMS与Cl-反应可以有效降解AO7,Cr(VI)同时存在可以提高AO7的降解效率,且Cr(VI)自身可以达到一定程度的去除.
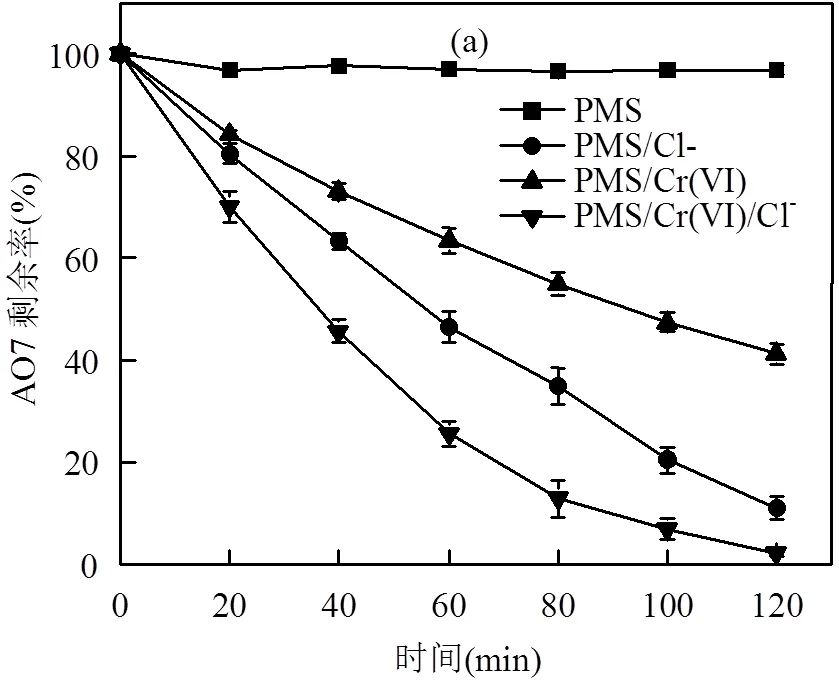
PMS=7.83mM, Cl-=14mM,Cr(VI)=0.38mM, AO7=0.3mM, pH0=2.5
2.2 PMS/Cl-体系降解AO7
2.2.1 Cl-浓度对体系降解的影响 分别选取浓度为5.6,14,28mmol/L 的Cl-进行实验,结果如图2所示.随着Cl-浓度增加,AO7降解效率逐渐升高,120min时AO7降解率分别达到56.5%、88.9%及99.1%;虽然28mmol/L的Cl-体系降解效率较高,但其在60min已接近反应完全,不方便后续研究,因此选取14mmol/L作为实验Cl-浓度进行后续研究.
2.2.2 初始pH值对体系降解的影响 有文献报道碱可以直接活化PMS产生活性物质降解污染物[22],为避免碱性条件干扰体系降解AO7的实验结果,仅探究酸性条件下初始pH值的变化对于体系降解AO7的影响,结果如图3所示.初始pH值在4.5及6.5的条件下AO7的降解率仍能达到97.9%,因此酸性条件下PMS/Cl-体系对AO7的降解效率基本不受初始pH值的影响.

图2 不同Cl-浓度对AO7降解的影响
PMS=7.83mmol/L, AO7=0.3mmol/L,pH0=2.5

图3 不同初始pH值对AO7降解的影响
PMS=7.83mmol/L, Cl-=14mmol/L, AO7=0.3mmol/L
2.2.3 HClO掩蔽剂对体系降解的影响 Wang等[23]考察Cl-对Co2+/PMS体系降解AO7的研究中发现较高浓度的Cl-可以活化PMS生成活性氯与AO7反应,且有研究表明NH4+不能被SO4·—和×OH 氧化,但是可以与HClO发生反应生成活性较低的NH2Cl、NHCl2和NCl3[24-26],因此选用硫酸铵作为HClO掩蔽剂进行掩蔽实验,结果如图4所示.不添加掩蔽剂时体系降解效率为88.9%;添加15mmol/L硫酸铵后体系降解效率降低至43.5%;添加150mmol/L硫酸铵后体系降解效率降低至3.4%,与PMS单独降解效率相近.因此说明该体系中AO7的降解是HClO的作用.

图4 不同HClO掩蔽剂浓度对AO7降解的影响
PMS=7.83mmol/L, Cl-=14mmol/L, AO7=0.3mmol/L, pH0=2.5
2.3 PMS/Cr(VI)体系降解AO7
2.3.1 初始pH值对体系降解的影响 当PMS溶于水时显酸性,pH值可以达到3以下,为考察酸性条件在体系降解AO7中的作用,将PMS/Cr(VI)体系与酸性条件下单独Cr(VI)降解AO7进行对比,并调节不同初始pH值探究其对体系降解效果的影响,结果如图5所示.初始pH值为2.5时Cr(VI)可以单独降解AO7,降解效率与PMS/Cr(VI)体系降解效率相近,说明PMS/Cr(VI)体系降解AO7是由于PMS溶于水创造的酸性条件使得Cr(VI)具有强氧化性进而直接氧化AO7;随着pH值的升高AO7的降解率逐渐降低,pH值为4.5时AO7几乎不降解,表明PMS/Cr(VI)降解AO7的反应仅在3以下时效果较好.
2.3.2 自由基掩蔽剂对体系降解的影响 为验证Cr(VI)是否能够活化PMS产生活性自由基,使用叔丁醇作为×OH掩蔽剂,乙醇作为×OH及SO4·—的共同掩蔽剂进行掩蔽实验,结果如图6所示.2种掩蔽剂对于体系降解均无明显影响,说明Cr(VI)并不能活化PMS产生活性自由基,结合2.3.2实验结果可以说明AO7的降解是酸性条件下Cr(VI)的强氧化性导致的.
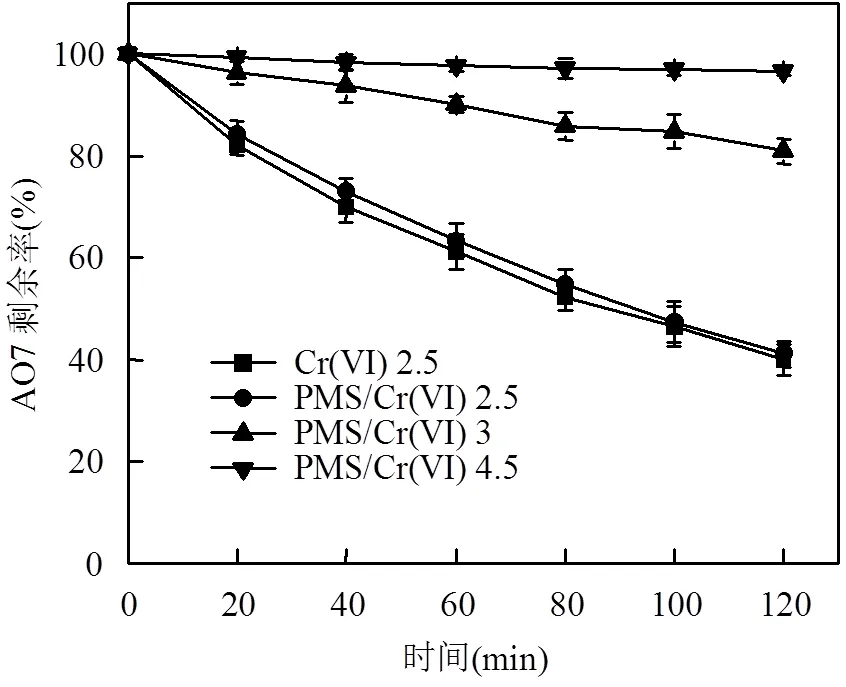
图5 不同初始pH值对AO7降解的影响
PMS=7.83mM, Cr(VI)=0.38mM, AO7=0.3mM
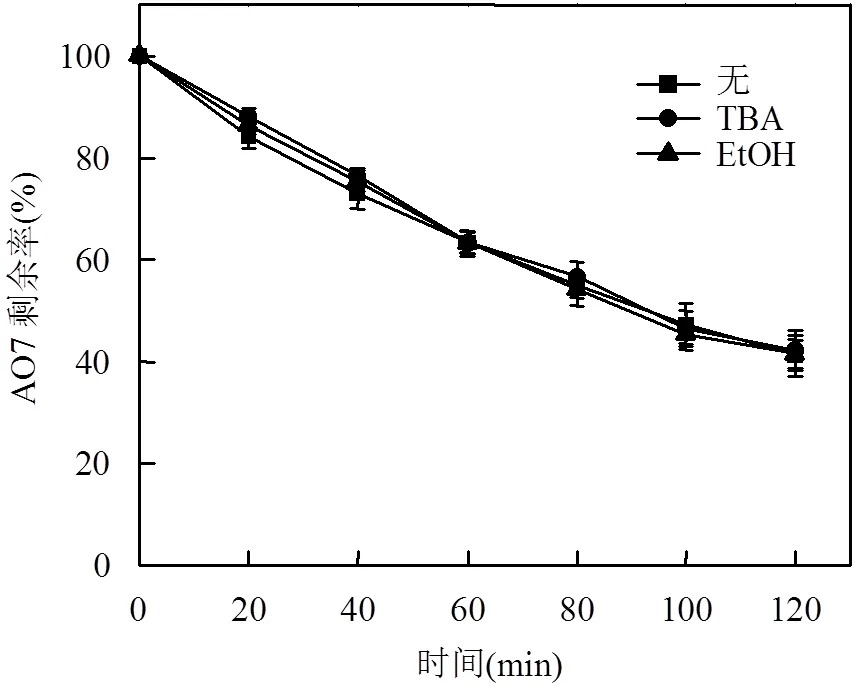
图6 不同自由基掩蔽剂对AO7降解的影响
PMS=7.83mM, Cr(VI)=0.38mM, AO7=0.3mM, pH0=2.5
2.4 基于PMS的Cr(VI) -AO7协同处理机理
徐蕾[27]等人研究发现,在常温条件下Cl-可以与PMS发生非自由基反应生成活性氯,其反应方程如下:
2Cl-+ HSO5-+ H+= SO42-+ Cl2+ H2O (1)
Cl2+ H2O = HClO + H++ Cl-(2)
Cl-+ HSO5-= SO42-+ HclO (3)
本研究中2.2.3实验结果验证了这一机理,同时2.3实验结果表明,Cr(VI)不能活化PMS产生活性自由基,而是由于PMS/Cl-体系创造的酸性条件使得Cr(VI)具有强氧化性,在氧化AO7的同时实现自身向低毒性Cr(III)的转化.
由于在PMS/Cr(VI)/Cl-体系中Cr(VI)与活性物质HClO均能降解AO7,因此可以通过计算两部分对AO7降解的贡献占比来确定体系中起主要作用的活性物质.计算过程如下:通过PMS/ Cr(VI)体系中AO7降解及Cr(VI)去除量计算得出单位浓度Cr(VI)消耗对应的AO7降解量,再通过PMS/Cr(VI)/Cl-体系中Cr(VI)的消耗量计算得出对应的AO7降解量,AO7的降解总量除去因Cr(VI)氧化降解的量剩余为HClO氧化降解的量;计算结果如下:PMS/ Cr(VI)/Cl-体系降解AO7的反应中,HClO氧化降解的部分占70.8%,Cr(VI)氧化降解的部分占29.2%.
综上所述,PMS/Cr(VI)/Cl-体系中AO7的降解是由于Cl-与PMS反应产生氧化性物质HClO以及PMS投加创造的酸性条件使得Cr(VI)具有强氧化性的共同作用,其中起主导作用的是HClO;Cr(VI)的转化是由自身与AO7发生氧化还原反应导致的.
2.5 中间产物、TOC测定及降解途径分析
为探究PMS/Cr(VI)/Cl-体系降解AO7的途径进行中间产物的测定,测定结果见表1,根据测定结果推测的AO7降解途径见图7.
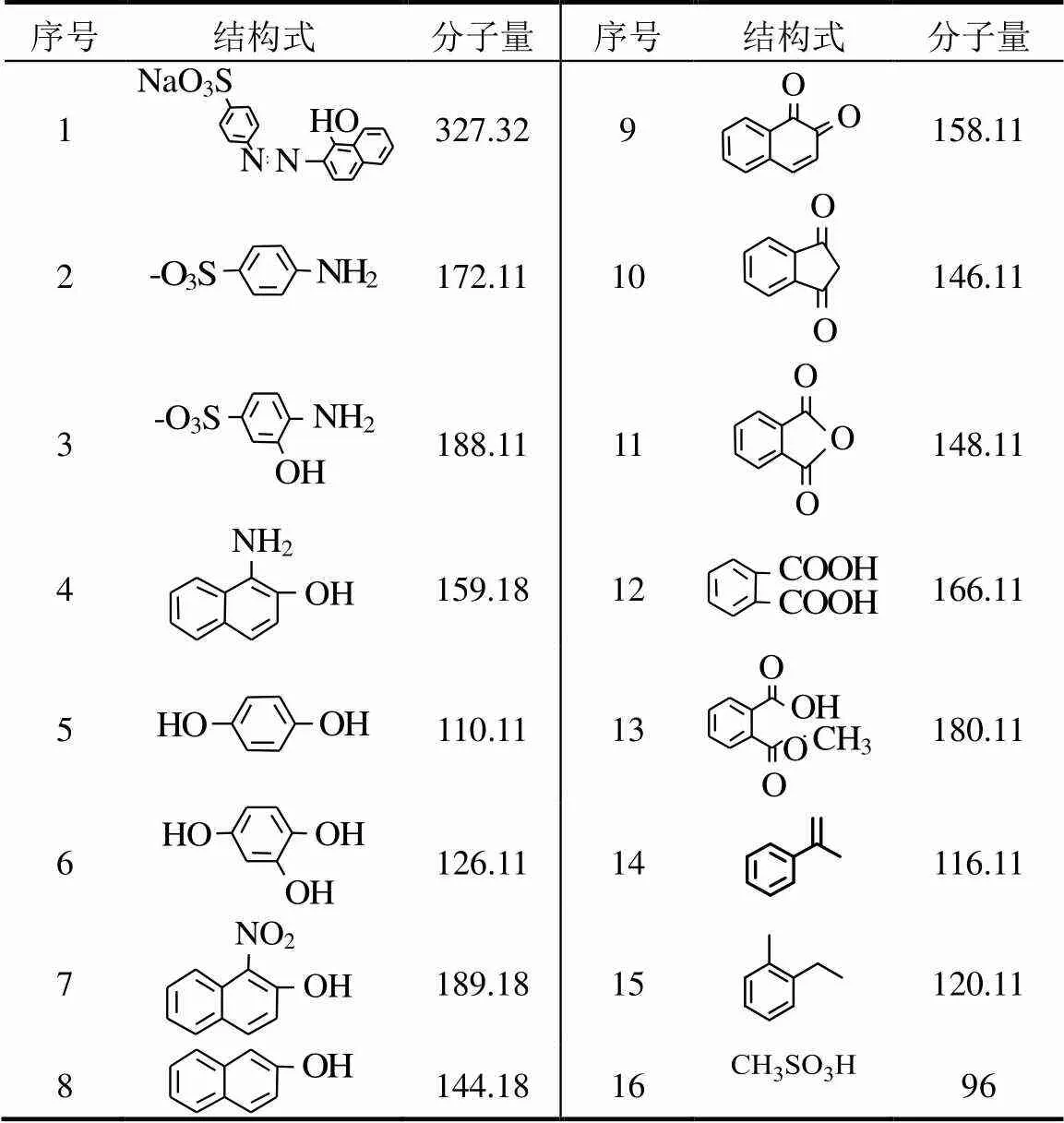
表1 中间产物测定结果
如图7所示,反应中AO7的-N=N-优先被打开从而使染料脱色,AO7被分解为对氨基苯磺酸钠及1-氨基-2-萘酚;随后对氨基苯磺酸钠可以被氧化成对苯酚及1,2,4苯三酚,同时磺基脱下形成甲基磺酸;1-氨基-2-萘酚可以被氧化形成1-硝基-2-萘酚及2-萘酚,随后萘环被破坏生成多种苯系物;沿着对氨基苯磺酸钠及1-氨基-2-萘酚2条路径氧化最终均生成苯系物,且苯环无法进一步被打开.
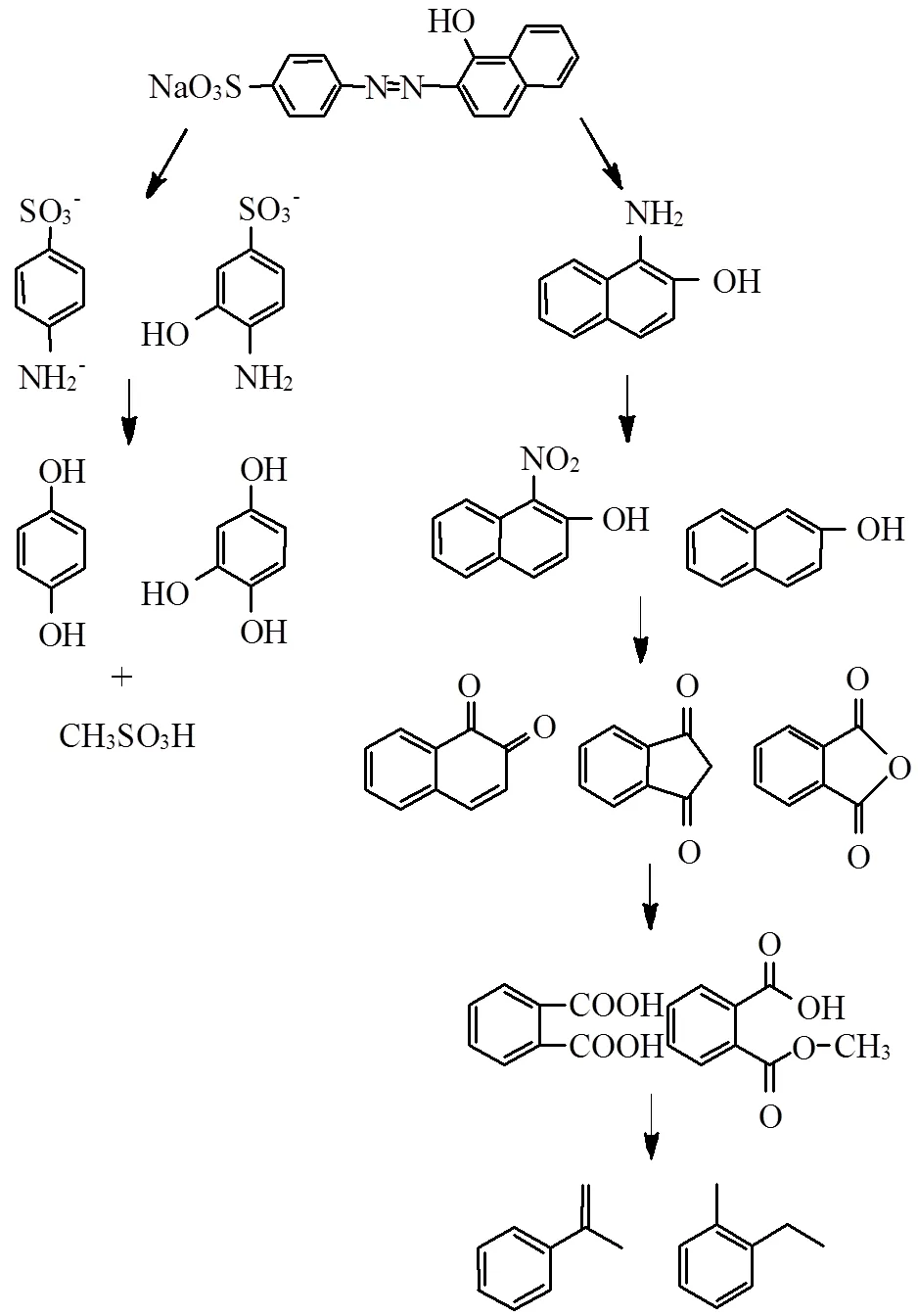
图7 AO7可能的降解途径
为探究体系降解AO7的矿化程度在反应前后进行TOC测定,测定结果反应前后TOC无明显变化,说明体系降解AO7无法达到矿化,与中间产物测定结果相同.
3 结论
3.1 单独PMS在120min内对AO7基本无降解,PMS/Cr(VI)、PMS/Cl-以及PMS/Cr(VI)/Cl-体系均可以有效降解AO7,120min时降解率分别达到58.8%、88.9%及97.9%;PMS/Cr(VI)以及PMS/Cr (VI)/Cl-体系中Cr(VI)去除率分别可达到35.9%及22.1%.
3.2 初始pH值对PMS/Cl-体系降解AO7无明显影响.PMS/Cr体系在降解AO7的同时Cr(VI)自身可以转化为Cr(III);随着pH值降低AO7及Cr(VI)去除率逐渐升高,pH值在3以下反应效果较好.
3.3 PMS/Cr(VI)/Cl-体系中AO7的降解主要是强氧化性物质HClO以及Cr(VI)的共同作用,其中起主导作用的是HClO;Cr(VI)的转化是由自身与AO7发生氧化还原反应导致的.
3.4 反应过程中AO7的-N=N-键首先被破坏从而使染料脱色,且随着反应进行萘环可以被破坏但苯环无法被进一步打开,体系反应前后TOC值不变,不能达到矿化.
[1] 郭建博.高盐染料废水的生物降解及介提强化作用研究 [D]. 大连:大连理工大学, 2005. Guo JB. Biodegradation of hyper-salinity dye wastewaters and the accelerating effect of redox mediators [D]. Dalian: Dalian University of Technology, 2005.
[2] 张禄艳,王 竞,吕 红,等.高盐条件下染料酸性橙7的生物降解特性 [J]. 中国环境科学, 2009,29(6):640-645. Zhang LY, Wang J, Lv H, et al. Biodegradation characteristics of Acid Orange 7under hypersaline conditions [J]. China Environmental Science, 2009,29(6):640-645.
[3] Liu W, Liu C, Liu L, et al. Simultaneous decolorization of sulfonated azo dyes and reduction of hexavalent chromium under high salt condition by a newly isolated salt-tolerant strain Bacillus circulans BWL1061 [J]. Ecotoxicology and Environmental Safety, 2017,141: 9-16.
[4] Hussain S, Quinn L, Li J, et al. Simultaneous removal of malachite green and hexavalent chromium by Cunninghamella elegans biofilm in a semi-continuous system [J]. International Biodeterioration & Biodegradation, 2017,125:142-149.
[5] Anwar F, Hussain S, Ramzan S, et al. Characterization of Reactive Red-120Decolorizing Bacterial Strain Acinetobacter junii FA10Capable of Simultaneous Removal of Azo Dyes and Hexavalent Chromium [J]. Water, Air, & Soil Pollution, 2014,225:1-16.
[6] 方 伟.改性石墨烯/聚吡咯复合材料对水中Cr(VI)及刚果红的吸附研究 [D]. 广州:华南理工大学, 2018. Fang W. Research on Adsorption of hexavalent chromium and CongoRed in aqueous solutions onto modified graphene/pyrrole composite materials [D]. Guangzhou: South China University of Technology, 2018.
[7] Kyzas G Z, Lazaridis N K, Kostoglou M. On the simultaneous adsorption of a reactive dye and hexavalent chromium from aqueous solutions onto grafted chitosan [J]. Journal of Colloid And Interface Science, 2013,407:432-441.
[8] Fu F, Han W, Tang B, et al. Insights into environmental remediation of heavy metal and organic pollutants: Simultaneous removal of hexavalent chromium and dye from wastewater by zero-valent iron with ligand-enhanced reactivity [J]. Chemical Engineering Journal, 2013,232:534-540.
[9] Kim S A, Kamala-Kannan S, Oh S, et al. Simultaneous removal of chromium(VI) and Reactive Black 5using zeolite supported nano- scale zero-valent iron composite [J]. Environmental Earth Sciences, 2016,75:1-8.
[10] Xie W, Zhang M, Liu D, et al. Photocatalytic TiO2/porous BNNSs composites for simultaneous LR2B and Cr (VI) removal in wool dyeing bath [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2017,333:165-173.
[11] Djellabi R, Ghorab M, Sehili T. Simultaneous Removal of Methylene Blue and Hexavalent Chromium From Water Using TiO2/Fe(III)/ H2O2/Sunlight [J]. CLEAN-SOIL AIR WATER, 2017:45.
[12] Suzuko Y, Atsushi Y, Hiroyuki A. Photocatalytic degradation of chloroform in the gas phase on the porous TiO2pellets: effect of Cl-accumulated on the catalyst surface [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2005,169(2):191-196.
[13] Cardoso J C, Lizier T M, Zanoni M V B. Highly ordered TiO2nanotube arrays and photoelectrocatalytic oxidation of aromatic amine [J]. Applied Catalysis B: Environmental, 2010,99(1/2):96-102.
[14] Vogtenhuber D, Podloucky R, Redinger J. Ab initio study of atomic Cl-dsorption on stoichiometric and reduced rutile TiO2(110) surfaces [J]. Surface Science, 2000,(454-456):369-373.
[15] 古振川,高乃云,安娜,等.Cl-/PMS体系降解甲氧苄啶的效能与机理 [J]. 中国环境科学, 2018,38(3):977-984. Gu Z C, Gao N Y, An N, et al. Efficiency and mechanism of trimethoprim degradation in Cl-/PMS system [J]. China Environmental Science, 2018,38(3):977-984.
[16] 张 珂,许 芬,陈家斌,等.丙酮/氯离子协同活化过一硫酸盐降解酸性橙 [J]. 中国环境科学, 2018,38(11):4159-4165. Zhang K, Xu F, Chen JB, et al. Acetone and chloride ion synergistically activate peroxymonosulfate to decolorize acid orange [J]. China Environmental Science, 2018,38(11):4159-4165.
[17] 谈超群,董雨婕,钟毅杰,等.新型氯离子活化过氧单硫酸盐的非自由基系统去除水中扑热息痛的研究 [J]. 四川大学学报(自然科学版), 2018,55(4):819-826. Tan C Q, Dong Y J, Zhong Y J, et al. Acetaminophen degradation with non-radical based reactive oxidants generated by chloride activated peroxymonosulfate system [J]. Journal of Sichuan University (Natural Science Edition), 2018,55(4):819-826.
[18] Liang C J, Bruell C J, Marley M C, et al. Persulfate oxidation for in situ remediation of TCE. I Activated by ferrous ion with and without a persulfate-thiosulfate redox couple [J]. Chemosphere, 2004,55(9): 1213-1223.
[19] Anipsitakis G P, Dionysiou D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt [J]. Environmental Science and Technology, 2003,37(20):4790-4797.
[20] Asadi A, Dehghani MH, Rastkari N, et al. Comparison of potentiality of Zinc oxide nanoparticles and hydrogen peroxide in removal of hexavalent chromium from polluted water [J]. Journal of Birjand University of Medical Sciences, 2012,19:277-285.
[21] GB/7467-87 水质六价铬的测定二苯碳酰二肼分光光度法 [S]. GB/7467-87 Water quality-Determination of chromium(VI) - 1,5diphenylcarbohydrazide spectrophotometric method [S].
[22] Betterton E A, Hoffmann M R. Kinetics and mechanism of the oxidation of aqueous hydrogen sulfide by peroxymonosulfate [J]. Environmental Science and Technology, 1990,24(12):1819-1824.
[23] 葛勇建,蔡显威,林 翰,等.碱活化过一硫酸盐降解水中环丙沙星 [J]. 环境科学, 2017,38(12):5116-5123. Ge Y J, Cai X W, Lin H, et al. Base activation of peroxymonosulfate for the degradation of ciprofloxacin in water [J]. Environmental Science, 2017,38(12):5116-5123.
[24] Wang Z H, Yuan R X, Guo Y G, et al. Effects of chloride ions on bleaching of azo dyes by Co2+/oxone regent: Kinetic analysis [J]. Journal of Hazardous Materials, 2011,190(1–3):1083-1087.
[25] Deborde M, Gunten U V. Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms: A critical review [J]. Water Research, 2008,42(1/2):13-51.
[26] Yang S Y, Wang P, Yang X, et al. Degradation efficiencies of azo dye Acid Orange 7by the interaction of heat,UV and anions with common oxidants: Persulfate, peroxymonosulfate and hydrogen peroxide [J]. Journal of Hazardous Materials, 2010,179:552-558.
[27]徐 蕾,袁瑞霞,郭耀广,等.氯离子对钴/单过氧硫酸盐体系降解2,4,6-三氯苯酚的影响 [J]. 武汉大学学报理学版, 2013,59(1):51- 56. Xu L, Yuan R X, Guo Y G, et al. Effects of chloride ions on degradation of 2,4,6-trichlorophenol by Co(II)/peroxymonosulfate (Co/PMS) system [J]. Journal of Wuhan University (Natural Science Edition), 2013,59(1):51-56.
Synergistic treatment effect and mechanism of Cr(VI)-dye complex wastewater based on PMS.
YAN Song1,2, ZHANG Cheng-wu1,2, LI Tian-yi1,2, QIN Chuan-yu1,2*
(1.Key Laboratory of Groundwater Resources and Environment, Ministry of Education, Jilin University, Changchun 130012, China;2.College of New Energy and Environment, Jilin University, Changchun 130012, China)., 2019,39(8):3271~3276
This article investigated the feasibility, influencing factors and mechanism of the synergistic treatment of azo dyes II (AO7) and Cr (VI) by adding persulfate (PMS). The results showed that the system could reduce the Cr (VI) and remove AO7 simultaneously and the degradation rate reached 97.9% and 22.1% at 120 minutes, respectively. AO7 degradation and Cr (VI) removal efficiency increased gradually with the decrease of initial pH. The degradation of AO7 was mainly because of the combined functions of the oxidizing substance HClO produced when Cl-reacts with PMS and the strong oxidizer Cr (VI) in acidic condition created by PMS. Among these two functions, HClO played the dominant role. In addition, the conversion of Cr (VI) was caused by the redox reaction between itself and AO7. Thus, this research could provide a theoretical basis for the treatment of compound polluted wastewater.
dye wastewater;compound pollution;persulfate;Cr(VI);synergistic treatment
X703
A
1000-6923(2019)08-3271-06
闫 松(1995-),女,内蒙古兴安盟乌兰浩特人,吉林大学新能源与环境学院环境工程专业工程学士,主要从事水土污染控制与修复方面的研究.发表论文1篇.
2019-02-25
国家自然科学基金资助项目(41572213,41530636)
* 责任作者, 副教授, qincyu@jlu.edu.cn
