寡养单胞菌对S2-氧化特性及主要代谢途径
2019-08-28徐瑶瑶路金霞岳正波刘晓玲
徐瑶瑶,宋 晨,路金霞,王 进,岳正波,刘晓玲*
寡养单胞菌对S2-氧化特性及主要代谢途径
徐瑶瑶1,2,宋 晨3,4,路金霞1,王 进2,岳正波2,刘晓玲1*
(1.中国环境科学研究院,北京 100012;2.合肥工业大学资源与环境工程学院,安徽 合肥 230009;3.南京瑞迪建设科技有限公司,江苏 南京 210029;4.南京水利科学研究院,江苏 南京 225600)
以无机硫(S2)-为目标污染物,从北京东沙河黑臭水体筛选出一株能够高效氧化S2-的土著硫氧化菌,并对其进行16S rRNA测序及生理生化特性鉴定,结果表明,该菌株属于寡养单胞菌属(),命名为sp.sp3.菌株sp3在温度25℃,初始pH值7.0,初始葡萄糖浓度0.25%,初始菌浓度1.00g/L时,菌株sp3对S2-的氧化率最高.在此适宜条件下,反应60h后,菌株sp3对S2-的最高氧化率达到86.6%.S2-的浓度在整个氧化过程中持续下降后保持稳定,在此过程中产生了S0,S2O32-,SO32-以及SO42-这4种其它存在形态的硫.随着S2-被氧化,SO42-的浓度呈缓慢上升的趋势.利用高通量测序技术推测菌株sp3主要是通过副球菌硫氧化途径(PSO)将非稳定态的S2-逐步转化为稳定态的SO42-.在此代谢途径中,一部分S2-被氧化为S0,另一部分S2-则直接氧化为SO32-;S0与SO32-可自发反应生成S2O32-,而S2O32-发生歧化反应再释放出SO32-和S0;反应生成的部分SO32-继续直接氧化为SO42-.菌株sp3在黑臭水体的水质净化过程中有一定的应用前景.
S2-;筛选;硫氧化特性;代谢途径
近年来工业化、城市化的快速发展造成了严重的水环境污染,城市建成区及周边许多河流出现了常年性或者季节性的黑臭现象,已成为中国日益突出的环境问题之一.国务院颁布的《水污染防治行动计划》[1]对黑臭水体提出了分阶段治理目标,要求到2020年,地级及以上城市建成区黑臭水体均控制在10%以内.据统计,截至2018年5月,全国排查确认黑臭水体2100个,其中36个重点城市黑臭水体总数为897个,整治完成率平均为70%[2].加快城市黑臭水体治理已成为我国当前解决突出环境问题的主要任务之一.
水体黑臭现象成因复杂,涉及物理、化学和生物等诸多过程,影响因素较多.已有研究表明,上覆水中的S2-是导致水体变黑的关键因素,它与水体中Fe2+、Mn2+、Cu2+等金属离子结合,并累积生成金属硫化物,从而引起水体变黑[3-6].因此,将黑臭水体中的S2-氧化为价态稳定的SO42-可避免水体变黑现象的产生.S2-的氧化过程在自然环境下非常缓慢,主要依靠天然水体中的土著硫氧化菌(SOB)完成[7-8].这使得外源输入的S2-在黑臭水体中进一步富集,导致水质出现恶化[9].S2-等黑臭水体中污染物质的去除方法主要包括曝气复氧[10]、底泥疏浚[11-12]、强化混凝[13-14]和微生物法[15-16]等.其中,微生物法具有针对性强、对环境无二次污染等优点,已被成功应用于中小河道的治理中[17-18].目前,针对黑臭水体治理,微生物菌剂的开发已开展了一些研究工作,主要包括不动杆菌()、乳酸菌()、芽孢杆菌()和假单胞菌()等[19-21].但是,这些微生物菌剂以非硫氧化菌为主,且集中于菌剂对水体中COD、NH3-N和TP等污染物的去除效果研究,鲜少涉及对黑臭水体中致黑关键污染物S2-的去除影响研究.
本研究从北京东沙河黑臭水体中筛选分离1株能够高效氧化S2-的土著硫氧化菌株,考察菌株的生长特性及其对S2-的氧化特性,研究S2-的氧化过程,并利用高通量测序技术探讨菌株对S2-生物氧化的主要代谢途径,以期为黑臭水体治理及含S2-工业废水的处理提供高效硫氧化菌菌源.
1 材料与方法
1.1 硫氧化菌的筛选及富集
1.1.1 硫氧化菌的来源 东沙河是北京市典型的黑臭水体[3].本实验从北京东沙河采集底泥与水样等比例混合均匀,以此泥水混合物作为微生物富集分离培养的来源.水样采集于东沙河表层水,经10μm的膜过滤,剔除大块悬浮颗粒、藻类和浮萍等杂质.底泥用抓泥斗采集于水下0.5~1.0m,剔除石块和动植物残体等杂质.采样时进行多点布置,确保菌源的多样性.
1.1.2 培养基 实验所用培养基分别为富集培养基:Na2S·9H2O 0.162g/L,可溶性淀粉2g/L,KNO30.1g/L,K2HPO40.05g/L,NaCl 0.05g/L,MgSO4·7H2O 0.05g/L,FeSO40.001g/L,营养琼脂 2%;分离纯化培养基:Na2S·9H2O 0.162g/L,KNO30.1g/L,K2HPO40.05g/L,NaCl 0.05g/L,MgSO4·7H2O 0.05g/L,FeSO40.001g/L,葡萄糖 20g/L,蛋白胨10g/L,酵母浸膏粉5g/L,琼脂 15~20g/L;液体培养基:葡萄糖 20g/L,蛋白胨10g/L,酵母浸膏粉10g/L. 每种培养基在使用前均调节pH值至7.0,在100Mpa和121℃条件下灭菌20min.
1.1.3 菌种的富集与分离 取5mL泥水混合物稀释于500mL浓度为5%无菌NaCl溶液,再将其接种于富集培养基(S2-浓度为21.6mg/L)中,于25℃恒温培养2~3d.待硫氧化菌在培养基中大量生长后,选取长势较好的单菌落在分离纯化培养基上进行划线,于25℃恒温培养2~3d.不断重复进行划线分离,直至平板上所有菌落特征一致,即为硫氧化单菌株.
1.1.4 种子液的制备与扩培发酵 用接种环挑取分离纯化出来的硫氧化菌,接种到装有100mL液体培养基的锥形瓶中,转速120r/min,25℃恒温培养2d后用作种子液,再按照5%的接种量转接至新鲜的液体培养基中,于25℃,120r/min的恒温摇床中培养2d分批次发酵,用于黑臭水体硫氧化实验.
1.2 菌株的鉴定
1.2.1 16S rRNA测序 采用生工生物工程(上海)股份有限公司的Ezup柱式细菌基因组DNA抽提试剂盒SK8255对硫氧化菌总DNA进行抽提,具体实验步骤遵照试剂盒说明书进行.设计引物序列为27F(AGTTTGATCMTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT).以细菌总DNA为模板,PCR扩增,长度为1500bp.最后由生工生物工程(上海)股份有限公司完成测序工作.将碱基序列测序结果通过Blast程序和GenBank中核糖数据进行同源性分析,构建系统发育树.
1.2.2 形态及生理生化特性实验 (1)菌落形态观察:采用平板稀释法将分离纯化所获得的硫氧化单菌株涂布于固体培养基上,在25℃下恒温培养2~3d,待菌落生长出来后,观察并记录其表面形态,大小,颜色等菌落特征.(2)菌株生理生化特性实验:参考东秀珠等编著的《常见细菌系统鉴定手册》[22]和沈萍等编著的《微生物学实验》[23],完成硫氧化菌株生理生化特性实验.
1.3 含S2-废水的配制
实验采用人工配置的含S2-废水.根据Zhuang等[24]的描述对配水成分进行优化,主要成分见表1.含S2-废水配制后灭菌备用.灭菌条件为:100MPa, 121℃灭菌20min.

表1 含S2-人工配制废水
1.4 硫氧化最适条件及硫氧化菌的生长
将扩培发酵实验中生长至稳定期的硫氧化菌接入装有200mL含S2-人工配制废水的锥形瓶中,于120r/min转速条件下进行生物氧化反应,分别考察温度(5,15,20,25,30,35℃),pH值(4,5,6,7,8),葡萄糖浓度(0.05%,0.10%,0.25%,0.50%,1.00%)及初始菌浓度(0.01,0.10,1.00,2.00,5.00g/L)对S2-氧化率的影响,测定反应过程中细菌生长量OD600值,进而确定硫氧化菌对S2-的最适生物氧化条件.在最适S2-氧化条件下,通过定时测定细菌生长量和剩余S2-浓度,绘制硫氧化菌的生长曲线和S2-氧化曲线.
硫氧化菌对S2-的生物氧化途径研究在最适的硫氧化条件下进行.实验设计2组容积为5L的生化反应装置,每组设置3个平行实验.将硫氧化菌按1g/L的接种量转接至含S2-人工配制废水中(实验组),设立不添加硫氧化菌的对照组.反应过程中定时取样,测定水样中S2-,S0,S2O32-,S4O62-,SO32-和SO42-的质量浓度.
1.5 硫氧化菌对硫离子的生物氧化途径分析
1.5.1 基因组制备与测序 硫氧化菌总DNA提取采用美国Omega公司的E.Z.N.A.® DNA Kit试剂盒进行样品DNA抽提,PE文库构建采用美国Illumina公司的TruSeq™ DNA Sample Prep Kit试剂盒,桥式PCR建立采用美国Illumina公司的HiSeq PE Cluster Kit v4 cBot,最后进行Illumina Hiseq测序过程.基因组测序事宜委托上海美吉生物医药科技有限公司完成.
1.5.2 基因组组装与注释 对测序完成后所获得的Reads进行质量剪切工作,以去除Illumina Hiseq原始测序过程中产生的一些质量较低的Reads,使用IDBA-UD软件拼接组装优化序列,以获得最优选的组装结果.利用Glimmer 3.02软件进行细菌的基因预测,将预测基因的蛋白序列分别与Nr、Genes、String和Go等数据库进行blastp比对,从而获得所预测基因的注释信息.
1.6 硫氧化菌对黑臭水体处理实验
黑臭水样取自于北京市东沙河黑臭河段,具体水质参数如表2所示.将培养后的硫氧化菌以1g/L的接种量接种于装有200mL黑臭水样的锥形瓶中.同时设立不添加硫氧化菌的对照组,每组设置3个平行实验.在120r/min转速和25℃下反应60h,测定S2-的氧化率,以及COD,NH3-N,TP及色度的去除率.

表2 黑臭水样主要水质参数
1.7 分析测定方法
水样中测定指标包括S2-,S0,S2O32-,S4O62-,SO32-, SO42-,COD,NH3-N,TP,色度和OD600.S2-和S0采用分光光度法测定,S2O32-,SO32-和SO42-采用离子色谱仪(CIC-D120,青岛盛翰)测定.S4O62-采用高效液相色谱法(LC-10AD,岛津液相)测定.COD和NH3-N采用HACH多参数水质测定仪(DB2800,美国哈希)测定,TP采用紫外分光光度计(UV-1800,日本岛津)测定.色度评价参照稀释倍数法[25].硫氧化菌生长量按照冯玉雪等[26]描述的细菌计数法测定,即以OD600值来表示细菌的生长量.
每组实验设置3个平行样品,每组实验数据测3次求平均值.数据处理及分析分别采用OriginPro 9.0和Microsoft Excel 2013软件.
2 结果与讨论
2.1 硫氧化菌的筛选与分离
用以硫化钠为目标物的培养基进行菌种筛选和分离.通过富集培养和分离纯化,从东沙河泥水混合物中分离得到1株能高效氧化黑臭水体致黑关键污染物即S2-的土著硫氧化菌,在S2-浓度为21.6mg/L的培养基上,S2-氧化率可达到60%以上,将其命名为sp3.
2.2 菌种的鉴定
2.2.1 16S rRNA测序鉴定 通过NCBI中的Blast工具将测序得到的菌株sp3的16S rRNA 基因序列与GenBank中其它菌株的16S rRNA序列进行同源性对比.结果表明,菌株sp3的16S rRNA基因序列与菌属的多株菌株同源性高达99%以上.为此,菌株sp3鉴定为属.为进一步分析菌株sp3的系统进化位置,选取相似度最高的10条已命名纯培养菌株的16S rRNA基因序列,利用Mega7软件构建系统发育树,结果如图1所示.
2.2.2 形态及生理生化鉴定 菌株sp3在营养琼脂上进行25℃恒温培养后,为灰黄色不透明圆形菌落,边缘光滑,部分不规则,质地粘稠,菌落有氨气味,直径0.5~1mm,中央突起.通过革兰氏染色实验观察到菌株sp3颜色呈红色,为革兰氏阴性菌,且菌体微小呈短杆状.生理生化特性实验结果表明,菌株sp3具有赖氨酸脱羧酶活性,可还原硝酸盐和利用麦芽糖,并可水解七叶苷和液化明胶.由此可见,菌株sp3与的个体形态和生理生化特性具有相似性[27].结合菌株sp3的16S rRNA测序鉴定结果,初步确定菌株sp3为寡养单胞菌属.寡养单胞菌属代谢功能多样,大多体现在对抗生素的耐药性、降解有机磷、降解DDT[28-30]等方面的研究,关于硫氧化功能研究鲜有报道.

图1 菌株sp3系统发育树
2.3 菌株sp3的生长及硫氧化特性
2.3.1 温度对菌株生长及S2-氧化率的影响 如图2(a)所示,菌株sp3的生长量和对S2-的氧化率均随着温度的升高而增加,在温度为25℃时达到最高,此时S2-的氧化率高达85.2%.当温度继续提高至35℃时,菌株sp3的生长量和对S2-的氧化率略有下降.可以明显得出,菌株sp3嗜中温,能够在温度适宜的条件下,尤其是25℃进行各项代谢活动.因此,控制温度为25℃对S2-的氧化较为适宜.
2.3.2 初始pH值对菌株生长及S2-氧化率的影响 如图2(b)所示,菌株sp3的生长量和对S2-的氧化率随着初始pH值由强酸性到弱碱性呈现先上升后显著下降的变化趋势.当初始pH值在6~7范围内时,菌株sp3的生长较好,S2-的氧化率亦较高,皆达到85%左右.碱性条件不适合菌株sp3生长,也不利于对S2-的生物氧化.因此,初始pH值为7时较为适宜菌株sp3的生长及对S2-的生物氧化.
2.3.3 初始葡萄糖浓度对菌株生长及S2-氧化率的影响 如图2(c)所示,当初始葡萄糖浓度由0.05%提高至0.25%时,菌株sp3的生长量显著增加.这说明葡萄糖是菌株sp3可利用的碳源,能促进细菌的生长繁殖.当初始葡萄糖浓度继续提高至1%时,菌株sp3生长量的增长趋于缓慢,这是因为微生物细胞膜输入葡萄糖的能力趋近饱和.S2-的氧化率随着初始葡萄糖浓度的提高呈现先增加后下降的变化趋势.当初始葡萄糖浓度为0.25%时,菌株sp3对S2-的生物氧化能力最强,S2-的氧化率达到83%左右.因此,最适宜的初始葡萄糖浓度为0.25%.
2.3.4 初始菌浓度对菌株生长及S2-氧化率的影响 如图2(d)所示,初始菌浓度是影响S2-去除效率的重要因素之一.当初始菌浓度由0.01g/L提高至1.00g/L时,S2-的氧化率达到最高,为81.3%.继续提高初始菌浓度后,菌株sp3对S2-的氧化却保持基本稳定.Pradhan等[31]研究亦发现,将菌株生物量由0.064g提高1倍时,微生物对Cu2+的去除率却不再增加.因此,在本研究中最适的初始菌浓度为1.00g/L.

2.3.5 菌株sp3的生长曲线与S2-氧化曲线 将菌株sp3在最适条件下培养72h,得到S2-的剩余浓度及菌株生长量的变化曲线,如图3所示.菌株sp3的生长曲线符合细菌的群体生长规律.前16h为菌株的延滞期.随着菌株的加入,S2-剩余浓度开始迅速下降.在第16h后,菌株开始快速生长,至第35h达到最大值.因此,这19h为菌株的对数生长期.在此期间,菌株对S2-的氧化反应继续进行,促使S2-的剩余浓度持续下降.在第35~60h,菌株sp3的数量处于基本稳定的状态,菌株的生长进入稳定期.在菌株sp3稳定期,S2-的剩余浓度缓慢下降,在第60h达到最低值,为2.9mg/L,S2-氧化率高达86.6%.此后,菌株的数量开始迅速下降,菌株sp3处于衰亡期.而S2-的剩余浓度在菌株sp3的衰亡期保持基本稳定的状态.可以明显得出,菌株sp3对S2-的生物氧化过程发生在前35h,即菌株sp3的延滞期和对数生长期.
2.4 菌株sp3对S2-的生物氧化过程与主要代谢途径
2.4.1 菌株sp3对S2-的生物氧化过程 S2-在生物氧化过程中可能涉及6种不同的存在形态,包括S2-,S0,S2O32-,S4O62-,SO32-以及SO42-.因此,通过测定这6种无机硫存在形态的变化可推测S2-的生物氧化过程.在最适条件下,S2-在菌株sp3氧化作用过程中硫的存在形态变化如图4(a)所示.随着S2-生物氧化过程的进行,检测到不同存在形态的无机硫,包括S2-,S0,S2O32-,SO32-以及SO42-,并且这些无机硫浓度的变化在整个反应过程中呈现明显差异.由于S2-作为电子供体被氧化为其它价态的无机硫,它的浓度在前10h迅速下降;随后缓慢减少并逐渐趋于平缓,在反应30h后,水样中S2-的剩余浓度为3.0mg/L,其氧化率达到86.1%.S0,S2O32-和SO32-的浓度随着反应进行呈现明显的波动,这说明这些存在形态的无机硫在反应过程中同时存在生成与消耗2个过程.S0和SO32-浓度均呈现先上升后下降再上升的变化趋势,它们的浓度分别于18和45h达到最大值,这可能与前18h内S2-的氧化消耗有关.S2O32-的浓度呈现先上升后下降并逐渐趋于平稳的变化趋势,它的浓度在第8h取得最大值,为11.2mg/L.与S2-的浓度变化相反,SO42-的浓度在反应过程中则持续增加,最终达到9.2mg/L.Zhuang等[24]发现,初始浓度为200mg/L的含S2-废水在加入菌株ZJY-7后,SO42-的浓度随着S2-的不断氧化持续增加,达到91.8mg/L后保存稳定.
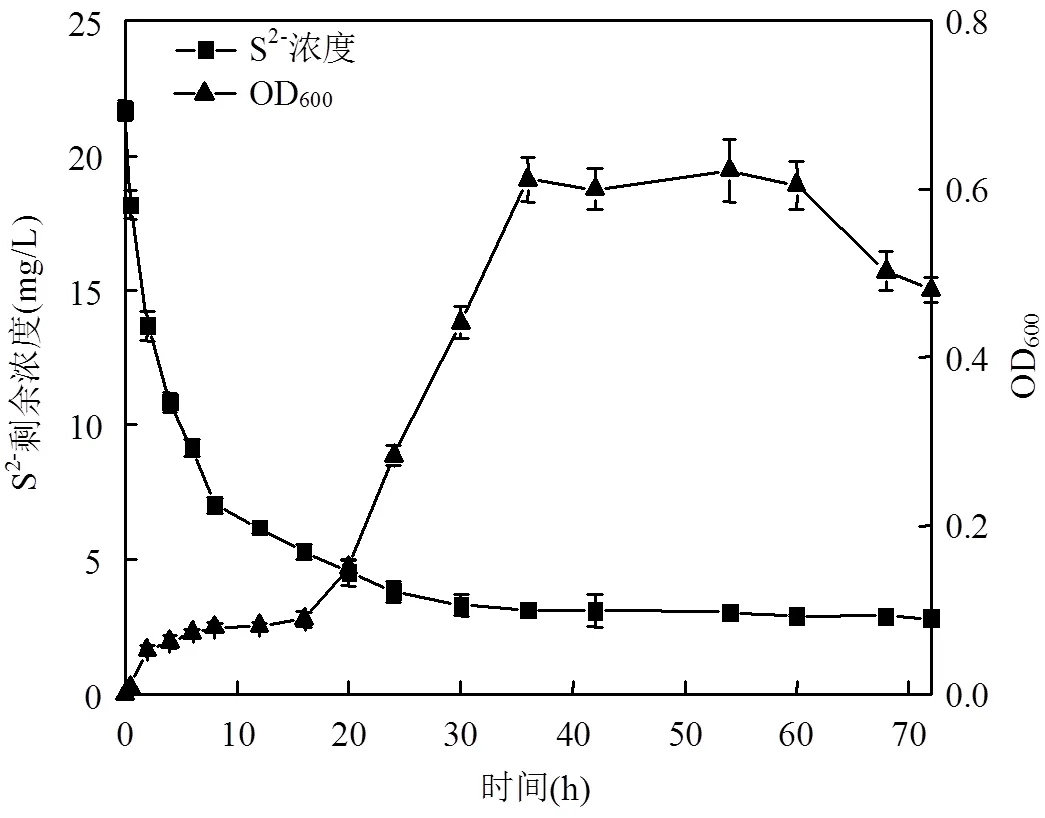
图3 菌株sp3的生长曲线和S2-氧化曲线
上述结果表明,菌株sp3对S2-的氧化过程是将非稳定态的S2-逐步转化为稳定态SO42-的过程.其中伴随着一系列中间存在形态无机硫的产生.这些无机硫最终部分转化为SO42-.需要说明的是,在整个反应中并未检测到S4O62-.此外,在未添加菌株sp3的对照组中,S2-的浓度呈现略微下降的趋势,并检测到极低浓度的S2O32-和SO42-产生,如图4(b)所示.其它存在形态的无机硫在反应过程中并未检测到.可以得出,菌株sp3的添加可明显促进S2-的生物氧化.

2.4.2 硫离子氧化功能基因 为了探讨硫氧化菌sp3对S2-氧化的主要代谢途径,进一步采用高通量测序技术进行分析.基因组测序结果显示,总碱基数为1047369985bp,平均测序深度为204×.根据剪切后的数据,将Reads拼接成Contigs;而后,将Contigs按顺序排列在一起形成Scaffolds.利用Glimmer 3.02软件对菌株sp3组装后的Scaffolds进行分析和基因预测.统计获得的基因数量,基因总长度和GC含量等指标,结果如表3所示.
研究得出SOB对无机硫氧化的2条主要途径[32-33].一条为PSO(副球菌硫氧化)途径,即从S0氧化为SO32-,再氧化为SO42-的硫氧化途径.另一条为S4I(连四硫酸盐)途径,即伴随有多硫酸盐产生的四硫化物中间物途径.S4O62-仅存在于S4I途径,是此途径中重要的中间代谢产物[34-35].PSO和S4I这2条途径都存在3个阶段的氧化过程,包括S2-到S0,低价态无机硫到SO32-,SO42-的生成,涉及硫化物醌氧化还原酶(SQR),亚硫酸盐还原酶(SRN),硫代硫酸盐-硫转移酶(TST),异二硫化物还原酶(HDR),连四硫酸盐水解酶(TTH)以及亚硫酸盐氧化酶(SO)等关键酶[36].其中,TTH酶仅存在于S4I途径中,起到将S4O62-转化为SO42-的作用.

表3 菌株sp3基因测试结果
根据现有文献报道与公共数据库KEGG中有关硫氧化代谢途径中相关基因的描述,结合基因组测序结果,在菌株sp3中检测出31种与无机硫生物氧化过程相关的功能基因,如表4所示.前人研究表明,在菌株sp3检测出的部分硫氧化功能基因同样存在于其它SOB中[37-39],例如编码半胱氨酸脱硫酶的ES基因,编码吡啶核苷酸二硫键氧化还原酶的A基因,编码TST酶的基因,编码NAD(P)H-泛醌氧化还原酶的基因,以及编码硫酸盐ABC转运体渗透酶的基因等.此外,还检测出其它一些与硫氧化相关的功能基因[40-41],包括编码SRN酶的IJ基因,编码FAD黄素腺嘌呤二核苷酸F,编码电子传递体的B基因以及编码SO酶的基因簇.虽然测序结果中未检测出编码SQR酶的基因,但是检测到编码吡啶核苷酸二硫键氧化还原酶的A基因.此基因已被证实同样可以起到编码SQR酶的作用[42-43].
2.4.3 硫氧化主要代谢途径 基因测序结果表明,在菌株sp3中不存在编码连四硫酸盐水解酶TTH的H基因,结合本研究未检测出中间产物S4O62-,可推测菌株sp3对S2-的氧化可能仅存在PSO途径,见图5所示.此途径中涉及的无机硫存在形态包含S2-、S0、S2O32-、SO32-以及SO42-.S2-在菌株sp3作用下的主要氧化途径推测如下:一部分底物S2-作为电子供体被氧化为S0,此过程涉及到编码SQR酶的A基因和编码FAD黄素腺嘌呤二核苷酸的F基因[41-44];另一部分底物S2-在编码SRN酶的IJ基因调控下直接氧化为SO32-[45-46];在氧化过程中生成的S0与SO32-可自发反应生成S2O32-,而S2O32-可在编码TST酶的基因调控下发生歧化反应释放出SO32-和S0[36];SO32-在编码SO酶的基因簇调控进一步氧化生成SO42-[33,47].

表4 菌株sp3基因组中无机硫生物氧化过程相关基因
A基因可编码SQR酶,该酶主要起催化S2-转化为S0的作用[45].IJ基因通过控制SRN酶的合成调控S2-至SO32-的生化反应[45-46],此过程为可逆.过量的SO32-可对微生物细胞产生毒害作用[48].而SO32-还原为S2-的反应有助于减少SO32-在体系中的累积并降低对细胞的毒害风险.S2-直接氧化为SO32-的代谢途径仅存在于少数SOB中[47].此外,SRN酶通路亦发现于具有有机硫化物矿化功能的微生物中,起着调节SO32-的作用[49].这说明菌株sp3可能同样具有有机硫化物矿化功能,可能成为降解黑臭水体中致味硫醇和硫醚类致臭污染物的功能微生物.S0也可直接氧化为SO32-.此反应需通过异二硫化物还原酶通路,该通路存在于大多数SOB中[50].在此通路中,S0在硫醇基团RSH的作用下被活化为硫烷硫原子RSSH,接着经异二硫化物还原酶催化转化为SO32-,并重新形成RSH[51].RSSH的生成过程由基因调控[39],而异二硫化物还原酶由BC基因编码[50].在菌株sp3中虽然检测到基因,但未检测出BC基因.这表明在菌株sp3中可能无S0→ RSH→RSSH→SO32-的通路.因此,菌株sp3中可能仅存在S0与SO32-之间的自发反应,以及S2O32-的歧化反应.SO32-可直接或间接氧化为SO42-.在直接氧化途径中,基因簇,尤其是C基因扮演着重要作用,其通过调控SO酶的合成控制SO42-的生成[47].而间接氧化途径是指SO32-由Apr基因调控磷酸腺苷硫酸盐(APS)途径而被氧化成SO42-[33].在菌株sp3中未检测出Apr基因,故SO32-的氧化可能只存在直接氧化途径.

图5 菌株sp3对S2-的生物氧化主要途径
SQR:硫化物醌氧化还原酶; SRN:亚硫酸盐还原酶; TST:硫代硫酸盐-硫转移酶; SO:亚硫酸盐氧化酶
2.5 菌株sp3对黑臭水样的去除效果
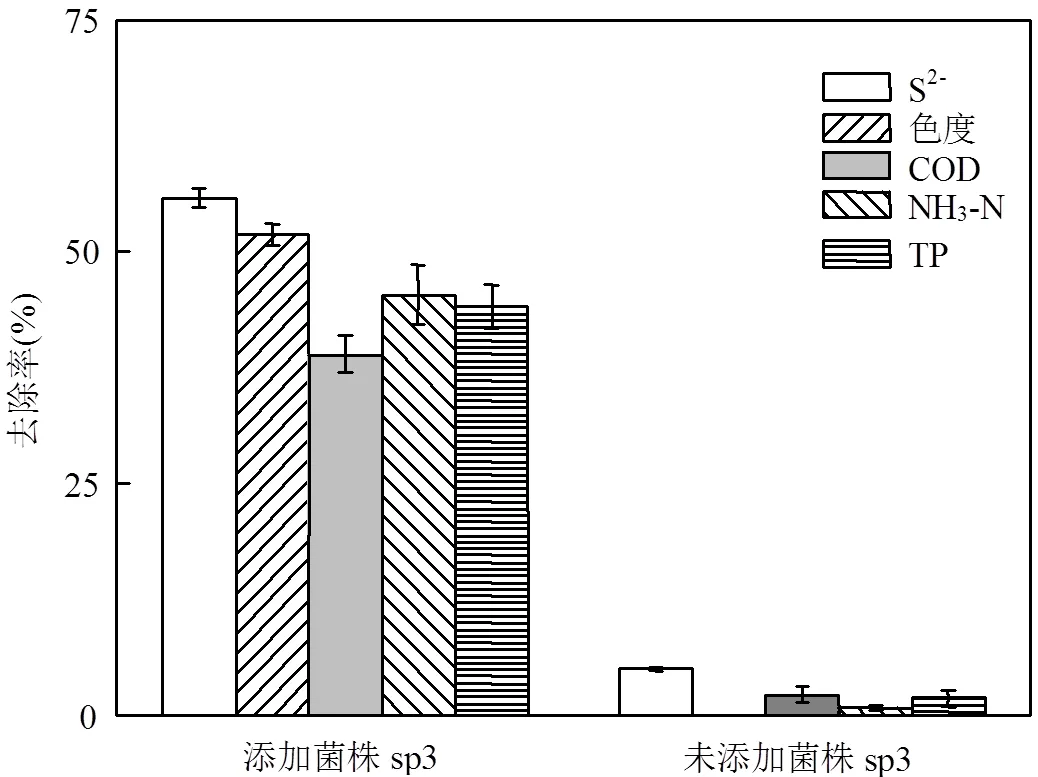
图6 菌株sp3对北京东沙河水样中污染物的去除效果
菌株sp3对北京东沙河黑臭水样中的主要污染物去除效果如图6所示.结果表明,菌株sp3对实际黑臭水体中的S2-亦表现出较好的氧化能力.S2-由12.9mg/L的初始浓度降低为5.7mg/L,氧化率达到55.8%.水样中的色度随着S2-浓度的降低而下降,去除率高于50%.同时,菌株sp3对COD、NH3-N和TP亦具有明显的去除效果,去除率分别为38.9%, 45.4%和44.1%.未添加菌剂sp3的对照组中S2-氧化率仅为5.1%,且COD等污染物去除率变化并不明显.
3 结论
3.1 从北京东沙河黑臭水体中筛选分离到一株能高效氧化S2-的菌株,经鉴定,该菌株属于寡养单胞菌属(),命名为sp. sp3.
3.2 在温度25℃,初始pH值7.0,初始葡萄糖浓度0.25%,初始菌浓度1.00g/L的适宜条件下,菌株sp3对S2-的氧化率最高可达86.6%.
3.3 在S2-生物氧化过程中产生了S0,S2O32-,SO32-和SO42-这4种存在形态的硫.利用高通量测序技术推测菌株sp3主要通过副球菌硫氧化途径(PSO)将非稳定态的S2-逐步转化为稳定态的SO42-.
3.4 菌株sp3对北京东沙河黑臭水样中S2-氧化率为55.8%.同时,色度、COD、NH3-N和TP的去除率分别为51.3%、38.9%、45.4%和44.1%.
[1] 国务院.水污染防治行动计划 [z]. 2015. The State Council. Action plan for water pollution prevention and control [z]. 2015.
[2] 住房和城乡建设部和环境保护部.全国城市黑臭水体整治信息发布平台 [EB/OL]. http://www.hcstzz.com/2017-08. Ministry of Housing and Urban-Rural Construction and Ministry of Environmental Protection.National information publishing platform for urban black and odorous water treatment [EB/OL]. http://www. hcstzz.com/2017-08.
[3] Song C, Liu X L, Song Y H, et al. Key blackening and stinking pollutants in Dongsha River of Beijing: Spatial distribution and source identification [J]. Journal of Environmental Management, 2017,200: 335-346.
[4] Tang W, Shan B, Zhang H, et al. Heavy metal contamination in the surface sediments of representative limnetic ecosystems in eastern China [J]. Scientific Reports, 2014,4:7152-7158.
[5] 王玉琳,汪 靓,华祖林.黑臭水体中不同浓度Fe2+、S2-与DO和水动力关系 [J]. 中国环境科学, 2018,38(2):627-633. Wang Y L, Wang L, Hua Z L. The relationships of different concentration Fe2+, S2-with hydrodynamics, DO in black bloom water based on quantile regression method [J]. China Environmental Science, 2018,38(2):627-633.
[6] 王 旭,王永刚,孙长虹,等.城市黑臭水体形成机理与评价方法研究进展 [J]. 应用生态学报, 2016,27(4):1331-1340. Wang X, Wang Y G, Sun C H, et al.Formation mechanism and assessment method for urban black and odorous water body: A review [J]. Chinese Journal of Applied Ecology, 2016,27(4):1331-1340.
[7] Liu C, Shen Q, Zhou Q, et al. Precontrol of algae-induced black blooms through sediment dredging at appropriate depth in a typical eutrophic shallow lake [J]. Ecological Engineering, 2015,77:139-145.
[8] Jiang Y, Xie P, Nie Y. Concentration and bioaccumulation of cyanobacterial bioactive and odorous metabolites occurred in a large, shallow Chinese lake [J]. Bulletin of Environmental Contamination and Toxicology, 2014,93:643-648.
[9] Sheng Y, Qu Y, Ding C, et al. A combined application of different engineering and biological techniques to remediate a heavily polluted river [J]. Ecological Engineering, 2013,57(57):1-7.
[10] Gu D G, Xu H, He Y, et al. Remediation of urban river water by Pontederia cordata combined with artificial aeration: Organic matter and nutrients removal and root-adhered bacterial communities [J]. International Journal of Phytoremediation, 2015,17(11):1105-1114.
[11] He W, Shang J G, Lu X, et al. Effects of sludge dredging on the prevention and control of algae-caused black bloom in Taihu Lake,China [J]. Journal of Environmental Sciences, 2013,25(3):430- 440.
[12] 陈 超,钟继承,范成新,等.疏浚对湖泛的影响:以太湖八房港和闾江口水域为例 [J]. 中国环境科学, 2014,34(8):2071-2077. Chen C, Zhong J C, Fan C X, et al. Effects of sludge dredging on black bloom: a case study of Bafang port and Lujiang port of Taihu Lake [J]. China Environmental Science, 2014,34(8):2071-2077.
[13] 刘树娟,陈 磊,钟润生,等.硝酸钙对河流底泥中含硫化合物嗅味原位控制 [J]. 环境科学研究, 2012,25(6):691-698. Liu S J, Chen L, Zhong R S, et al. In situ control of odor in sulfide-containing compounds with calcium nitrate in river sediments [J]. Research of Environmental Sciences, 2012,25(6):691-698.
[14] Liang-Liang T, Peng L I, Jing-Min D, et al. The Chemical Coagulation-Advanced Oxidation Composite Process for Treating Sulfur-contained Tannery Wastewater [J]. Leather & Chemicals, 2011, 28(6):8-10.
[15] Wang M, Yang G, Min H, et al. Bioaugmentation with the nicotine- degrading bacterium Pseudomonas sp. HF-1in a sequencing batch reactor treating tobacco wastewater: Degradation study and analysis of its mechanisms [J]. Water Research, 2009,43(17):4187-4196.
[16] Jin M, Wang X W, Gong T S, et al. A novel membrane bioreactor enhanced by effective microorganisms for the treatment of domestic wastewater [J]. Applied Microbiology & Biotechnology, 2005,69(2): 229-235.
[17] Chen J, Koopman B, Fang G, et al. Bioaugmentation with Gordonia strain JW8 in treatment of pulp and paper wastewater [J]. Clean Technologies & Environmental Policy, 2012,14(5):899-904.
[18] Semrany S, Favier L, Djelal H, et al. Bioaugmentation: Possible solution in the treatment of Bio-Refractory Organic Compounds (Bio-ROCs) [J]. Biochemical Engineering Journal, 2012,69(51): 75-86.
[19] 徐熊鲲,谢翼飞,陈政阳,等.曝气强化微生物功能菌修复黑臭水体 [J]. 环境工程学报, 2017,11(8):4559-4565. Xu X K, Xie Y F, Chen Z Y, et al. Remediation of urban black- odorous river by aeration enhancing functional strains [J]. Chinese Journal of Environmental Engineering, 2017,11(8):4559-4565.
[20] 吴 霞,谢悦波.直接投菌法在城市重污染河流治理中的应用研究 [J]. 环境工程学报, 2014,8(8):3331-3336. Wu X, Xie Y B. Application of directly adding microbial agent to improve water quality of heavily polluted urban river [J]. Chinese Journal of Environmental Engineering, 2014,8(8):3331-3336.
[21] Guo H, Chen C, Lee D J, et al. Proteomic analysis of sulfur– nitrogen-carbon removal bysp. C27under micro– aeration condition [J]. Enzyme and Microbial Technology, 2014,56: 20-27.
[22] 东秀珠,蔡妙英.常见细菌系统鉴定乎册 [M]. 北京:科学出版社, 2002. Dong X Z, Cai M Y. Systematic identification of common bacteria [M]. Beijing: Science Press, 2002.
[23] 沈 萍,范秀容,李广武.微生物学实验 [M]. 北京:高等教育出版社, 2003. Shen P, Fan X R, Li G W.Microbiology Experiment [M]. Beijing:Higher Education Press, 2003.
[24] Zhuang R, Lou Y, Qiu X, et al. Identification of a yeast strain able to oxidize and remove sulfide high efficiently [J]. Applied Microbiology & Biotechnology, 2017,101(1):391-400.
[25] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.中国环境科学出版社, 2002. Editorial board of water and wastewater monitoring and analysis method of the State Environmental Protection Administration. Water and Wastewater Monitoring and Analysis Method (4) [M]. China Environmental Science Press, 2002.
[26] 冯玉雪,毛 缜,吕蒙蒙.一株DDT降解菌的筛选及其降解特性 [J]. 中国环境科学, 2018,(5):1935-1942. Feng Y X, Mao Z, Lü M M. Screening and degradation characteristics of a DDT-degrading bacteria [J]. China Environmental Science, 2018(5):1935-1942.
[27] Lambert T, MarieCécile P, François D, et al. Characterization of the Chromosomal aac(6′)-Iz Gene of Stenotrophomonas maltophilia [J]. Antimicrob Agents Chemother, 1999,43(10):2366-2371.
[28] Shen Y J, Lu P, Mei H, et al. Isolation of a methyl parathion-degrading strainsp. SMSP-1and cloning of thegene [J]. Biodegradation, 2010,21(5):785-792.
[29] Dubey K K, Fulekar M H. Chlorpyrifos bioremediation inPennisetumrhizosphere by a novel potential degraderMHF ENV20 [J]. World Journal of Microbiology & Biotechnology, 2012,28(4):1715-1725.
[30] Fang H, Deng Y, Ge Q, et al. Biodegradability and ecological safety assessment ofsp. DDT-1in the DDT-contaminated soil [J]. Ecotoxicology and Environmental Safety, 2018,158:145-153.
[31] Pradhan S, Rai L C. Optimization of flow rate, initial metal ion concentration and biomass density for maximum removal of Cu2+by immobilized Microcystis [J]. World Journal of Microbiology & Biotechnology, 2000,16(6):579-584.
[32] Quatrini R, Appia-Ayme C, Denis Y, et al. Extending the models for iron and sulfur oxidation in the extreme acidophile[J]. Bmc Genomics, 2009,10(1):394-412.
[33] 刘 阳,姜丽晶,邵宗泽.硫氧化细菌的种类及硫氧化途径的研究进展 [J]. 微生物学报, 2018,58(2):191-201. Liu Y, Jiang L J, Shao Z Z. Research progress on species of sulfur-oxidizing bacteria and sulfur-oxidizing pathways [J]. Acta Microbiologica Sinica, 2018,58(2):191-201.
[34] Wang Z B, Li Y Q, Lin J Q, et al. The two-component system RsrS-RsrR regulates the tetrathionate intermediate pathway for thiosulfate oxidation in Acidithiobacillus caldus [J]. Froutiers in Microbiology, 2016,7(1755):1-15.
[35] Kelly D P, Shergill J K, Lu W P, et al. Oxidative metabolism of inorganic sulfur compounds by bacteria [J]. Antonie Van Leeuwenhoek, 1997,71(1/2):95-107.
张 宪.嗜酸氧化硫硫杆菌的全基因组测序及硫氧化途径研究 [D]. 中南大学, 2014. Zhang X. Whole-genome sequencing ofand metabolic construction of sulfur oxidation [D]. Central South University, 2014.
[37] Yoshimoto A, Sato R. Studies on yeast sulfite reductase I. Purification and characterization [J]. Biochim Biophys Acta, 1968,153(3):555-575.
[38] Rohwerder T, Sand W. Oxidation of Inorganic Sulfur Compounds in Acidophilic Prokaryotes [J]. Engineering in Life Sciences, 2007,7(4): 301-309.
[39] Foloppe N, Nilsson L. The glutaredoxin -C-P-Y-C- motif: influence of peripheral residues [J]. Structure, 2004,12(2):289-300.
[40] 彭加平,韦平和,周锡樑.半胱氨酸脱硫酶的生化特性及其脱硫作用机制 [J]. 药物生物技术, 2011,(6):548-552. Peng J P, Wei P H, Zhou X L. Biochemical properties of cysteine desulfurase and its mechanism for the desulfuration of-Cysteine [J]. Pharmaceutical Biotechnology, 2011,(6):548-552.
[41] Rother D, Henrich H J, Quentmeier A, et al. Novel Genes of the sox Gene Cluster, Mutagenesis of the Flavoprotein SoxF, and Evidence for a General Sulfur-Oxidizing System in Paracoccus pantotrophus GB17 [J]. Journal of Bacteriology, 2001,183(15):4499-4508.
[42] Hedderich R, Koch J, Linder D, et al. The heterodisulfide reductase from Methanobacterium thermoautotrophicum contains sequence motifs characteristic of pyridine-nucleotide-dependent thioredoxin reductases [J]. Febs Journal, 2010,225(1):253-261.
[43] 朱 薇.嗜热古菌浸出黄铜矿的硫氧化活性与群落结构及硫形态关联性研究 [D]. 中南大学, 2012. Zhu W. Research on the correlations among sulfur oxidation activity, community structure and sulfur speciation in bioleaching chalcopyrite with thermophilic archaea [D]. Central South University, 2012.
[44] Chan L K, Morgankiss R M, Hanson T E. Functional analysis of three sulfide:quinone oxidoreductase homologs in Chlorobaculum tepidum [J]. Journal of Bacteriology, 2009,191(3):1026-1034.
[45] Tan T, Liu C, Liu L, et al. Hydrogen sulfide formation as well as ethanol production in different media by- and/or-inactivated mutant strains ofZM4 [J]. Bioprocess Biosyst Eng, 2013,36(10):1363-1373.
[46] Meiping W, Yunli J, Ziwei X, et al. Impairment of Sulfite Reductase Decreases Oxidative Stress Tolerance in Arabidopsis thaliana [J]. Frontiers in Plant Science, 2016,7:1843-1852.
[47] 辛玉峰.异养细菌硫化物氧化途径及产物分析 [D]. 山东大学, 2016. Xing Y F. Sulfide oxidation pathway and products anaiysis in heterotrophic bacteria [D].Shandong University, 2016.
[48] Sugio T, Mizunashi W, Inagaki K, et al. Purification and some properties of sulfur:ferric ion oxidoreductase from[J]. Journal of Bacteriology, 1987,169(11):4916-4922.
[49] Santana M M, Gonzalez J M, Clara M I. Inferring pathways leading to organic-sulfur mineralization in the Bacillales [J]. CRC Critical Reviews in Microbiology, 2016,42(1):1-15.
[50] 季家举.嗜酸氧化亚铁硫杆菌异二硫化物还原酶HdrC亚基的表达纯化及定点突变 [D]. 中南大学, 2012. Ji J J. Expression, purification and site-directed mutagenesis of the HdrC subunit from heterodisulfide reductase in[D]. Central South University, 2012.
[51] Rohwerder T, Sand W. The sulfane sulfur of persulfide is the actual substrate ofthe sulfur-oxidizing enzymes from Acidithiobacillus and Acidiphilium spp [J]. Microbiology, 2003,149(7):1699-1710.
S2--oxidizing characteristics and main bio-oxidation metabolic pathway ofsp.sp3.
XU Yao-yao1,2, SONG Chen3,4, LU Jin-xia1, WANG Jin2, YUE Zheng-bo2, LIU Xiao-ling1*
(1.Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China;3.Nanjing R&D Technology Group Co., Ltd, Nanjing 210029, China;4.Nanjing Hydraulic Research Institute, Nanjing 225600, China)., 2019,39(8):3373~3382
Inorganic sulfur (S2-) was used as the target pollutant, and a single strain capable of S2--oxidizing was obtained from Dongsha river (a black-stinking river) located in Beijing. Through both of the physiological-biochemical characteristics and the 16S rRNA sequencing experiment, this single strain was identified as, and named assp.sp3. The experiment on the growth and S2--oxidizing characteristics of this strain sp3 was then carried out. The best conditions of S2--oxidizing were as follows: initialpH of 7.0, 25℃, initial glucoseconcentration of 0.25%along with initial cell concentrationof 1.00g/L. Under the above bio-oxidation conditions, the highest S2--oxidizing ratio was arrived at 86.6% by this strain sp3 after the bio-reaction of 60h. The concentration of S2-decreased continually and then kept in a stable status in the whole bio-reaction process, and other sulphur chemical forms including S0, S2O32-, SO32-and SO42-were produced in this period. With the bio-oxidation of S2-, the concentration of SO42-increased slowly. High-throughput sequencing technologies were used to investigate the main metabolic pathway of S2-bio-oxidation by this strain sp3. The paracoccus sulfur oxidation process was the possibly main metabolic pathway of S2-(unstable valence state)to SO42-(stable valence state). It was initially concluded that a portion of S2-was oxidized to S0, while other part of S2-was directly oxidized to SO32; and then S0reacted with SO32-spontaneously to form S2O32-, while the latter was released SO32-and S0by the disproportionate reaction again. The SO32-accumulated gradually in the system was further directly oxidized to SO42-. This study indicated that this strain sp3 has potential application in water purification of the black-stinking wate bodies.
S2-;screening;sulphur oxidation characteristics;metabolic pathway
X172
A
1000-6923(2019)08-3373-10
徐瑶瑶(1992-),女,安徽铜陵人,合肥工业大学资源与环境工程学院硕士研究生,主要从事黑臭水体治理技术研究.
2019-01-03
北京市自然科学基金资助项目(8182058);中央院所基本科研业务专项(2019YSKY-003)
* 责任作者, 研究员, liuxl@craes.org.cn
