MnFe2O4活化过一硫酸盐降解废水中LAS
2019-08-28佘月城董正玉吴丽颖洪俊明
佘月城,董正玉,吴丽颖,王 霁,张 倩,洪俊明*
MnFe2O4活化过一硫酸盐降解废水中LAS
佘月城1,2,董正玉1,2,吴丽颖1,2,王 霁1,2,张 倩1,2,洪俊明1,2*
(1.华侨大学环境科学与工程系,福建 厦门 361021;2.福建省工业废水生化处理工程技术研究中心,福建 厦门 361021)
采用共沉淀法制备了铁锰双金属复合催化剂(MnFe2O4),用于活化过一硫酸盐(PMS)产生强氧化性的硫酸根自由基(SO4−·)氧化降解水中阴离子表面活性剂(LAS).采用傅立叶变换红外光谱仪(FTIR)、X射线粉末衍射仪(XRD)、扫描电子显微镜(SEM)对催化剂进行表征,表明成功合成了具有尖晶石结构的MnFe2O4催化剂.考察了催化剂投加量、PMS投加量以及初始pH值等各种因素条件对LAS的降解效率以及反应动力学的影响.实验结果表明,MnFe2O4活化PMS降解LAS的过程符合准一级动力学(2>0.9).在LAS初始浓度为80mg/L,催化剂投加量为2.0g/L,PMS的浓度为2.5mmol/L,初始pH值为7.0,反应时间为30min的情况下,LAS降解效率达到94.1%,此时LAS的降解速率常数达到0.192min-1.通过自由基猝灭实验证明了MnFe2O4/PMS体系中起主要氧化降解作用的活性自由基为SO4−·.通过反应前后催化剂的X射线光电子能谱(XPS),证实Fe和Mn之间存在协同作用,提高了MnFe2O4对PMS的活化效率.
MnFe2O4;过一硫酸盐;LAS;硫酸根自由基
基于硫酸根自由基(SO4−·)的高级氧化技术是一种新型高效的污染物降解技术[3-4],处理有机废水的适用范围宽泛,处理效果好,具有很好的应用前景[5].目前主要是通过活化过硫酸盐(S2O82-,PS)或过一硫酸盐(HSO5-,PMS)产生具有强氧化性的硫酸根自由基(SO4−·)氧化降解废水中的有机物.相对于PS,PMS的分子结构具有不对称性,更易被活化而产生SO4−·.而单独存在的PMS具有较强的稳定性,对有机物没有明显的去除效果,需要通过热[5]、紫外光[6]、过渡金属离子[7-8]和金属氧化物[9]等活化PMS产生高活性的SO4−·.复合金属催化剂是由多种金属或金属氧化物通过化学键作用形成的复合催化剂[9],比表面积大,不同的金属间存在强的协同作用,活性位点密度更大,催化活性更高[10].因此,复合金属催化剂活化过硫酸盐降解污染物效果更好[11-12].在具有活化特性的过渡金属中,铁、锰均可有效活化PMS去除难降解有机污染物且两种材料廉价易得.铁锰复合催化剂制作简单,不会造成二次污染,且催化剂具有磁性,方便回收循环利用[13].MnFe2O4为铁锰复合催化剂的一种,已有研究表明[9-10,14]:MnFe2O4催化剂具有尖晶石结构,Mn2+和Fe2+之间的协同作用可大大地增强MnFe2O4/PMS体系中的电子转移效率,从而产生更多的强氧化性自由基,提高MnFe2O4/PMS体系对于污染物的降解效果.
本研究首次提出利用双金属催化剂活化PMS体系降解LAS废水.利用制备的MnFe2O4活化PMS降解LAS废水,探究反应体系降解LAS的降解效果、影响因素、以及反应动力学,并对反应机理进行分析,为处理阴离子表面活性剂废水的工程应用提供参考.
1 实验部分
1.1 材料与方法
过硫酸氢钾购自上海麦克林生化科技有限公司,浓硫酸(H2SO4),氢氧化钠(NaOH),亚甲基蓝(指示剂级),一水合磷酸二氢钠(NaH2PO4·H2O),均购自国药集团化学试剂有限公司.十二烷基苯磺酸钠(LAS 化学纯),六水合氯化铁(FeCl3·6H2O),一水合硫酸锰(MnSO4·H2O).甲醇,叔丁醇,二氯甲烷均购自汕头市西陇科学股份有限公司.以上试剂均为分析纯,实验用水为去离子水.
1.2 催化剂的制备与表征
将摩尔比为2:1的FeCl3·6H2O和MnSO4·H2O溶于600mL去离子水中,其中Fe和Mn的浓度保持在0.15mol/L,然后将其放入油浴锅中,保持温度80℃,持续加热搅拌6h.随后向溶液中滴加8mol/L的NaOH溶液,使溶液pH值保持在11左右,继续反应10min后冷却至室温.再用去离子水重复多次洗涤所产生的沉淀物,直至上清液为中性.最后将沉淀放入表面皿中,真空干燥12h后,便可得到铁锰复合催化剂(MnFe2O4).
使用场发射扫描电子显微镜(FESEM)(Tescan Mira3Zeiss Merlin Compact)来表征MnFe2O4催化剂的形态和结构,并配备OxfordX-MAX能量色散X射线光谱仪(EDS).通过X射线粉末衍射仪(XRD) (D8advance Bruker)表征催化剂的晶体结构,使用Nicolet iS50光谱仪(Thermo Scientific)进行衰减全反射-傅里叶变换红外光谱(ATR-FTIR)分析.反应前后催化剂中的Fe、Mn的价态变化利用X射线光电子能谱(XPS)(Thermo Scientific Escalab 250Xi)进行分析.
1.3 实验方法
取100mL一定浓度的十二烷基苯磺酸钠溶液于250mL的烧杯中,然后加入一定量制备好的MnFe2O4催化剂和一定量的PMS,打开磁力搅拌器进行反应,并同时对反应进行计时.在室温(298K)下,反应一定时间后,取出一定量的反应液测量其中LAS的剩余浓度.利用亚甲基蓝分光光度法测定水样中的LAS浓度,并同时计算降解率.每组设置3个平行样取平均值.
1.4 分析方法
LAS的测定方法为在652nm波长下,用紫外-可见分光光度计测定吸光度,通过标准曲线换算成浓度值.并根据方程Q=(C0-Ct)/C0×100%计算其降解效率.式中:Q为LAS降解效率,C0为LAS的初始浓度(mg/L),Ct为取样测定时的LAS浓度(mg/L).运用准一级反应动力学分析不同条件下LAS的降解速率,准一级反应动力学方程为dC/dt=-kC,其中t为反应时间(h),C=C(t)为t时刻LAS浓度(mg/L),k为降解速率常数(h-1).
2 结果与讨论
2.1 MnFe2O4的表征
如图1(a)和(b)所示,从SEM照片中,可以看出MnFe2O4催化剂分散均匀,呈现颗粒状,只有少量发生团聚现象,粒径大小约为1μm.同时,通过EDS图谱可以看出催化剂的主要元素组成为Fe、Mn、O 3种元素,并且Fe、Mn之间的比例约为2.2:1,基本与投加量相一致.如图1(c)所示,从XRD图中可以看出所有特征衍射峰的位置和尖晶石相MnFe2O4的标准图谱(JCPDS No.10-0319)相一致.说明成功制备了具有尖晶石结构的MnFe2O4催化剂.并且,在XRD的图谱中未发现其他杂峰的存在,说明了制备的MnFe2O4催化剂中无其它杂质,纯度较高.如图1(d)所示,在1630和3410cm-1处分别有2个明显的-OH吸收峰,前者对应催化剂吸附水的弯曲振动,后者对应催化剂吸附水中的-OH的伸缩振动[15].在1410cm-1处的特征吸收峰对应于金属氧化物上-OH的变形振动[16].而在480和586cm-1处的2个吸收峰可分别对应于Mn-O键和Fe-O键的四面体的伸缩振动,在480cm-1处的峰是指Mn2+在八面体位点中的伸缩振动,而在586cm-1处是指Fe3+在四面体位置中的固有伸缩振动[16].

2.2 不同体系对LAS降解效率影响

图2 不同体系中LAS的降解效率
在LAS初始浓度为80mg/L、pH值为7、催化剂投加量为2.0g/L、PMS浓度为2.5mmol/L的条件下,考察了LAS在不同体系下的降解效率.如图2所示,在MnFe2O4或PMS单独存在时,LAS在30min内的降解率只有12%和22%.而当MnFe2O4和PMS同时存在时,在30min内LAS的降解率可达到94.1%,远大于MnFe2O4或PMS单独存在时LAS的降解率.
备自投引入负荷均分功能,能够改善某一侧主变失电时可能导致的过载现象,但是该功能也会带来一些不利因素。通过延时判别联切,取消了强制负荷均分功能,根据负荷情况自动投入负荷均分,使某一侧在主变失电时,有一个分段开关让相邻主变能够进行互相支援;通过整定不同备投时间的方式,能够避免全站失压的情况,保障重要负荷的电力供应。进行负荷均分功能的优化后,不仅能提高供电可靠性,也使一次设备得到充分利用,取得良好的经济效益。
2.3 催化剂的投加量对LAS降解效率的影响
在LAS初始浓度为80mg/L,pH值为7,PMS投加量为2.5mmol/L的条件下,考察MnFe2O4的不同投加量对LAS降解效率的影响,如图3(a)所示.根据图3(a)的结果拟合得到动力学影响为图3(b),动力学参数见表1.结果表明,MnFe2O4活化PMS降解LAS过程符合准一级反应动力学过程.
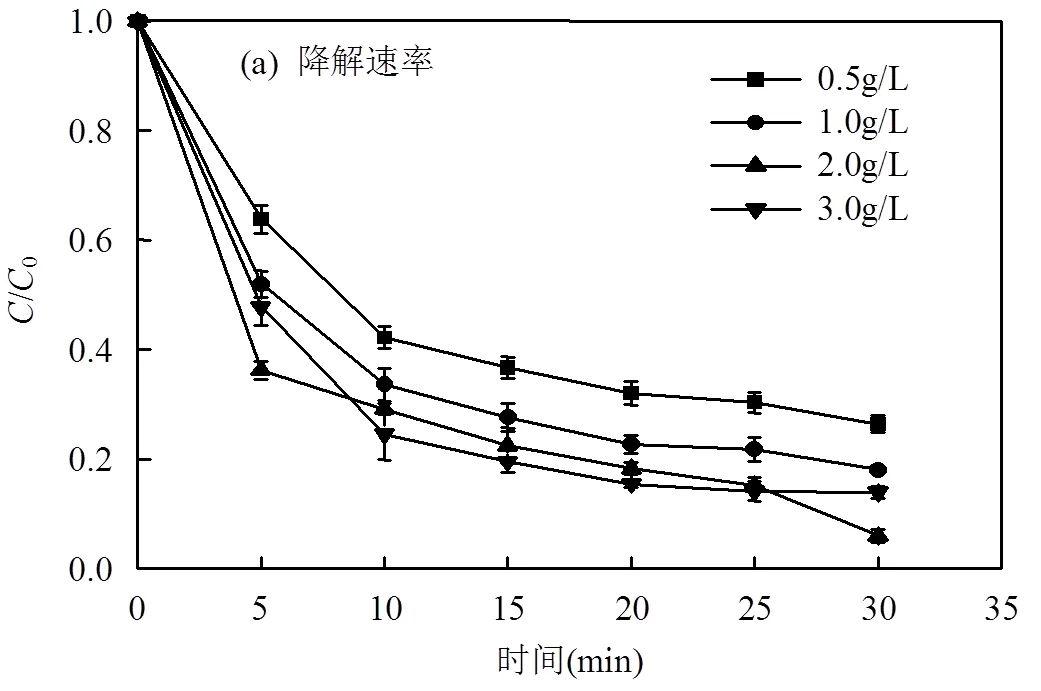
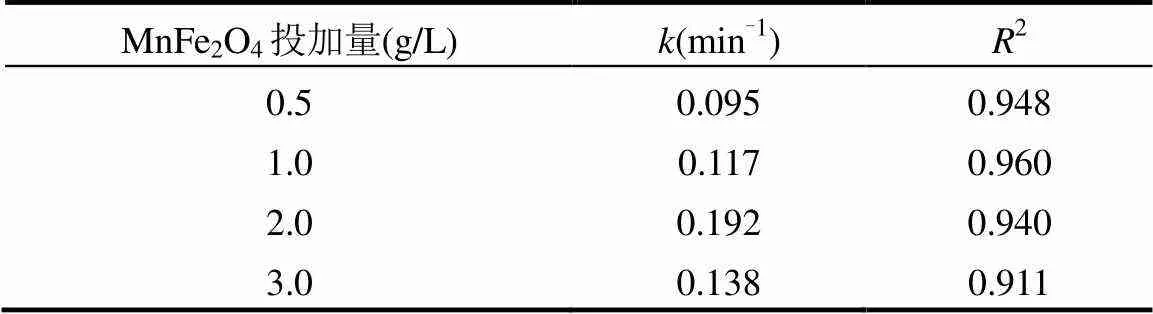
表1 不同催化剂投加量下LAS降解的动力学速率常数
当催化剂的投加量为0.5g/L时,LAS的降解速率常数为0.095min-1,降解效率为73.7%,逐渐提高催化剂的投加量至2.0g/L时,LAS的降解速率常数上升至0.192min-1,降解效率也上升至94.1%.当催化剂的投加量继续增加至3.0g/L时,LAS的降解速率常数并未继续升高,而是略微下降到0.138min-1,降解效率也下降到86.1%.这可能是由于当催化剂投加量较低时(低于2.0g/L),随着催化剂投加量的逐渐增加,溶液中参与活化反应的活性位点增加,生成更多强氧化性的SO4−·,从而不断提高了LAS的降解效率.而催化剂投加量继续加大时(高于2.0g/L),溶液中的催化剂颗粒会过多而发生团聚现象,导致催化剂的比表面积降低[17],活性位点减少,LAS的降解效率被抑制.
2.4 PMS的浓度对LAS降解效率的影响
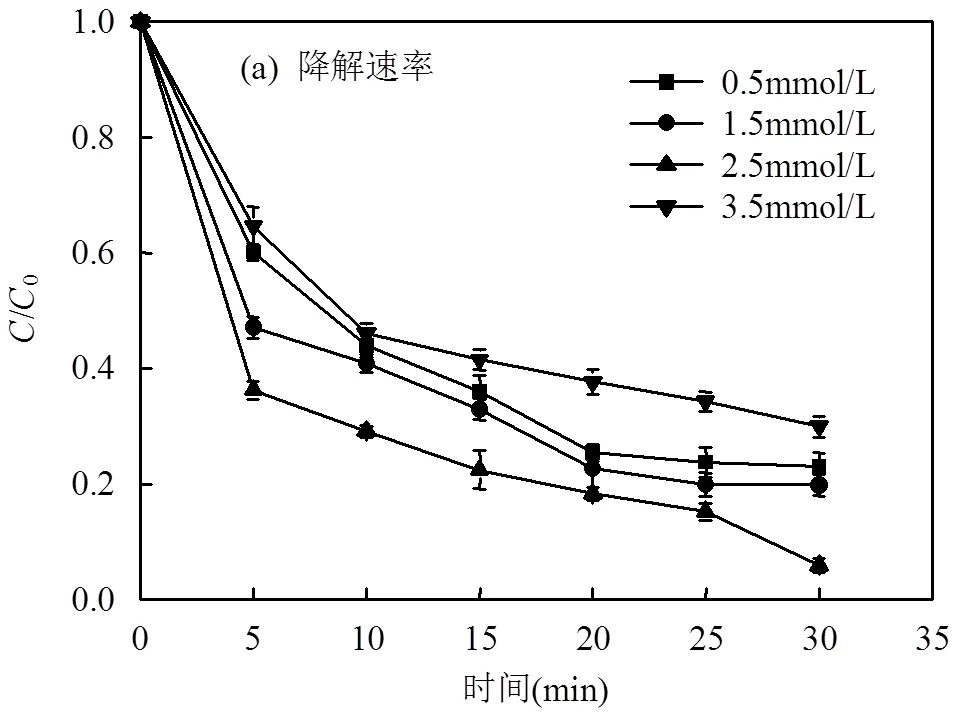
在LAS初始浓度为80mg/L、pH值为7、MnFe2O4投加量为2.0g/L的条件下,考察PMS的不同浓度对LAS降解效率的影响,如图4(a)所示.根据图4(a)的结果拟合得到动力学影响为图4(b),动力学参数见表2.结果表明:当PMS浓度为0.5mmol/L时,LAS的降解速率常数为0.120min-1,LAS的降解效率为77.1%.逐渐提高PMS的浓度至2.5mmol/L时,LAS的降解速率常数上升至0.192min-1,降解效率也提高至94.1%.当继续提高PMS的浓度,LAS的降解速率常数以及降解效率并未出现进一步的提升,而是反而出现了大幅度的下降.这是因为当PMS的浓度过高时,溶液中会生成大量的自由基,自由基之间会发生相互反应,猝灭生成的自由基,导致体系中SO4−·量变少.同时溶液中的HSO5-也会消耗生成的SO4−·,并生成氧化能力较弱的SO5−·[18-19],反应如方程式(1)~(2)所示.
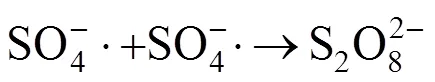
(2)
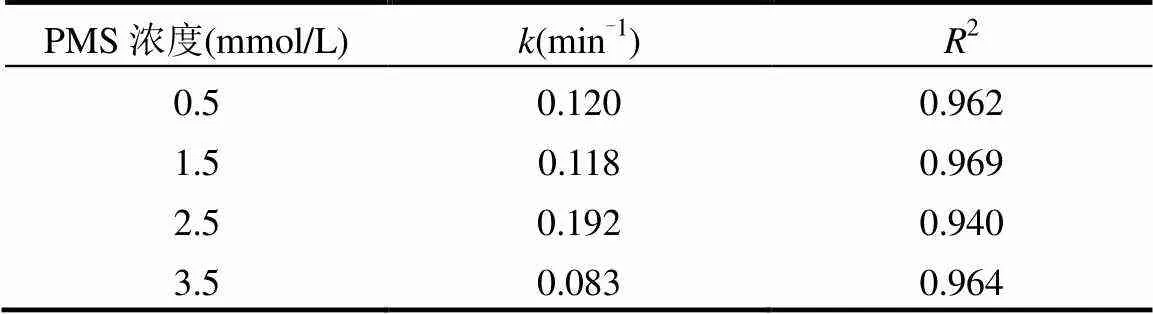
表2 不同PMS投加量下LAS降解的动力学速率常数
2.5 LAS初始浓度对降解效率的影响
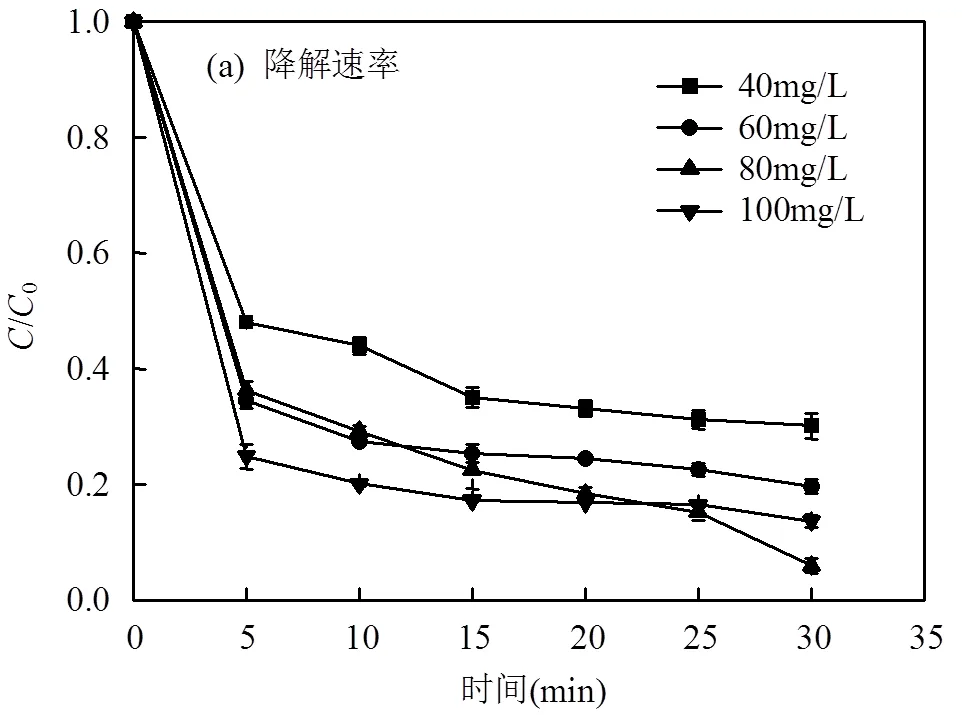
在pH值为7,MnFe2O4投加量为2.0g/L,PMS的浓度为2.5mmol/L的条件下,考察不同LAS初始浓度对降解速率的影响,如图5(a)所示,根据图5(a)的结果拟合得到动力学影响为图5(b),动力学参数见表3.结果表明:当LAS的初始浓度40mg/L时,LAS的降解速率常数为0.0587min-1,LAS的降解效率为69.9%.逐渐提高LAS的初始浓度至80mg/L时,LAS的降解速率常数上升至0.192min-1,降解效率为94.1%.而当LAS的初始浓度继续上升至100mg/L时,LAS的降解速率常数以及降解效率并未继续上升而是出现了下降的趋势.LAS的降解速率常数下降至0.0624min-1,降解效率下降为86.4%.这是因为当LAS的初始浓度较低时(低于80mg/L),LAS初始浓度的提升会增加自由基与LAS接触,提高体系中自由基的利用率,从而使得降解速率逐渐上升.而当LAS的初始浓度较高时(高于80mg/L),随着LAS浓度的增加会导致更多的LAS分子吸附在催化剂表面,覆盖了催化剂的活性位点,从而降低了自由基的产量[11,20].
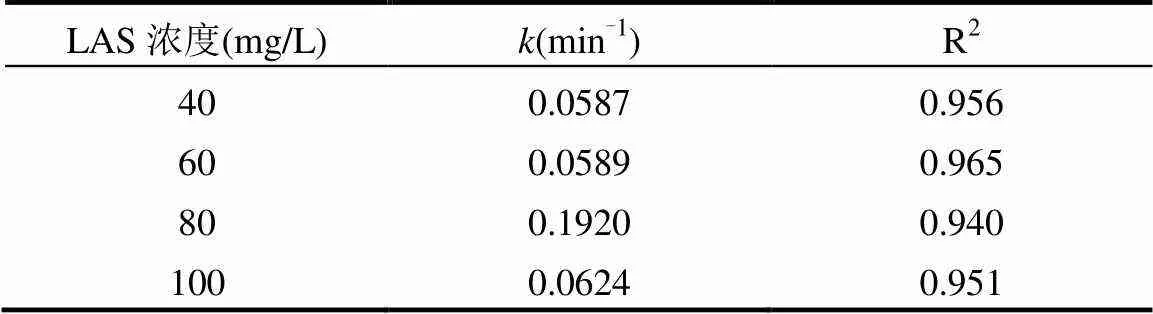
表3 不同LAS初始浓度下LAS降解的动力学速率常数
2.6 初始pH值对LAS降解效率的影响
在LAS初始浓度为80mg/L,MnFe2O4投加量为2.0g/L,PMS的浓度为2.5mmol/L的条件下,考察不同初始pH值对LAS的降解效率的影响,如图6所示,动力学参数见表4.从图中可以看出,当初始pH值为3时,LAS的降解速率常数为0.176min-1,降解效率为87.3%.当pH值调至中性时,LAS的降解速率常数上升到0.192min-1,降解效率提高到94.1%.当pH值继续提高至11时,LAS的降解速率常数降低至0.042min-1,降解效率也明显降低至31.5%.因此pH值为中性时,LAS的降解效果最好.这是因为在初始pH值为3.0时,H+的增加会抑制催化剂的表面活性,阻碍了铁锰之间的离子循环,降低了Fe2+和Mn2+的协同作用[21],从而使得LAS的降解效率下降.但是,高的初始pH值会使得催化剂表面上产生金属氧化物沉淀,催化剂表面的活性位点被遮盖[21],降低了MnFe2O4催化剂的活性,从而减少了SO4−·产生量.
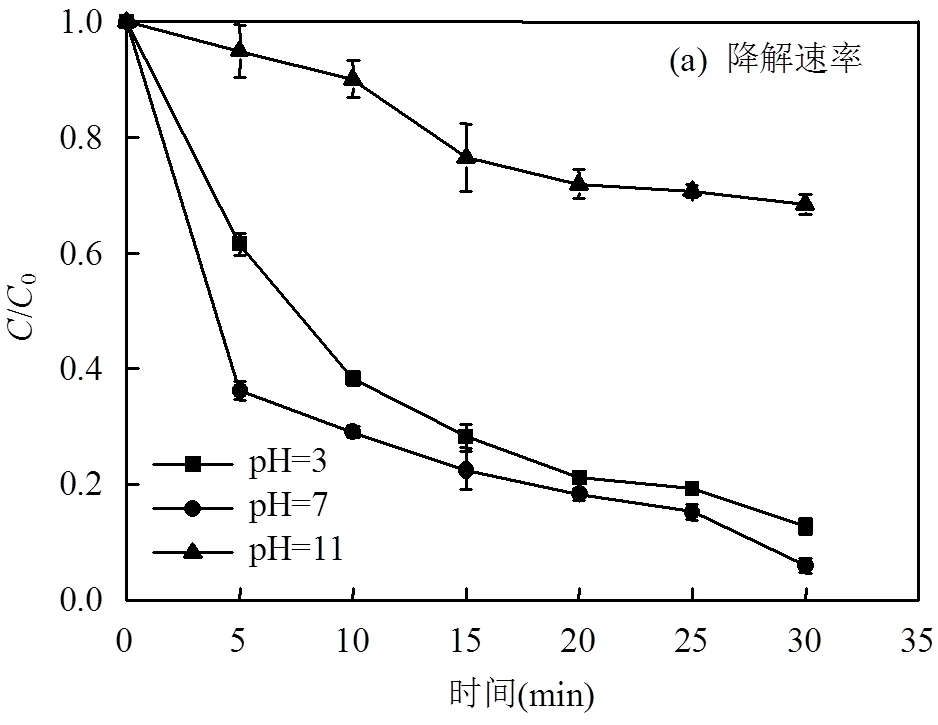
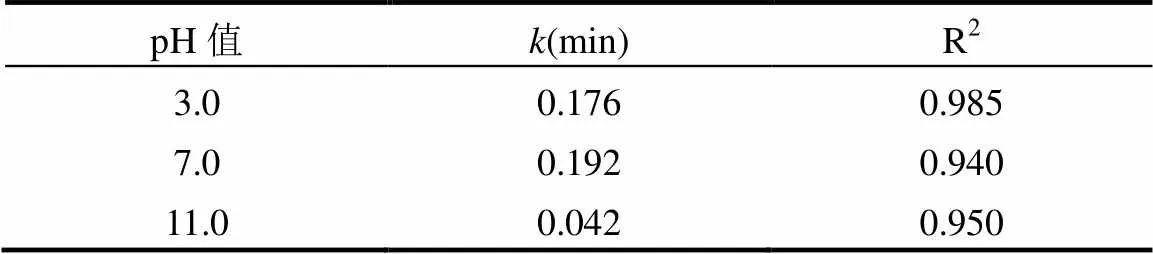
表4 不同初始pH值下LAS降解的动力学速率常数
2.7 降解过程中COD的变化分析

图7 LAS降解过程COD变化曲线
在LAS初始浓度为80mg/L,MnFe2O4投加量为2.0g/L,PMS的浓度为2.5mmol/L,初始pH值为7的条件下,探究在MnFe2O4/PMS体系降解LAS的过程中COD的变化,如图7所示.可以发现,溶液的COD随着反应时间的进行逐渐降低,在30min时COD的去除率可达到90%以上,这一结果与LAS的浓度变化基本一致.因此MnFe2O4/PMS体系对COD和LAS都具有较高的去除效率.
2.8 自由基种类和反应机理分析
研究表明[22],在过渡金属/PMS体系中,一般存在3种不同的自由基SO4−·、·OH以及SO5−·.但SO5−·的氧化性较弱,对污染物没有明显的降解作用.因此,体系中主要起到氧化降解作用的是SO4−·和·OH,SO4−·与·OH之间的相互转化机理如方程式(3)~(4)[23]:

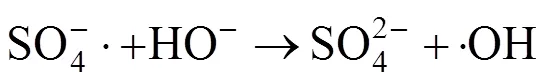
叔丁醇(TBA)与·OH和SO4−·的反应速率常数分别为·OH/TBA=3.8×108~7.6×108和SO4−/TBA=4×105~ 9.1×105,两者相差约1000倍;甲醇(Me)与·OH和SO4−·的反应速率常数分别为·OH/Me=1.2×109~ 2.8× 109和SO4−·/Me=1.6×107~7.7×107,两者相差约100倍[24-25],说明两种自由基和甲醇反应速率相差不大,可以用来鉴别·OH和SO4−·的存在,而叔丁醇与·OH和SO4−·的反应速率相差较大,且·OH/TBA远大于SO4−·/TBA,可以用来判断·OH的作用[26].
为了分析在MnFe2O4活化PMS降解LAS过程中起主要作用的自由基的种类.在LAS初始浓度为80mg/L,pH值为7,MnFe2O4投加量为2.0g/L,PMS浓度为2.5mmol/L的条件下,向体系中加入甲醇和叔丁醇,两者浓度均为100mmol/L,作为不同自由基的猝灭剂.实验结果如图8所示,当体系中加入叔丁醇作为·OH的猝灭剂时,对LAS的降解无明显抑制作用,说明体系中·OH对LAS的降解几乎无贡献.但是,体系加入甲醇后,对LAS的降解出现明显的抑制作用,LAS降解效率大幅度下降,说明体系中起主要氧化作用的自由基为SO4−·.
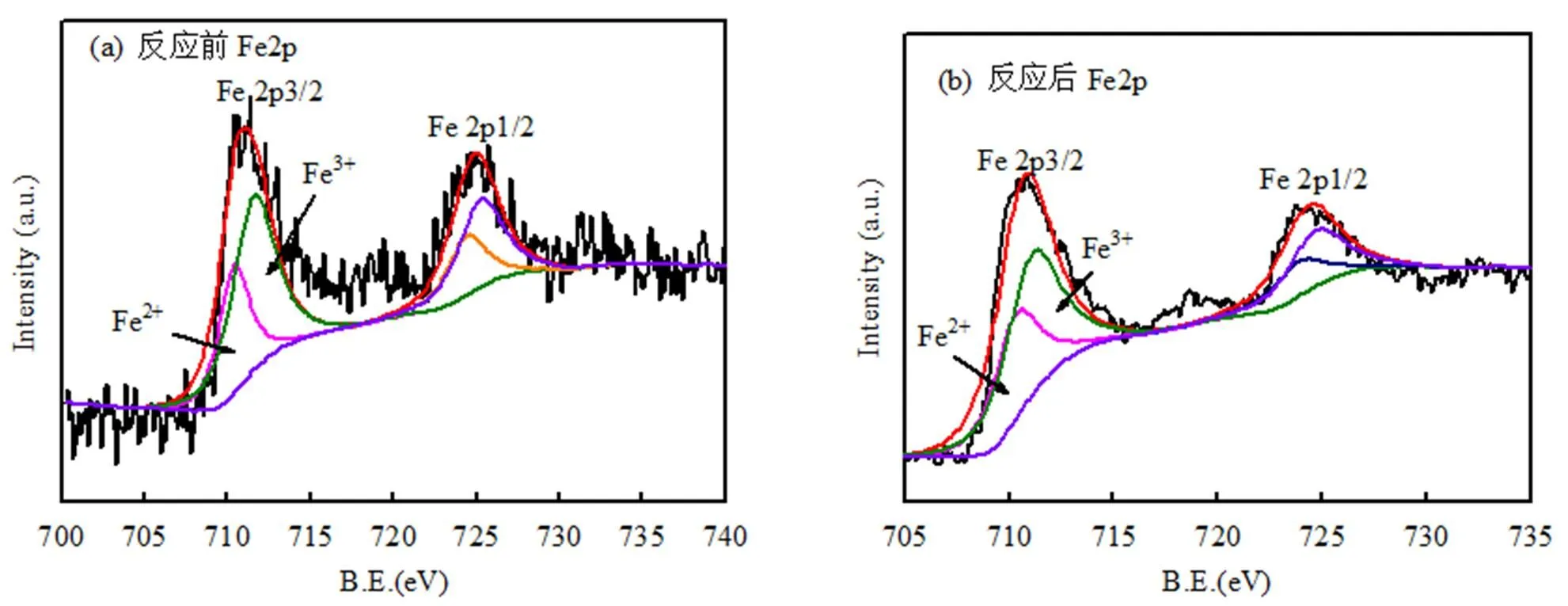
根据所得的实验结果,可以推测相应的反应机理.Mn2+主要存在于MnFe2O4催化剂中的八面体位置上,Mn2+首先与PMS反应生成SO4−·,Mn2+转化为Mn3+,Fe2+与PMS之间也发生类似的反应.另外,Fe2+可以将生成的Mn3+还原为Mn2+,从而实现了锰离子的再生,体现了铁锰之间的协同作用,并且大大地加强了金属离子活化PMS生成SO4−·的效率(如反应(5)~(11)所示)[27-28].图9为反应前后催化剂的XPS能谱图,可以看出反应前的催化剂中Mn2p3/2的峰位于642.2和640.8eV处,分别是Mn3+和Mn2+的结合能峰,其中Mn3+和Mn2+的百分比分别为54.3%和45.7%[29].反应前的催化剂中Fe2p3/2的能谱图在710.5和711.9eV处的2个结合能峰,分别是Fe2+和Fe3+的峰且百分比分别为32.5%和67.5%.从反应后的Mn2p3/2的能谱图,可以看出在643.4eV出现新的Mn4+的结合能峰,并且Mn2+和Mn3+的峰均削弱,这表明Mn2+和Mn3+均在催化剂的表面参与了氧化还原反应[30].同时从反应后的Fe2p3/2能谱图,可以得到Fe2+的比例从32.5%上升到34.2%,这是因为催化剂中的Fe3+在反应后部分被还原为Fe2+.反应后Mn4+的出现和Fe2+比例的增加都表明了在MnFe2O4催化剂活化PMS的过程中存在Fe和Mn之间的电荷转移[28].因此,Fe和Mn之间存在协同作用,以促进Fe2+/Fe3+,Mn2+/Mn3+/Mn4+的循环效率,从而提高了MnFe2O4催化剂对于PMS的活化效率.
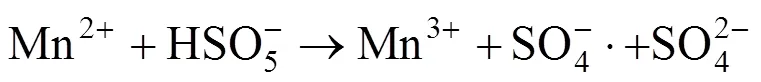
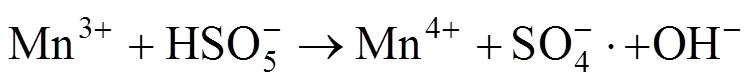
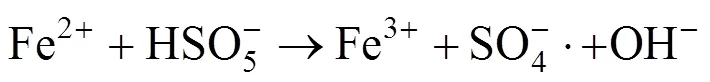
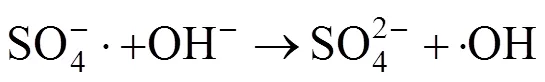
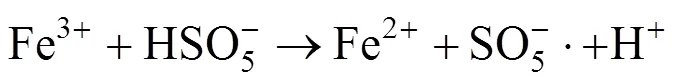

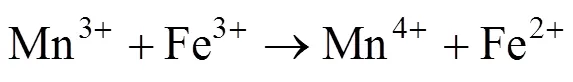
3 结论
3.1 采用共沉淀法制备了铁锰双金属MnFe2O4催化剂,用于活化PMS降解水中阴离子表面活性剂LAS.相比于单独的MnFe2O4催化剂体系和单独PMS体系具有更好的降解效果.
3.2 最佳反应条件为:LAS初始浓度为80mg/L、MnFe2O4催化剂投加量为2.0g/L、PMS的浓度为2.5mmol/L、初始pH值为7.0,反应时间为30min,LAS初始浓度为80mg/L时,降解效率可达94.1%,且LAS的降解过程符合准一级反应动力学,COD去除率可达到90%以上.
3.3 MnFe2O4/PMS体系中起主要氧化降解作用的自由基为SO4−·,反应前后催化剂的XPS能谱图显示,Fe和Mn的协同作用提高了MnFe2O4催化剂对PMS的活化效率.
[1] 孙 硕,潘忠稳,周 杨,等.一种新型双子阴离子表面活性剂的合成及增溶性能评价 [J]. 精细石油化工, 2017,34(2):44-48. Sun S, Pan Z W, Zhou Y, et al. The synthesis of a novel gemini anionic surfactant along with the evaluation of its solubilization performance [J]. Speciality Petrochemicals, 2017,34(2):44-48.
[2] 张 婷,冯辉霞,张 娟,等.Fe2O3/H2O2类芬顿法处理阴离子表面活性剂废水的试验 [J]. 净水技术, 2013,32(2):39-42. Zhang T, Feng H X, Zhang J, et al. Experiment of Fenton -Like Fe2O3/H2O2Reaction Process for Treatment of Wastewater with Anionic Surfactant [J]. Water Purification, Technology, 2013,32(2): 39-42.
[3] 张成武,李天一,廉静茹,等.Fe(II)活化O2高级氧化降解罗丹明B染料[J]. 中国环境科学, 2018,38(2):560-565. Zhang C W, Li T Y, Lian J R, et al. Study on degradation of rhodamine B by advanced oxidation based on O2activation by Fe(II) [J]. China Environmental Science, 2018,38(2):560-565.
[4] 田凯勋,杨 超,肖 泉,等.超声强化零价铁/过硫酸钾体系降解2,4,6-三氯苯酚废水[J]. 中国环境科学, 2017,37(10):131-136. Tian K X, Yang C, Xiao Q, et al. Degradation of 2,4,6-TCP in an ultrasound-enhanced zero-valent iron/potassium persulfate system [J]. China Environmental Science, 2017,37(10):131-136.
[5] 赵进英,张耀斌,全 燮,等.加热和亚铁离子活化过硫酸钠氧化降解4-CP的研究 [J]. 环境科学, 2010,31(5):1233-1238. Zhao J Y, Zhang Y B, Quan X, et al. Sodium Peroxydisulfate Activation by Heat and Fe(Ⅱ) for the Degradation of 4-CP [J]. Environmental Science, 2010,31(5):1233-1238.
[6] 林天来,刘秀峰,黄灿克.光源强度对UV活化过硫酸盐降解甲基叔丁基醚效果的影响研究[J]. 环境与可持续发展, 2017,32(5):103-105. Lin T L, Liu X F, Huang C K. Effect of Light Intensity on UV-assited Persulfate Degradation of MTBE [J]. Environment and Sustainable Development, 2017,32(5):103-105.
[7] 陈 平,王 晨,王 瑶.过渡金属强化FeS/过硫酸钾体系降解甲基橙废水[J]. 工业用水与废水, 2018,49(4):17-21. Chen P, Wang C, Wang Y. Methyl orange wastewater degradation by transition metal strengthening FeS/potassium persulfate system [J]. Industrial Water & Wastewater, 2018,49(4):17-21.
[8] 钟美娥,李 季,龚道新,等.均相Co(Ⅱ)/PMS体系对二氯喹啉酸的降解特性研究[J]. 中国环境科学, 2015,35(11):3282-3287. Zhong M E, Li J, Gong D X, et al. Degradation characteristics of quinclorac in homogeneous Co(Ⅱ)/PMS system [J]. China Environmental Science, 2015,35(11):3282-3287.
[9] Dong Z Y, Zhang Q, Chen B Y, et al. Oxidation of bisphenol A by persulfate via Fe3O4-α-MnO2nanoflower-like catalyst: Mechanism and efficiency [J]. Chemical Engineering Journal, 2019,357:337-347.
[10] 董正玉,吴丽颖,王 霁,等.新型Fe3O4@α-MnO2活化过一硫酸盐降解水中偶氮染料 [J]. 中国环境科学, 2018,38(8):3003-3010. Dong Z Y, Wu L Y, Wang J, et al. Novel Fe3O4@α-MnO2activated peroxymonosulfate degradation of azo dyes in aqueous solution [J]. China Environmental Science, 2018,38(8):3003-3010.
[11] Deng J, Feng S F, Ma X, et al. Heterogeneous degradation of Orange II with peroxymonosulfate activated by ordered mesoporous MnFe2O4[J]. Separation & Purification Technology, 2016,167:181-189.
[12] Khan A, Liao Z, Yong L, et al. Synergistic degradation of phenols using peroxymonosulfate activated by CuO-Co3O4@MnO2nanocatalyst [J]. Journal of Hazardous Materials, 2017,329:262-271.
[13] Vignesh R H, Sankar K V, Amaresh S, et al. Synthesis and characterization of MnFe2O4nanoparticles for impedometric ammonia gassensor [J]. Sensors & Actuators B Chemical, 2015,220:50-58.
[14] Ye P, Wu D M, Wang M Y, et al. Coating magnetic CuFe2O4nanoparticles with OMS-2 for enhanced degradation of organic pollutants via peroxymonosulfate activation [J]. Applied Surface Science, 2018,428:131-139.
[15] Ma Z, Zhao D, Chang Y, et al. Synthesis of MnFe2O4@Mn-Co oxide core–shell nanoparticles and their excellent performance for heavy metal removal [J]. Dalton Transactions, 2013,42(39):14261-14267.
[16] Tang W, Su Y, Li Q, et al. Superparamagnetic magnesium ferrite nanoadsorbent for effective arsenic (III, V) removal and easy magnetic separation [J]. Water Research, 2013,47(11):3624-3634.
[17] Xu L, Xu C, Zhao M, et al. Oxidative removal of aqueous steroid estrogens by manganese oxides [J]. Water Research, 2008,42(20): 5038-5044.
[18] Liu J, Zhao Z, Shao P, et al. Activation of peroxymonosulfate with magnetic Fe3O4-MnO2core-shell nanocomposites for 4-chlorophenol degradation [J]. Chemical Engineering Journal, 2015,262:854-861.
[19] 徐朋飞,郭怡秦,王光辉,等.紫外活化过硫酸盐对甲基橙脱色处理实验研究 [J]. 环境工程, 2017,35(11):58-61. Xu P F, Guo Y Q, Wang G H, et al. Experimental study on UV- activated persulfate for decolorization of methyl orange wastewater [J]. Environmental Engineering, 2017,35(11):58-61.
[20] Xu L, Wang J. A heterogeneous Fenton-like system with nanoparticulate zero-valent iron for removal of 4-chloro-3-methyl phenol [J]. Journal of Hazardous Materials, 2011,186(1):256-264.
[21] Leng Y Q, Guo W L, Shi X, et al. Degradation of Rhodamine B by persulfate activated with Fe3O4: Effect of polyhydroquinone serving as an electron shuttle [J]. Chemical Engineering Journal, 2014,240:338- 343.
[22] 张乃东,张曼霞,孙 冰.硫酸根自由基处理水中甲基橙的初步研究[J]. 哈尔滨工业大学学报, 2006,38(4):636-638. Zhang N D, Zhang M X, Sun B. Prelim inary study on processing methyl orange in the water with sulfate radical anion method [J]. Journal Harbin Institute Of Technology, 2006,38(4):636-638.
[23] Wu L Y, Zhang Q, Hong J M, et al. Degradation of Bisphenol A by persulfate activation via oxygen vacancy-rich CoFe2O4-x[J]. Chemosphere, 2019,221:412-422.
[24] Wan Z, Wang J L. Degradation of sulfamethazine using Fe3O4-Mn3O4/ reduced graphene oxide hybrid as Fenton-like catalyst [J]. Journal of Hazardous Materials, 2017,324:653–664.
[25] Lei Y, Chen C S, Tu Y J, et al. Heterogeneous Degradation of Organic Pollutants by Persulfate Activated by CuO-Fe3O4: Mechanism, Stability, and Effects of pH and Bicarbonate Ions [J]. Environmental Science & Technology, 2015,49:6838-6845.
[26] 姚淑华,马锡春,李士凤.秸秆生物炭活化过硫酸盐氧化降解苯酚[J]. 中国环境科学, 2018,38(11):168-174. Yao S H, Ma X C, Li S F. Straw biochar activated persulfate oxidation and degradation of phenol [J]. China Environmental Science, 2018, 38(11):168-174.
[27] Goyal A, Bansal S, Singhal S. Facile reduction of nitrophenols: Comparative catalytic efficiency of MFe2O4, (M=Ni, Cu, Zn) nano ferrites [J]. International Journal of Hydrogen Energy, 2014,39(10): 4895-4908.
[28] Wan Z, Wang J L. Degradation of sulfamethazine using Fe3O4-Mn3O4/reduced graphene oxide hybrid as Fenton-like catalyst [J]. Journal of Hazardous Materials, 2017,324:653-664.
[29] Khan A. Highly efficient a-Mn2O3@a-MnO2-500nanocomposite for peroxymonosulfate activation: comprehensive investigation of manganese oxides [J]. Journal of Materials Chemistry A, 2018,6: 1590-1600.
[30] Zhao Z W, Zhao J H, Yang C. Efficient removal of ciprofloxacin by peroxymonosulfate/Mn3O4-MnO2catalytic oxidation system [J]. Chemical Engineering Journal, 2017,327:481-489.
致谢:本实验的所有实验工作全部都在福建省工业废水生化处理工程技术研究中心完成,并得到了华侨大学分析测试中心在FTIR测定上给予的支持,在此表示感谢.
Degradation of LAS in wastewater by peroxymonosulfate activated by MnFe2O4.
SHE Yue-cheng1,2, DONG Zheng-yu1,2, WU Li-ying1,2, WANG Ji1,2, ZHANG Qian1,2, HONG Jun-ming1,2*
(1.Department of Environmental Science and Engineering, Huaqiao University, Xiamen 361021, China;2.Industrial Wastewater Treatment Engineering Research Center of Fujian Provincial, Xiamen 361021, China)., 2019,39(8):3323~3331
The Fe-Mn bimetallic composite catalyst MnFe2O4was prepared by co-precipitation method, applied to active peroxymonosulfate (PMS) to generate strong oxidizing sulfate radicals (SO4−·) for oxidative degradation of anionic surfactants (LAS) in water. The catalysts were characterized by Fourier transform infrared spectroscopy (FTIR), X-ray powder diffractometry (XRD) and scanning electron microscopy (SEM). It was indicated that the catalyst with MnFe2O4spinel structure was successfully synthesized. Effects of various factors such as catalyst dosage, PMS dosage and initial pH on the degradation efficiency and reaction kinetics of LAS were investigated. The experimental results showed that the MnFe2O4activates PMS to degrade LAS in accordance with quasi-first-order kinetics (2>0.9). The LAS degradation efficiency can reached 94.1% within 60 min when the initial concentration of LAS was 80mg/L, the catalyst dosage was 2.0g/L, the concentration of PMS was 2.5mmol/L, and the initial pH was 7.0. The degradation rate constant reached 0.192min-1. The active species that plays a major role in oxidative degradation in MnFe2O4/PMS system was identified as SO4−· by radical quenching experiment. By the X-ray photoelectron spectroscopy (XPS) analysis of the catalyst before and after the reaction, the synergistic effect between Fe and Mn was confirmed which in order to improve the activation efficiency of PMS by MnFe2O4.
MnFe2O4;PMS;LAS;sulfate radical
X703.5
A
1000-6923(2019)08-3323-09
佘月城(1995-),男,安徽芜湖人,硕士研究生,主要从事水污染控制工程研究.
2019-01-22
福建省科技计划项目(2017I01010015);厦门科技计划项目(3502Z20173050,3502Z20173052,3502Z20183023);泉州市科技计划项目(2018Z002);华侨大学研究生科研创新基金资助项目(18014087018)
* 责任作者, 教授, jmhong@hqu.edu.cn
