SnS2/a-Al2O3对酸性废水中汞离子的去除机制
2019-08-28陈丽红徐浩淼刘筱霜晏乃强
陈丽红,徐浩淼*,杨 波,刘筱霜,刘 萍,瞿 赞,晏乃强
SnS2/-Al2O3对酸性废水中汞离子的去除机制
陈丽红1,徐浩淼1*,杨 波2,刘筱霜1,刘 萍1,瞿 赞1,晏乃强1
(1.上海交通大学环境科学与工程学院,上海 200240;2.潍坊安健安全技术咨询有限公司,山东 潍坊 261061)
基于硫化物与汞亲和性较强的特性,构建了SnS2/-Al2O3复合型除汞吸附剂材料.实验结果表明,该复合材料对Hg2+的最大吸附容量可达950mg/g,其吸附效果不受pH值 (酸性pH=1~6) 影响,汞浓度为65mg/L 时,均能达到近100%的汞去除效率.同时,吸附过程不会受其他金属离子(Cd2+、Cr3+、Zn2+、Cu2+、Pb2+、Ni2+、Co2+等)的强烈干扰,汞浓度为1mmol/L条件下,汞的去除速率及效率均未有很大差距.吸附过程未有大量Sn2+析出,证明了该复合材料的酸性稳定性.通过吸附动力学以及吸附机制研究表明,该吸附过程为单层化学吸附.通过盐酸溶液浸泡洗涤,可以实现SnS2/-Al2O3复合材料的再生和循环使用.
硫化物;吸附剂;酸性废水;汞离子;层状结构
汞因具有高毒性、高挥发性、易迁移性和高生物累积性等特点,容易进入环境中,造成全球性汞迁移和转化,对生态环境和人体健康产生严重危害[1-3].因此,国际社会也一直通过努力形成一种国际性公约,在全球范围内减少来自于人为源向自然界的汞排放行为[4-5].《关于汞的水俣公约》已经正式生效,中国作为全球最大的汞排放国,减汞行动迫在眉睫[6].工业生产是水环境中最主要的汞的人为污染源[7-8].矿山、冶炼、电解、制革等行业生产过程以及末端排放均会产生一定量的含汞工业废水[9-10].尤其是在有色冶炼过程中,将产生大量的含汞废水,该酸性废水不仅含汞浓度高,同时还含有汞、铬、铅等有毒重金属离子,常规的方法难以处置.
目前,许多方法已被用于去除废水中的汞离子,如化学沉淀、离子交换、吸附、膜分离和电化学处理等[11-14].吸附法具有操作简便,相对高效且经济等优点[15-18].硫元素对汞离子有一种很强的亲和力,因此,硫化物一直是备受关注的除汞吸附剂[11,19].有着类石墨烯片状结构的过渡金属硫族化合物,如MoS2、MoSe2、SnS、SnS2等,具有比表面积大、吸附能力强、制备方法简单、循环利用率高等特点,因此在吸附领域有很大的研究意义和广阔的应用前景.目前该类金属硫化物应用于有机染料吸附去除的研究较多,徐海燕[20]制备MoS2纳米片吸附甲基橙,饱和吸附容量为139.44mg/g. SnS2在酸性溶液中具有良好的化学稳定性和在空气中的热稳定性,而且无毒[21].李熙[22]研究表明SnS2单晶纳米片对罗丹明B、孔雀石绿、藏红T等表现出很强的吸附性能.Ekashmi Rathore 和 Kanishka Biswas[23]制备的GO@SnS2吸附剂可用于0.3ppb浓度级别废水Hg(II)的吸附去除,吸附效率可达99%.Al2O3作为“地球丰富”材料,具有耐酸性,优良的电子受体等特性,已被广泛用作辅助支撑材料[24-25].Xu[14]等通过原位负载制备新型吸附剂Al2O3/ZnS,用于吸附Cu2+,-Al2O3作为载体的作用是便于吸附剂吸附后从溶液中分离,无吸附作用.因此,在本研究中,选择商用-Al2O3作为载体,SnS2为有效吸附成分,构建了SnS2/-Al2O3复合材料,对其进行了吸附汞离子效果研究,进而考察了吸附效果影响因素.此外,通过吸附热力学、吸附动力学和XPS等的分析来探究该复合型材料对汞离子的吸附机理.
1 材料与方法
1.1 SnS2的合成
通过水热法合成SnS2[26].称取2.1g SnCl4·5H2O和3.0g TAA(硫代乙酰胺)溶解于120mL去离子水中,超声处理20min,使其完全溶解.然后将混合液转移至200mL容量的不锈钢高压釜中,将高压釜密闭,并在180℃下保持搅拌12h,自然冷却至室温后,混合液经过数次去离子水和无水乙醇离心洗涤,收集到的黄色产物在60℃下真空干燥10h.根据SnCl4·5H2O摩尔量理论值计算得SnS2的最终产率达到89.5%.
1.2 SnS2/a-Al2O3的合成
选择耐酸性-Al2O3(200 nm)作为SnS2吸附剂的载体.SnS2/-Al2O3仍然通过水热法合成,将-Al2O3粉末的质量分别设定为SnCl4×5H2O质量的10%,20%和30%,合成步骤与纯SnS2的合成步骤相同.
1.3 表征方法
XRD分析采用具有Cu-Kα辐射的X射线衍射仪(Shimadzu XRD-6100);BET分析采用比表面积孔径测定仪(Quantachrome Instruments NOVA 2200e); FT-IR分析采用傅氏转换红外线光谱分析仪(Nicolet6700);SEM和EDS分析采用扫描电子显微镜(JSM-7001F);TEM分析采用透射电子显微镜(JEM-2100F);XPS分析采用射线光电子能谱仪(AXISUltraDLD X);离子浓度通过等离子发射光谱仪(ICP-OES 5110)测定.
1.4 吸附实验
表1为本研究调研的某铅锌冶炼厂酸性废水中所含的主要污染物及浓度,可以看出汞离子浓度介于10~100mg/L之间,对于工业废水,汞污染主要以Hg2+形式为主,因此本研究依据实际酸性含汞废水所含污染物状况,选择HgSO4作为代表性的汞污染物.所有的批次吸附实验的完成是通过将一定量的所合成的吸附剂加入到一定初始浓度的HgSO4溶液中,并在室温下搅拌(300r/min),在不同反应时间对溶液取样,通过过滤器(孔径: 220nm)过滤,最后通过汞分析仪(RA915,St. Petersburg,Russia)分析溶液样品中汞离子浓度.
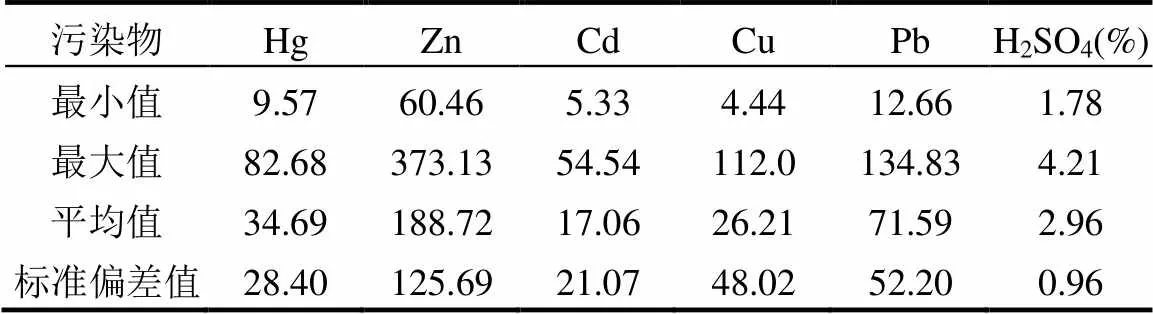
表1 某铅锌冶炼厂酸性废水中的主要污染物及浓度(mg/L)
实验过程,溶液的pH值通过H2SO4调节.汞离子去除效率用来表示,按式(1)计算:
=(0-e)/0×100% (1)
式中:0为吸附前溶液中汞离子浓度,mg/L;e为吸附后溶液中汞离子溶度,mg/L.
通过将20.0mg吸附剂加入100mL初始浓度为50.0~350.0mg/L的汞溶液中进行汞离子的批次吸附等温实验.在室温pH值为2的条件下,以300r/min转速搅拌24h,达到吸附平衡后,根据式(2)计算吸附剂的吸附容量,并运用吸附模型进行吸附曲线拟合,吸附等温曲线Langmuir模型和Freundlich模型如式(3)和式(4)[27]:
e=(0-e)×/(2)
式中:e为单位质量吸附剂上的吸附量,mg/g;0为吸附前溶液中Hg2+离子浓度,mg/L;e为吸附后溶液中Hg2+离子浓度,mg/L;为溶液体积,L;为吸附剂投加量,g.
e/e=e/m+ 1/(m×L) (3)
lne= lnF+1/×lne(4)
式中:e为吸附后溶液中Hg2+离子浓度,mg/L;e为单位质量吸附剂上的吸附量,mg/g;m为最大吸附量,mg/g;L,F为两种模型的吸附常数;1/为Freundlich吸附模型中的强度参数.
将50mg SnS2/-Al2O3(20%)加入到100mL的初始Hg2+浓度为200mg/L的硫酸汞溶液中,对其吸附过程进行动力学分析.通过准一级动力学模型、准二级动力学模型和内扩散模型研究SnS2/-Al2O3复合材料对Hg2+的吸附动力学,吸附动力学方程如式(5)、(6)和(7)[2,28]:
log(e-Q) = loge–1×(5)
/Q= 1/(2×e2) +/e(6)
Q=k×0.5(7)
式中:e为平衡时的吸附量,mg/g;Q为时间时的吸附量,mg/g;为反应时间,min;1,2,k为3种模型的速率常数.
2 结果与讨论
2.1 材料表征
通过X射线衍射(XRD)表征样品的晶体结构.图1中, SnS2的XRD图谱中显示的一系列衍射峰,2这表明了该复合材料的高纯度.
通过扫描电子显微镜(SEM)和能量色散X射线光谱(EDS)表征样品的一般形态和元素组成.图2a)清楚地显示不规则的片状SnS2包裹在-Al2O3上生长.SnS2/-Al2O3(20%)的EDS分析如图2b)所示,检测到样品中主要元素Sn、S、Al和O存在,而且Sn和S原子比例接近1:2,符合SnS2的元素比例组成. 透射电子显微镜(TEM)用于验证样品的微观结构.图2c)可以清楚地发现六方结构的SnS2和不规则的-Al2O3,并显示两者完全混合.图2d)中显示出的主要不同条纹间距0.35、0.28nm分别与SnS2和-Al2O3的XRD计算结果一致,进一步证实了SnS2成功负载在-Al2O3上.
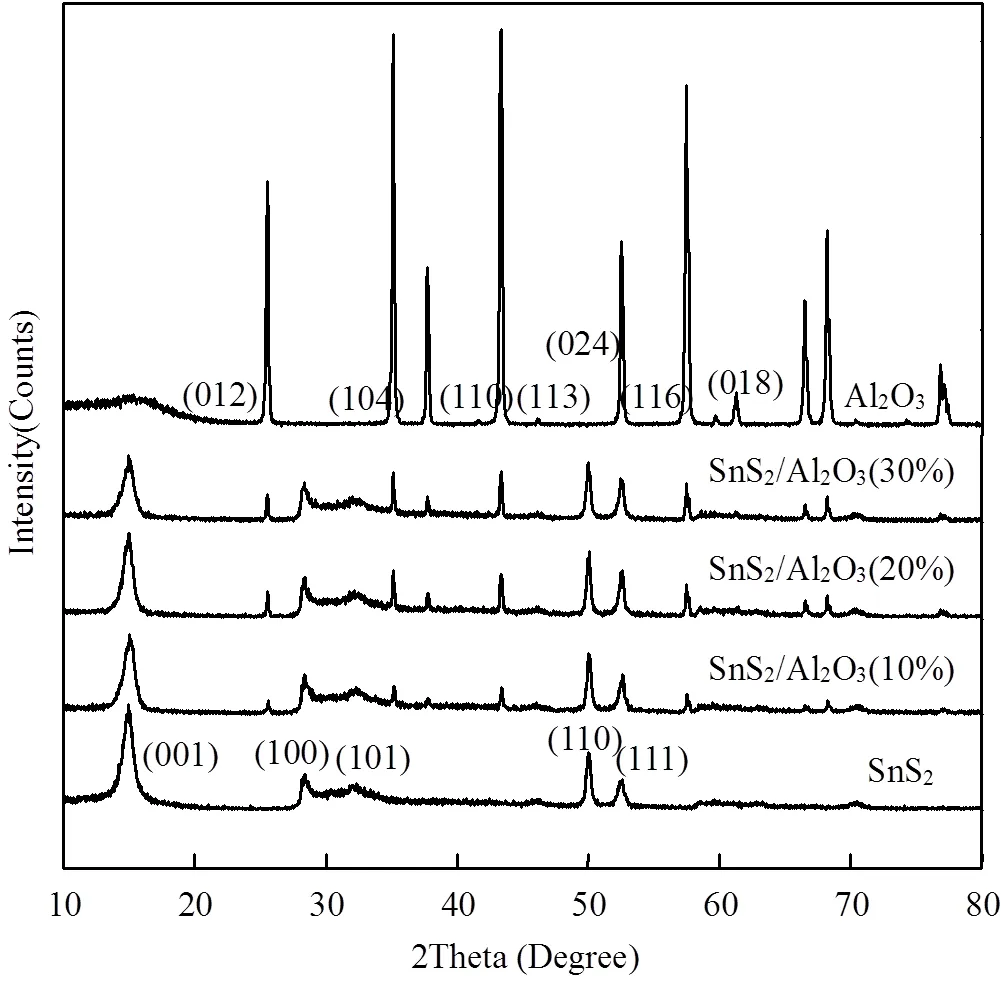
图1 5种吸附剂样品的XRD谱图

图2 SnS2/a-Al2O3(20%)的SEM图、EDS图和TEM图
a) SEM图;b) EDS图;c)和d) TEM图
表2给出了4种不同样品的BET比表面积和孔径结构分析结果,SnS2的比表面积和孔隙率分别为40.768m2/g和0.1043cm3/g.掺杂不同含量的氧化铝后,SnS2/-Al2O3复合材料的比表面积和孔隙率均高于纯SnS2,这可归因于辅助支撑材料

表2 3种样品吸附剂的BET表面积、孔隙率和孔径
2.2 SnS2/α-Al2O3脱除Hg2+效果
考察了SnS2/D3(20%)复合材料对不同初始浓度硫酸汞溶液中汞离子的去除效果.如图3所示,Hg2+初始浓度为6mg/L时,5min内去除效率几乎为100%,且随着吸附时间的增加,去除效率保持不变,1h内保持吸附稳定性.而Hg2+初始浓度为60mg/L时,5min时的去除效率不到60%,在反应30min时几乎可全部去除.对于更高的Hg2+初始浓度(160mg/L),5min内的去除效率更低,1h达到约90%的去除效率.因此,低浓度时,5min内即可达到完全去除的效果,随着Hg2+初始浓度的增加,去除速率变慢.但是仍说明,SnS2/.

图3 不同初始Hg2+浓度时吸附剂对Hg2+的去除率
SnS2/α-Al2O3(20%),50mg;溶液体积,100mL;25℃;pH 1.5
2.3 SnS2/α-Al2O3脱除Hg2+的影响因素
2.3.1 pH值对吸附效率的影响 针对酸性废水的处置,考察了酸性废水条件下的去除效果,设置pH值的范围为1~6.如图4所示,在溶液pH低于7时,无论pH值为多少,Hg2+去除效率均可达到近100%.这说明在酸性前提下,汞溶液pH值对SnS2/-Al2O3复合材料去除Hg2+效率并无影响.
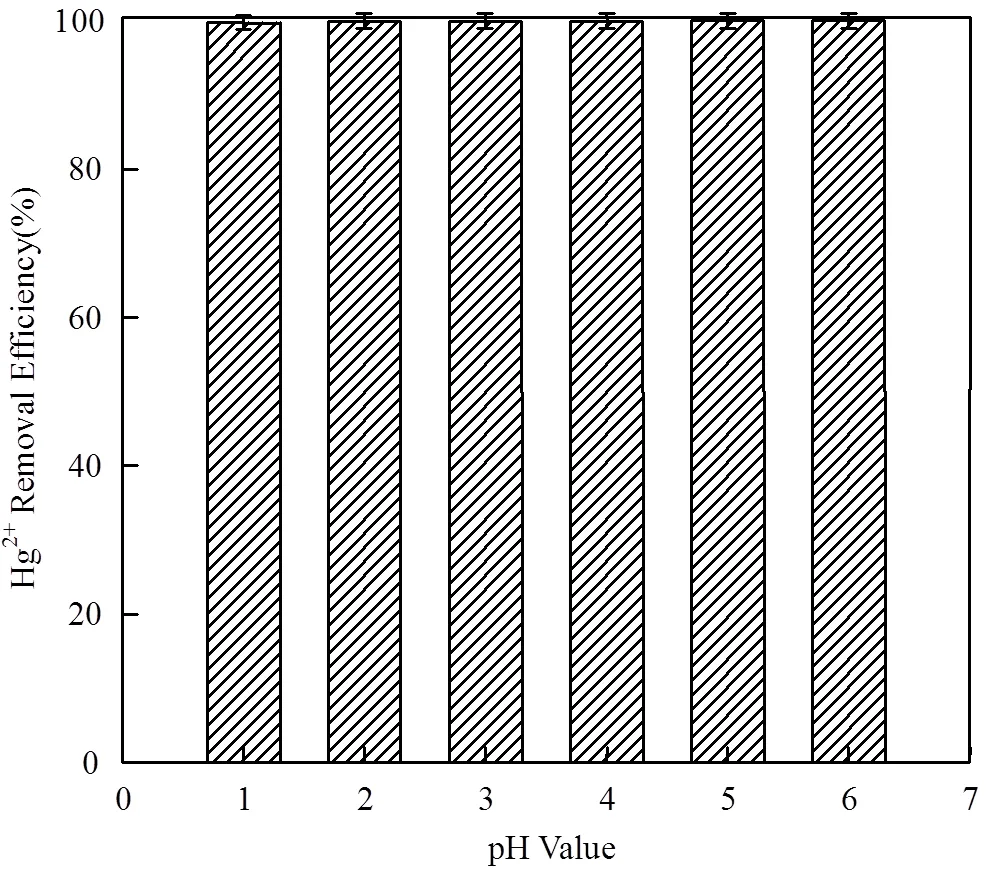
图4 pH值对Hg2+去除效果的影响
Hg2+浓度,65.0mg·L-1;SnS2/α-Al2O3(20%),50mg;溶液体积,100mL;反应时间,1h;25℃
考察了吸附剂在酸性条件下的稳定性,如表3所示,随着pH值的变化,无大量的Sn2+溶出,说明SnS2/-Al2O3在酸性条件下仍保持结构的稳定性.此性质有利于SnS2/-Al2O3复合材料对酸性废水中Hg2+的脱除.
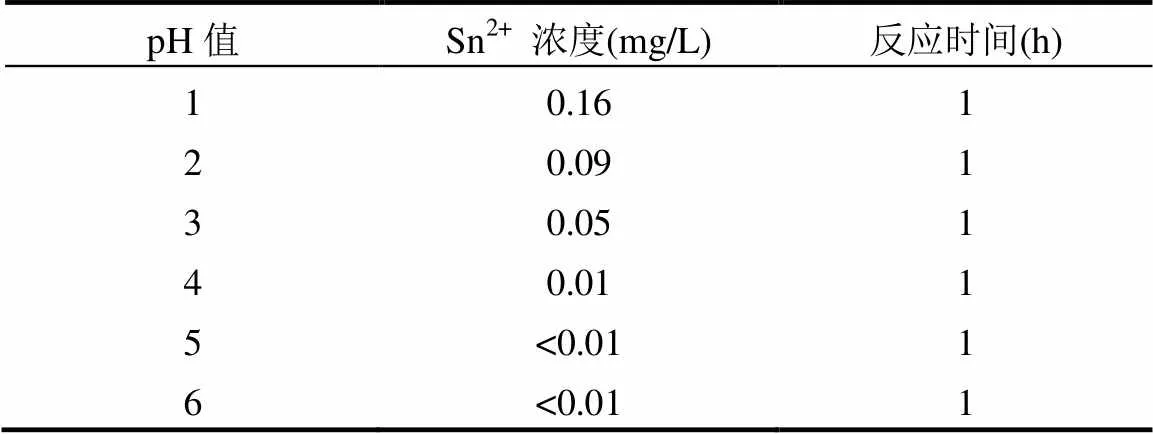
表3 不同pH值条件下的溶液中Sn2+浓度变化
注: SnS2/-Al2O3(20%),50mg;溶液体积,50mL;反应时间,1h;25℃
2.3.2 其他金属离子对吸附效果的影响 为了研究其他金属阳离子对SnS2/-Al2O3复合材料去除Hg2+的影响,分别在HgSO4溶液中加入CdCl2、CrCl3、ZnSO4、CuSO4、Pb(NO3)2、Ni(NO3)2、Co(NO3)2,Hg2+与所加入的金属阳离子浓度均为1mmol/L.根据图5可知,即使存在其他金属阳离子,1h内,吸附剂对Hg2+的去除速率和效率都未受到明显影响.
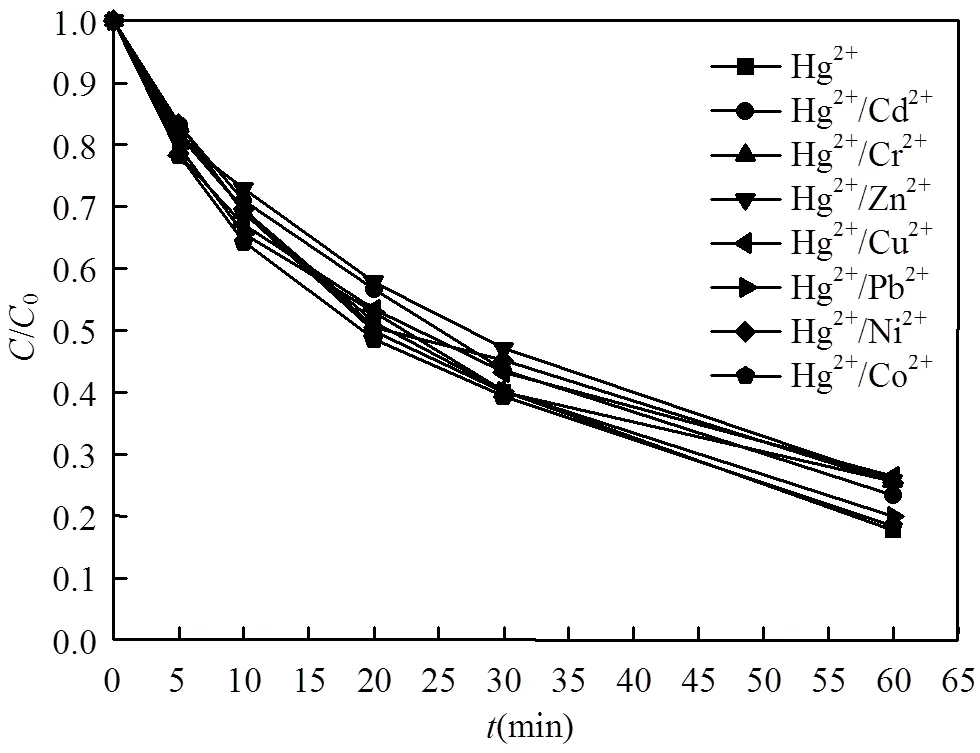
图5 其他金属离子对Hg2+去除效果的影响
Hg2+浓度,1mmol/L; SnS2/-Al2O3(20%),50mg;溶液体积,100mL;pH=2.0;25℃
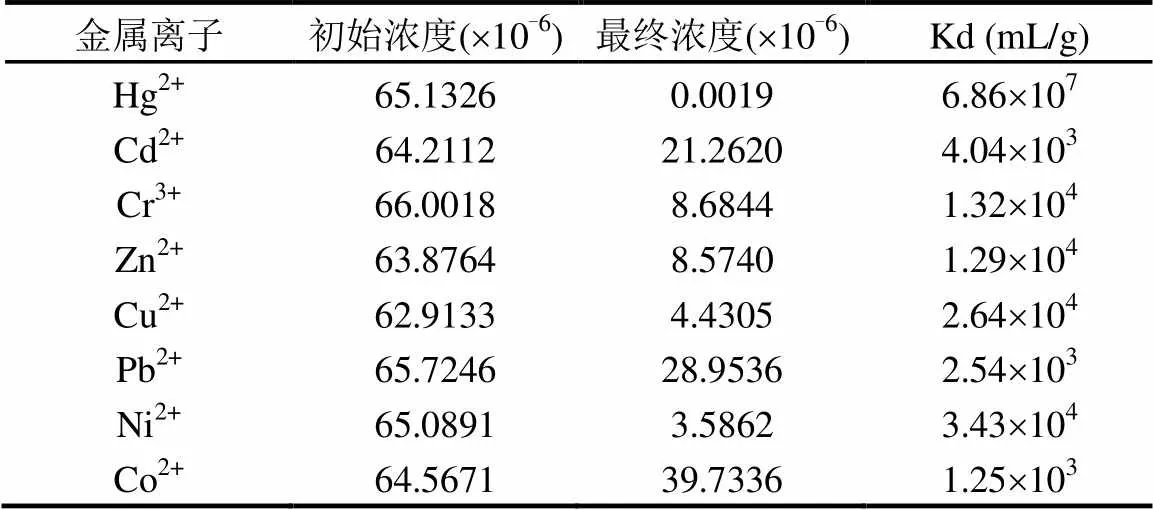
表4 多种金属阳离子共存条件下在SnS2/a-Al2O3复合材料上的竞争吸附
注: SnS2/-Al2O3(20%),50mg;溶液体积,100mL;反应时间,24h;25℃.
分配系数d(式(8))可评估在竞争金属离子共存条件下,吸附剂SnS2/-Al2O3对Hg2+的选择性程度.
d= (/)(0-e)/e(8)
通过将50mg的SnS2/-Al2O3吸附剂加入到60mg/L的100mL金属阳离子混合液中反应24h研究吸附剂对Hg2+吸附的选择性.表4结果表明SnS2/-Al2O3对Hg2+的分配系数远高于其他金属阳离子,因此这些金属离子与Hg2+共存时, SnS2/-Al2O3对Hg2+的吸附效果无明显变化.
2.4 吸附容量、吸附等温线、吸附动力学

表5 与文献报道的部分金属硫化物吸附剂对Hg2+吸附容量对比
图6a)的吸附等温曲线显示,SnS2/-Al2O3(20%)复合吸附剂的最大吸附容量达950mg/g.根据实验数据进行两大经典吸附模型Langmuir和Freundlich模型的拟合,结果表明SnS2/-Al2O3吸附剂对Hg2+的吸附与Langmuir模型相匹配,相关系数2等于1.该结果说明吸附质部分在吸附剂表面上经历单层覆盖,而且一旦吸附位点被占据,则在同一位置上不会发生进一步的吸附.此外,根据Langmuir模型拟合线的斜率1/m=0.00105,推算出理论最大吸附量为952mg·g-1,与实际测得的最大吸附容量相近.如表5,SnS2/-Al2O3吸附剂与部分文献已报道过的金属硫化物吸附剂相比,在酸性条件下,吸附容量具有明显的优势,此特点有利于该吸附剂的工业化运用.

a)吸附等温线;b) Langmuir和Freundlich模型线性拟合平衡等温线; c) SnS2/-Al2O3对Hg2+反应时间的吸附曲线; d)吸附的准二级动力学拟合图; e)内扩散模型拟合曲线
图6b)的吸附过程动力学分析结果表明,无论是低浓度还是高浓度情况下,SnS2/-Al2O3吸附剂对Hg2+的吸附现象可以很好地与pseudo-second-order动力学匹配,说明Hg2+在吸附剂结合位点上的吸附过程基本上由化学吸附控制.综上,Hg2+吸附于SnS2/-Al2O3复合材料特定位点上,遵循单层化学吸附.图6c)的内扩散拟合结果不经过原点,且可分为三阶段描述:第一阶段为快速的膜扩散过程,第二阶段为变慢的吸附剂表面吸附,第三阶段则为缓慢的内扩散直至达到吸附平衡.结果说明内扩散不是控制该吸附过程的唯一步骤.
2.5 Hg2+脱除机理
对吸附汞前后SnS2/-Al2O3吸附剂的XRD谱图进行对比分析(图7),发现Al2O3及SnS2的衍射峰均未消失,因为SnS2/-Al2O3复合物仍然完整.图谱中出现在2=18.10°和21.57°的2个新衍射峰,它们归因于SnS2-Hg[32].
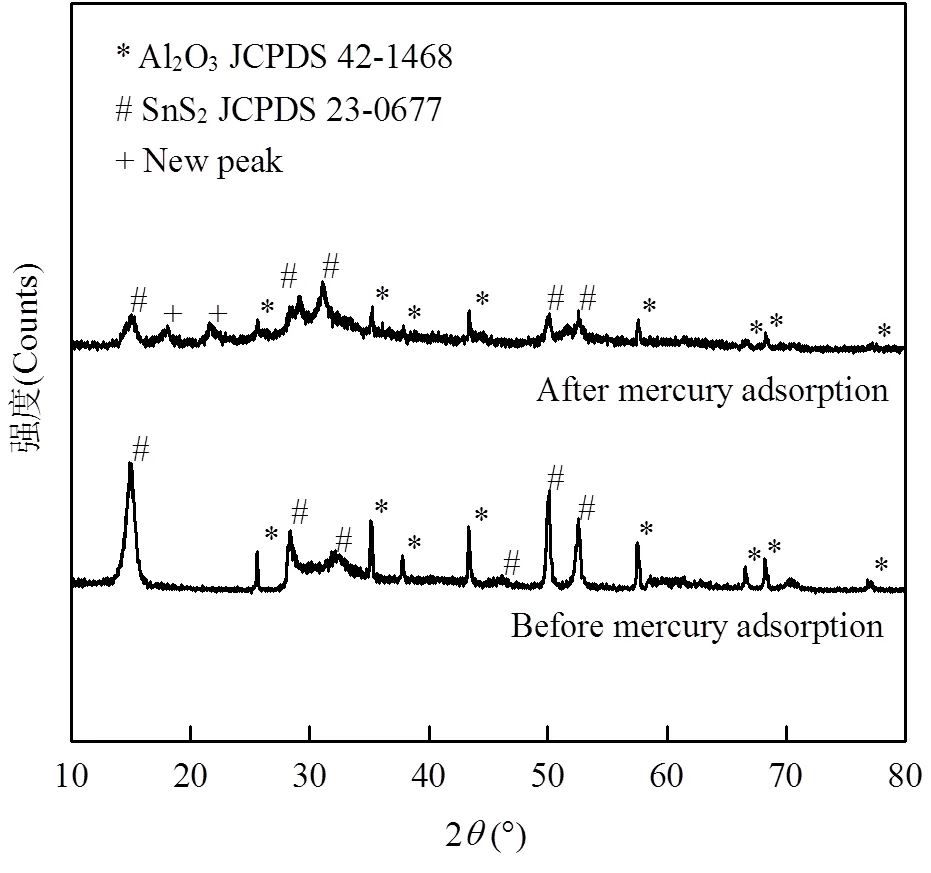
图7 吸附汞前后SnS2/a-Al2O3(20%) XRD谱图

图8 吸附汞后SnS2/a-Al2O3(20%)的a) TEM图和b) HRTEM图

a) Sn 3d; b) S 2p; c) O 1s; d) Al 2p; e) Hg 4f.
图8(a)为吸附Hg2+后的SnS2/-Al2O3吸附剂的TEM图,表明汞离子已经吸附于吸附剂上,图8(b)中HRTEM图中所显示的晶格间距0.57、0.44和0.42nm,比未进行吸附反应的SnS2/-Al2O3复合材料的层间距大,这归因于Hg2+进入了层间导致晶格膨胀.据文献推测Hg2+与SnS2/-Al2O3接触后,和周围的硫原子形成了共价键的关系[3,33].
SnS2/-Al2O3复合材料吸附Hg2+前后的XPS图谱反映其化学组成以及键合构型变化.图9a)的XPS光谱中,对于纯SnS2/-Al2O3的Sn 3d的2个典型峰486.38eV(Sn 3d5/2)和494.82eV(Sn 3d3/2),分别归因于Sn-S键和Sn-O键,这证实了Sn元素主要以Sn4+形式存在于SnS2/-Al2O3复合材料中[34].吸附Hg2+后,SnS2/-Al2O3的Sn 3d的XPS峰值移至487.04和495.48eV,比吸附前高0.66eV.图9b)显示S 2p的峰位于161.44和162.60eV,分别对应S 2p3/2和S 2p1/2,说明SnS2/-Al2O3复合材料中S以S2-形式存在[21].吸附Hg2+后,S的相应的2个峰比吸附前高1.0eV.此外图9c)、9d)中O 1s和Al 2p在531.7和74.36eV的峰说明Al和O对应于Al2O3.XPS的分析再次证实了SnS2/-Al2O3复合材料中SnS2和-Al2O3的共存.图9e)中2个特征峰100.83和104.90eV是由于Hg2+的存在[21].吸附Hg2+之后的SnS2/-Al2O3的Sn 3d和S 2p的XPS峰值比吸附前分别高0.66和1.0eV,这可归因于SnS2与Hg2+之间的相互作用,形成新的物质.根据以上分析结果,可以推测如式(9)的反应式:
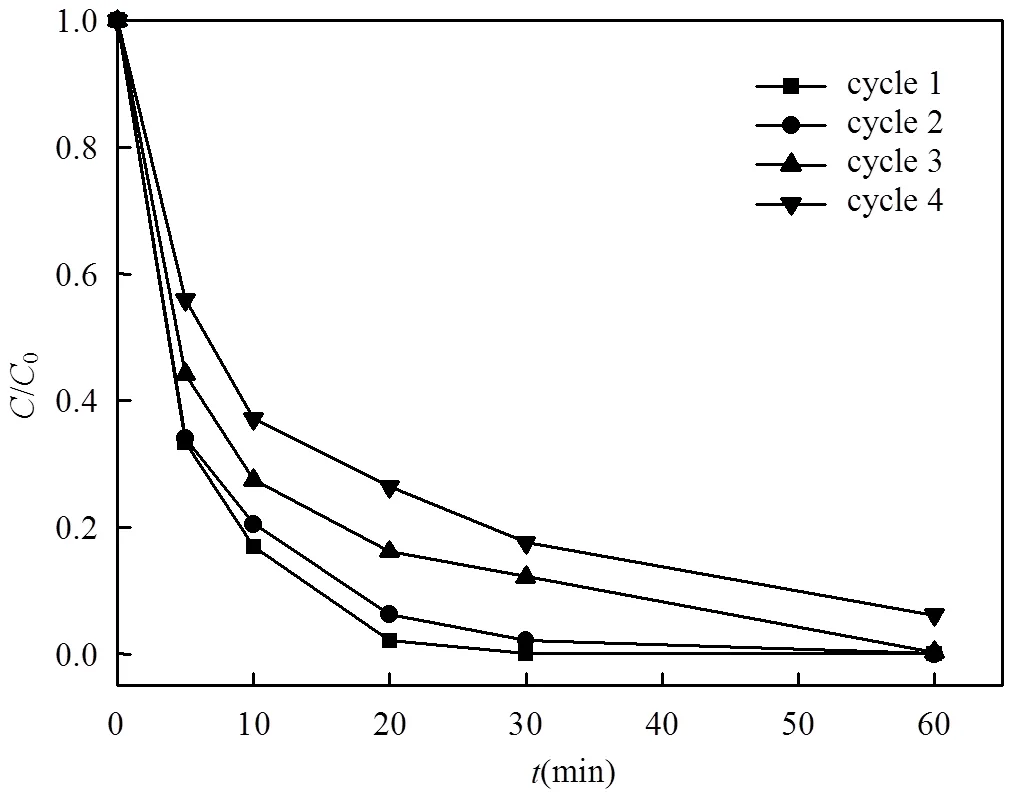
图10 吸附剂的再生与循环利用
Hg2+浓度, 66.0mg/L;SnS2/-Al2O3(20%), 50mg;溶液体积, 100mL; pH 2.0; 25℃
Sn4+-S2-+Hg2+→ Sn4+-HgS (9)
2.6 SnS2/a-Al2O3吸附剂的再生
将吸附Hg2+的SnS2/-Al2O3于HCl溶液(1mol/L)中混合搅拌再生,化学分析表明,再生后的SnS2/-Al2O3吸附剂中仅含0.05%的汞,且经过4个循环的再生和再利用后,再生的SnS2/-Al2O3吸附性能仍是完整的,由于不能完成彻底的脱附,随着脱附循环再生次数的增加,吸附剂的吸附速率有所下降,但整体上,1h内的吸附效率仅有略微的下降(图10).因此, SnS2/-Al2O3复合材料可反复吸附、脱附汞离子,可循环使用.
3 结论
3.1 通过水热法合成SnS2,并原位负载于-Al2O3,制备出复合材料SnS2/-Al2O3. XRD、EDS、SEM、TEM等表征结果表明,该复合材料中的SnS2与-Al2O3完全混合,且仍然保持六方层状结构,- Al2O3增大了材料的比表面积.
3.2 在汞离子浓度较低情况下,SnS2/-Al2O3复合材料,可快速高效去除汞离子,随着一定汞离子浓度的增加,吸附速率虽有所下降,但最大吸附容量可达950mg/g.
3.3 SnS2/-Al2O3复合材料吸附效果不受pH值及其他金属离子的影响.此外, SnS2/-Al2O3在酸性条件下仍保持结构的稳定性.
3.4 热力学与动力学模型拟合结果表明, SnS2/- Al2O3吸附剂对汞离子的吸附过程可用Langmuir模型和准二级动力学模型描述,对比吸汞前后吸附剂的XRD、TEM及XPS分析,表明该过程为单层化学吸附过程.
[1] Tian M Z, Liu L B, Li Y J, et al. An unusual OFF–ON fluorescence sensor for detecting mercury ions in aqueous media and living cells [J]. Chemical Communications, 2014,50(16):2055-2057.
[2] Jia F F, Wang Q M, Wu J S, et al. Two-Dimensional Molybdenum Disulfide as a Superb Adsorbent for Removing Hg2+from Water [J]. ACS Sustainable Chemistry & Engineering, 2017,5(8):7410-7419.
[3] Zhi L H, Zuo W, Chen F J, et al. 3D MoS2composition aerogels as chemosensors and adsorbents for colorimetric detection and high-capacity adsorption of Hg2+[J]. ACS Sustainable Chemistry & Engineering, 2016,4(6):3398-3408.
[4] Wang M, Wang Z Q, Wu G H, et al. Synthesis and application of magnetic adsorbent for mercury ions [J]. Environmental Chemistry, 2016,35(3):540-547.
[5] Tao X, Li K, Yan H, et al. Simultaneous removal of acid green 25 and mercury ions from aqueous solutions using glutamine modified chitosan magnetic composite microspheres [J]. Environmental Pollution, 2016,209:21-29.
[6] Li S X. Preliminary analysis on the status and implementation gap of mercury-containing waste management in China [J]. Science and Technology Innovation Herald, 2017,14(2):125-127.
[7] Tahmasebi E, Masoomi M Y, Yamini Y, et al. Application of mechanosynthesized azine-decorated zinc II) metal–organic frameworks for highly efficient removal and extraction of some heavy-metal ions from aqueous samples: a comparative study [J]. Inorganic chemistry, 2014,54(2):425-433.
[8] Trasande L, DiGangi J, Evers D C, et al. Economic implications of mercury exposure in the context of the global mercury treaty: hair mercury levels and estimated lost economic productivity in selected developing countries [J]. Journal of environmental management, 2016,183:229-235.
[9] Hu J S, Zhang H L, Tian Y L, et al. Preparation of New Chitosan/ Diatomite Composite Materials and Their Adsorption Effect on Mercury Ions [J]. Journal of Northeastern University Nature Science, 2017,38(9):1289-1292.
[10] Sun M Y, Hou J A, Cheng S A, et al. The relationship between speciation and release ability of mercury in flue gas desulfurization FGD) gypsum [J]. Fuel, 2014,125:66-72.
[11] Gong Y Y, Liu Y Y, Xiong Z, et al. Immobilization of mercury by carboxymethyl cellulose stabilized iron sulfide nanoparticles: reaction mechanisms and effects of stabilizer and water chemistry [J]. Environmental science & technology, 2014,48(7):3986-3994.
[12] Fang L, Li L, Qu Z, et al. A novel method for the sequential removal and separation of multiple heavy metals from wastewater [J]. Journal of hazardous materials, 2018,342:617-624.
[13] Ma L J, Islam S M, Xiao C L, et al. Rapid Simultaneous Removal of Toxic Anions [HSeO3]−,[SeO3]2–, and [SeO4]2–, and Metals Hg2+, Cu2+, and Cd2+by MoS42–Intercalated Layered Double Hydroxide[J]. Journal of the American Chemical Society, 2017,139(36):12745-12757.
[14] Xu J F, Qu Z, Yan N Q, et al. Size-dependent nanocrystal sorbent for copper removal from water[J]. Chemical Engineering Journal, 2016, 284:565-570.
[15] Sun Y, Lv D, Zhou, J S, et al. Adsorption of mercury (II) from aqueous solutions using FeS and pyrite: A comparative study [J]. Chemosphere, 2017,185:452-461.
[16] Abu-Danso E, Peräniemi S, Leiviskä T, et al. Synthesis of S-ligand tethered cellulose nanofibers for efficient removal of Pb (II) and Cd (II) ions from synthetic and industrial wastewater [J]. Environmental Pollution, 2018,242:1988-1997.
[17] Qu Z, Fang L, Chen D Y, et al. Effective and regenerable Ag/graphene adsorbent for Hg (II) removal from aqueous solution [J]. Fuel, 2017,203:128-134.
[18] Gao P, Gao B B, Gao J Q, et al. Chitosan and Its Composites for Removal of Mercury Ion from Aqueous Solution [J]. Progress in Chemistry, 2016,12:1834-1846.
[19] Oh Y, Bag S, Malliakas C D, et al. Selective surfaces: High- surface-area zinc tin sulfide chalcogels [J]. Chemistry of Materials, 2011,23(9):2447-2456.
[20] Xu H Y. Preparation of MoS2Nanosheets and Study on its Adsorption Capability [D]. 2014. Chongqing University, Chongqing, China.
[21] Zhang Z Y, Shao C L, Li X H, et al. Hierarchical assembly of ultrathin hexagonal SnS2nanosheets onto electrospun TiO2nanofibers: enhanced photocatalytic activity based on photoinduced interfacial charge transfer [J]. Nanoscale, 2013,5(2):606-618.
[22] Li X. Studies on the photocatalytic performance and mechanism of metal sulfides and their modified TiO2[D]. 2012. East China Normal University.
[23] Ekashmi R, Kanishka B. Selective and ppb Level Removal of Hg(II) from Water: Synergistic Role of Graphene Oxide and SnS2[J]. Journal of Materials Chemistry A, 2018,6:13142-13152.
[24] Shekhar M, Wang J, Lee W S, et al.Size and support effects for the water–gas shift catalysis over gold nanoparticles supported on model Al2O3and TiO2[J]. Journal of the American Chemical Society, 2012,134(10):4700-4708.
[25] Li F T, Zhao Y, Wang Q, et al. Enhanced visible-light photocatalytic activity of active Al2O3/g-C3N4heterojunctions synthesized via surface hydroxyl modification [J]. Journal of hazardous materials, 2015,283:371-381.
[26] Qiu F Z, Li W J, Wang F Z, et al. In-situ synthesis of novel Z-scheme SnS2/BiOBr photocatalysts with superior photocatalytic efficiency under visible light [J]. Journal of colloid and interface science, 2017,493:1-9.
[27] Xiao R. Adsorption of Hg2+Ions from Aqueous Solution by Urea Doped Activated Carbon [J]. Guangzhou Chemical Industry, 2017,23:019.
[28] Jawad A, Liao Z W, Zhou Z H, et al. Fe-MoS4: an effective and stable LDH-based adsorbent for selective removal of heavy metals [J]. ACS applied materials & interfaces, 2017,9(34):28451-28463.
[29] Zhang Z Y, Huang J D, Zhang M, et al. Ultrathin hexagonal SnS2nanosheets coupled with g-C3N4nanosheets as 2D/2D heterojunction photocatalysts toward high photocatalytic activity [J]. Applied Catalysis B: Environmental, 2015,163:298-305.
[30] Li F T, Zhao Y, Hao Y J, et al. N-doped P25TiO2–amorphous Al2O3composites: One-step solution combustion preparation and enhanced visible-light photocatalytic activity [J]. Journal of hazardous materials, 2012,239:118-127.
[31] Duan Y, Han D S, Batchelor B, et al. Application of a Reactive Adsorbent-Coated Support System for Removal of Mercury(II) [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016,509:623-630.
[32] Rathore E, Biswas K. Selective and ppb level removal of Hg(ii) from water: synergistic role of graphene oxide and SnS2[J]. Journal of Materials Chemistry A, 2018,6(27):13142-13152.
[33] Huang X Q, Kong L, Huang S Q, et al. Metal Sulfide Nanomaterials Based Adsorbent [J]. Progress in Chemistry, 2017,29(1):83-92.
[34] Bai Y, Zong X, Yu H, et al. Scalable Low-Cost SnS2Nanosheets as Counter Electrode Building Blocks for Dye-Sensitized Solar Cells [J]. Chemistry–A European Journal, 2014,20(28):8670-8676.
Mechanisms of mercury ions removal from acid wastewater by SnS2/-Al2O3.
CHEN Li-hong1, XU Hao-miao1*, YANG Bo2, LIU Xiao-shuang1, LIU Ping1, QU Zan1, YAN Nai-qiang1
(1.School of Environmental Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China;2.Weifang Anjian Safety Technology Consulting Co., Ltd., Weifang 261061, China)., 2019,39(8):3255~3263
Sulfur-based adsorbents had good affinity to mercury when using for mercury ions capture. The SnS2/-Al2O3composite was successfully prepared and used as adsorbents for Hg2+removal. The adsorption experimental results indicated that the maximum adsorption capacity of such composite was 950mg/g. The Hg2+removal efficiencies were not influenced by pH values. It can achieve nearly 100% mercury removal efficiencies under the pH values of 1~6 (Hg2+: 65mg/L). In addition, the coexisting metal ions (Cd2+, Cr3+, Zn2+, Cu2+, Pb2+, Ni2+, Co2+) had no significant influences on mercury adsorption rate and efficiencies (Hg2+: 1mmol/L). Therefore, it confirmed that SnS2/-Al2O3composite had a good stability under acidiccondition. The adsorption process followed a monolayer chemical adsorption mechanism. Moreover, the composite can be regenerated and recycled using a hydrochloric acid treatment method.
sulfur-based material;adsorbent;acid wastewater;mercury ion;layered structure
X703.5
A
1000-6923(2019)08-3255-09
陈丽红(1993-),女,江西高安人,上海交通大学硕士研究生,主要研究方向为酸性废水汞离子去除研究.发表论文1篇.
2019-01-12
国家重点研发计划项目(2017YFC0210500);国家自然科学基金资助项目(21806105);国家自然科学基金资助项目(21677096)
* 责任作者, 博士后, xuhaomiao@sjtu.edu.cn
