食品中蜡样芽孢杆菌芽孢EMA-qPCR检测
2019-08-28刘新梅程逸宇吴海晶冯秋实南京市食品药品监督检验院
□ 刘新梅 程逸宇 吴海晶 任 敏 冯秋实 杨 军 南京市食品药品监督检验院
蜡样芽孢杆菌(Bacillus cereus)是一种常见的兼性需氧革兰氏阳性致病菌,极易污染乳制品、米饭、水果制品等食品[1]。目前,检测方法主要是传统培养法,耗时费力,难以适应现代食品生产的检验需要。
蜡样芽孢杆菌实时荧光PCR技术因具有检测时间短、操作简便等优点得到广泛运用。蜡样芽孢杆菌在食品中多以芽孢形态存在,常规DNA提取方法很难从蜡样芽孢杆菌芽孢中提取高质量DNA,对PCR检测的灵敏度造成一定的影响。为提高蜡样芽孢杆菌芽孢DNA提取率,增加实时荧光PCR检测灵敏度,本文采用液氮研磨法等方法进行试验,找出适合的提取方法。
qPCR法检测蜡样芽孢杆菌还有一定的局限性,即不能区分检测到的DNA来自于死细胞还是活细胞,这造成qPCR检测法相对于传统分离培养方法存在假阳性情况。为解决这一问题,相继开发出mRNA检测法、免疫法等活菌检测方法,但都存在着各方面不足[2]。叠氮溴化乙锭(EMA)是一种DNA 插入型染料,能够透过细菌破损的细胞膜与DNA相交联,抑制PCR反应的进行。EMA与PCR相结合,可以精确地检测样品中活菌的存在[3]。本文将EMA运用到蜡样芽孢杆菌实时荧光PCR检测中,提高qPCR检测的准确度,降低假阳性率。
1 材料和方法
1.1 菌种
蜡样芽孢杆菌CMCC(B)63301。
1.2 仪器设备
ABI 7500FAST实时荧光PCR仪、生物安全柜、超声波细胞破碎仪、显微镜。
1.3 蜡样芽孢杆菌芽孢的制备
蜡样芽孢杆菌芽孢形成可以通过营养限量进行诱导,在培养基中添加Mn2+能提高芽孢的得率及稳定性。孔雀石绿染色镜检芽孢生成情况。蜡样芽孢杆菌标准菌株活化后,接种到营养肉汤中,培养三代后,取新鲜培养的菌液接种到含Mn2+营养琼脂培养基(蛋白胨5 g,牛肉膏3 g,NaCl 5 g,琼脂 20 g,MnSO4· H2O 5 mg,加水至 1 000 mL,pH 值为 7.2),30 ℃分别培养24、36、48、60 h,观察芽孢生成情况。
1.4 芽孢DNA提取
蜡样芽孢杆菌接种到Mn2+营养琼脂培养基中,30 ℃培养60 h。挑取单个菌落到1 mL灭菌水中,12 000 r/min离心2 min,弃上清,收集菌体,用于下步DNA提取。
1.4.1 液氮研磨法
在收集菌体的离心管中加入液氮冷却,使用研磨棒进行研磨,重复上述操作2次,加入500 μL无菌水,涡旋30 s,12 000 r/min 离心 2 min,取上清用细菌DNA提取试剂盒提取DNA。
1.4.2 溶菌酶法
向收集菌体的离心管加入500 μL无菌水,涡旋30 s,再加入1 μL溶菌酶(100 mg/mL),37 ℃水浴2 h,12 000 r/min离心2 min,取上清提取DNA。
1.4.3 煮沸法
在菌体中加入 500 μL 无菌水,涡旋30 s,置95 ℃水浴 5 min,12 000 r/min 离心2 min,取上清提取DNA。
1.4.4 超声波破碎法
向离心管中加入 500 μL 的无菌水,涡旋30 s,放入超声波细胞破碎仪超声波振荡20 min(40%,5 s,5 s),12 000 r/min 离心 2 min,取上清提取DNA。
1.5 EMA使用浓度优化
用 ddH2O 配 制 0.1 mg/mL 的EMA 溶液,-20 ℃避光保存。取Mn2+营养肉汤中30 ℃培养48 h的蜡样芽孢杆菌菌液于80 ℃水浴中处理20 min,灭活营养体细胞。将EMA(0.1 mg/mL)分别加入装有1 mL上述灭活菌液的离心管中,使EMA 终质量浓度分别达到 0.1、1.0、2.0、5.0、10.0、20.0 μg/mL,不加EMA 的菌液作为对照。充分混匀后,将离心管黑暗中室温放置约5 min,让EMA与细菌DNA充分结合。然后将离心管放置冰上,强光下曝光 20 min,以此为模板采用超声波破碎法提取DNA。
1.6 EMA 光照时间优化
添加EMA到1.5中所述灭活菌液1 mL离心管中,使每管 EMA终浓度达到 2.0μg/mL。充分混匀后,将离心管黑暗中室温放置 5 min。然后将离心管放置冰上,分别强光下曝光 0、1、5、10、20、40 min,不加EMA的菌液作为对照。以此为模板采用超声波破碎法提取DNA。
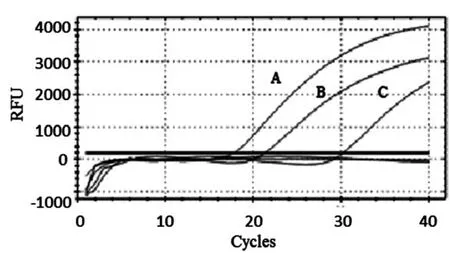
图1 不同DNA提取方法效果比较

图2 不同浓度EMA处理对EMA-qPCR结果影响

图3 不同光照时间处理对EMA-qPCR结果影响
1.7 荧光定量PCR检测
利 用Primer Express 3.0软 件,根据蜡样芽孢杆菌pc-plc基因序列,设计引物和探针(南京金斯瑞生物公司合成)。上游引物:5’-AAAGATTGGTTCGTGAGAGC-3’;下 游 引 物:5’-CGCTTACCTGTC A T T G G T G-3’; 探 针:5’FAM-ACAAGAATATGCAGAT AAATGGCGCGCTG- TAMRA 3’,扩增条带大小163bp。
PCR反应体系:Premix Ex Taq 12.5 μL,引物各 0.5 μL,探针 1 μL,模板 DNA5 μL,无菌水补足 25 μL。PCR反应条件:95 ℃ 3 min,95 ℃ 5 s,58 ℃ 40 s,40 循环。
1.8 人工污染实验
将蜡样芽孢杆菌接种到10 mL鲜牛奶中,37 ℃分别培养24、36、48、60、72 h,80 ℃水浴20 min杀死营养体细胞,在热处理前后分别吸取1 mL样品涂布到MYP培养基上计数。将热处理后的样品分设为EMA处理组(10.0 μg/mL EMA黑暗放置5 min,光照10 min)和无EMA处理,再使用超声波破碎法提取样品蜡样芽孢杆菌芽孢DNA,进行qPCR检测。
2 结果与分析
2.1 芽孢的制备
蜡样芽孢杆菌含Mn2+离子的培养基中培养24、36、48、60 h时,芽孢的生成率分别为0%、41.6%、77.3%、90.1%。培养60 h后,90%以上的细菌形成芽孢,适合下一步实验使用。
2.2 DNA提取方法不同对实时荧光PCR的影响
使用4种不同方法提取的DNA为模板,进行荧光定量PCR,结果如图1所示。液氮研磨法和煮沸法提取的DNA经qPCR扩增,Ct值分别为21.78和29.54。超声波破碎法提取的DNA进行qPCR扩增,Ct值为18.29,小于其他2种方法。溶菌酶法不能提取芽孢中的DNA。结果表明,超声波破碎法得到的DNA质量要明显强于煮沸法和液氮研磨法。
2.3 EMA使用浓度优化
实验结果如图2所示:不加入EMA处理的样品Ct值最低为18.64,随着EMA浓度的增加,Ct值也逐渐增加。低浓度 EMA(0.1~1.0 μg/mL)处理对Ct值得影响不大,仅有略微上升。稍高浓度 EMA(2.0~10.0 μg/mL)处理使得Ct值有显著的上升。10.0 μg/mL以上高浓度EMA处理Ct值就不再升高。EMA浓度过低不能全部去除死菌DNA的干扰,出现“假阳性”结果,EMA处理浓度控制在5.0~10.0 μg/mL之间较为适宜。
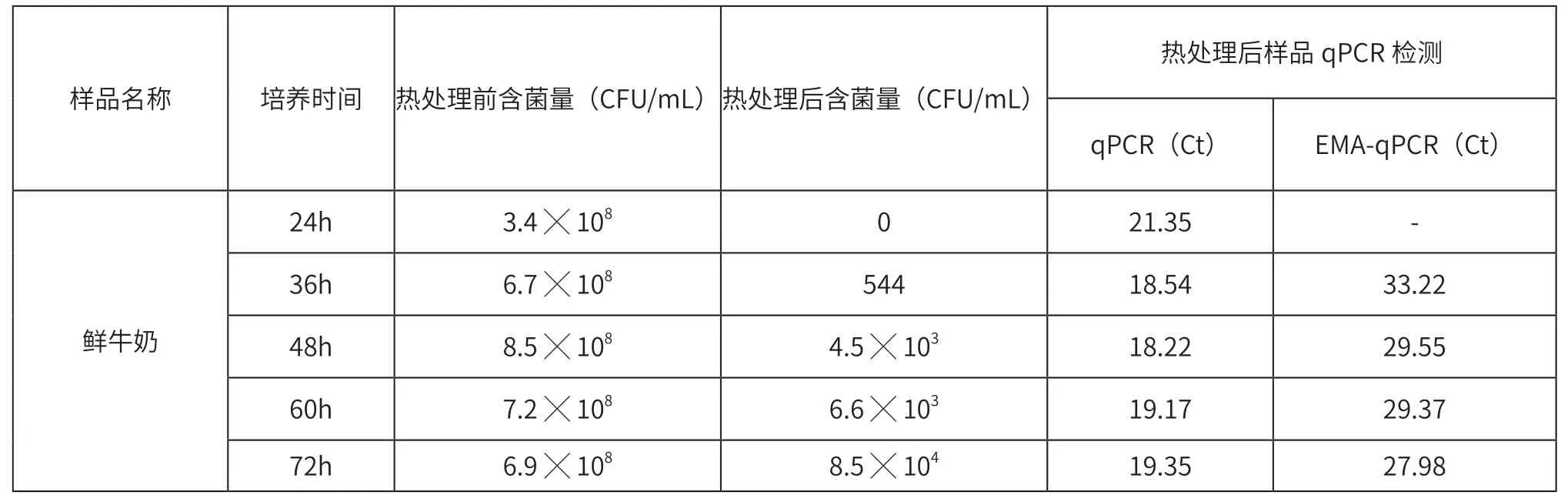
表1 人工污染实验
2.4 EMA 光照时间优化
可见光照射使EMA分解从而不能抑制PCR扩增。若光照时间不足,则EMA不能被完全钝化,影响PCR反应进行,出现“假阴性”结果。如图3所示,EMA处理的样本在不进行光照时Ct值远高于对照组,为36.77;随着光照时间的延长,Ct值逐渐下降,光照10 min时达到最小值24.11;光照10 min以后再延长光照时间则对PCR结果没有任何影响,Ct值稳定在24.10左右。实验结果表明,光照时间控制在10 min左右是较好的选择。
2.5 人工污染实验结果
将蜡样芽孢杆菌接种到新鲜牛奶中,37 ℃培养72 h,再80 ℃热处理20 min,测定热处理前后的菌数,热处理前的菌量可以视为牛奶中总的含菌量,加热灭菌后菌量则为芽孢含量,实验结果见表1。无EMA处理的PCR结果受到死细菌DNA的影响,Ct值与活菌量之间没有明显的相关性;经EMA处理后PCR结果不再受到死细菌的干扰,与细菌芽孢数呈明显的负相关性,随着芽孢数量的增加而降低。
3 讨论
PCR检测蜡样芽孢杆菌芽孢中,常规DNA提取方法难以提取芽孢DNA,导致PCR检测灵敏度偏低,假阴性率较高。本实验比较煮沸法、液氮研磨法、超声波破碎法、溶菌酶法等4种不同方法提取芽孢DNA效果。其中,超声波破碎法效果最佳,所得DNA浓度明显高于其他。EMA处理能有效去除复杂样本中死菌DNA,提高蜡样芽孢杆菌芽孢检测准确率。对蜡样芽孢杆菌样本进行10.0 μg/mL浓度EMA处理及10 min光照,能够得到较为理想的检测结果。通过对牛奶进行人工添加蜡样芽孢杆菌实验结果也支持上述结论,进行EMA处理的PCR结果与芽孢数呈明显的负相关性,而未进行EMA处理的PCR结果受到死细菌DNA的严重干扰,不能准确地反映细菌总量,并且容易出现假阳性的情况。
