帕金森病相关骨骼肌肉疼痛的中枢机制及治疗研究现状
2019-08-28朱本藩综述许二赫审校
李 俊, 朱本藩综述, 许二赫审校
帕金森病(Parkinson’s disease,PD)是伴有多种运动及非运动症状的神经变性疾病。近些年来非运动症状引起越来越多的重视,包括疼痛、情绪、嗅觉、认知、便秘等,其中疼痛一直有着高伴发率,并逐渐引起学界的重视。其实早在1817年詹姆斯帕金森就曾在专论里写到,疼痛可以是帕金森病疾病损害的早期警示征[1]。疼痛定义是指一种与组织损伤或潜在组织损伤相关的感觉、情感、认知和社会维度的痛苦体验,在中老年人群很常见,在PD患者中更常见。疼痛可早于运动症状出现之前多年[2],在PD早中晚期阶段均存在,影响到了60%~80%的PD患者,严重妨碍患者的生活质量,2015年柳叶刀神经病学[3]中就指出疼痛作为一个重要的治疗目标,在PD患者中常常被低估、认识不足并管理不善。2018年英国伦敦发表了迄今为止最大最详细的多中心的PD疼痛研究,共纳入1957例PD患者,发现疼痛发生率高达85%,其中42%是中到重度疼痛[4],显然这是一个非常高的伴发率,显著高于其它人群。临床常用分类方法Ford分类[5]把PD疼痛分为以下五种类型:骨骼肌肉疼痛、神经根性疼痛、肌张力障碍疼痛、中枢性疼痛和静坐不能。其中最常见的类型是骨骼肌肉性疼痛,约占所有类型当中的一半左右。2018年英国伦敦PD疼痛研究将之更为细分化为:肌肉骨骼疼痛、PD相关的慢性疼痛、波动性疼痛、夜间疼痛、衣架样疼痛、口腔颌面部疼痛、肢体远端疼痛和腹痛,其中骨骼肌肉疼痛占66%[4]。慢性骨骼肌肉疼痛严重影响到患者的生活质量[6]。可见PD疼痛分类较为复杂,但不同的分类对于骨骼肌肉疼痛的类型认知一致,其所占比例也最高,对患者生活质量影响也最大,有待并值得进一步研究。
1 PD相关骨骼肌肉疼痛的定义及临床特征
骨骼肌肉疼痛是指发生在肌肉、骨骼、关节、肌腱或软组织等部位的疼痛,超过3 m的称之为慢性骨骼肌肉疼痛。中枢神经系统疾病可引起中枢神经功能障碍相关的骨骼(包括脊柱与关节)、肌腱或肌肉的慢性疼痛,包括运动功能改变和感觉功能改变引起的疼痛。神经系统疾病引起的生物力学功能改变能够激活肌肉骨骼组织中伤害性感受器,疼痛可能是自发的或运动诱发的[7]。PD相关骨骼肌肉性疼痛[5]指常发生在PD患者颈部、肩周、椎旁、小腿肌肉的疼痛、痉挛以及肩、髋、膝、踝等关节的疼痛不适,可伴有肌肉压痛、关节紊乱、骨骼畸形、姿势异常和防痛步态等。它的临床特征有:可因PD的僵硬、强直和少动而加重,并因加强运动而减轻;可通过给药而波动,用左旋多巴改善。骨骼肌肉疼痛可以作为PD的前驱症状。有研究发现[8]在发展为PD的人群中有三分之一的人在早期存在骨骼肌肉疼痛,并且服用左旋多巴后85%的患者疼痛症状改善。临床疼痛形式多表现为酸、胀、紧缩、痉挛、烧灼、针刺、蚁行感、隐痛或不可名状。
2 PD相关骨骼肌肉疼痛的影响因素
2008年国际运动障碍协会(MDS)指出[9]:PD伴疼痛影响因素纷繁而复杂。大体分为PD非相关疼痛和PD相关疼痛,PD非相关影响因素常见于糖尿病、风湿性疾病、关节炎、脊柱和关节退行性变、肿瘤、跌倒外伤等常见的可引起疼痛的PD的合并症。PD相关影响因素包括有:一是与PD直接相关:如果根据病史、临床检查、实验室检查或影像学结果不能归因于任何其他健康问题。既往研究认为女性、运动并发症、抑郁、焦虑被认为是PD伴疼痛最可能的危险因素。二是与PD间接相关:如果另一种疾病引起疼痛(例如骨关节炎),但由于僵硬、异常姿势或运动,PD加重疼痛强度。既往研究认为PD相关骨骼肌肉疼痛患者的疼痛、抽筋和关节疼痛通常被认为是由于受影响的肢体和关节姿势改变、肌肉僵硬、肌肉痉挛,肩关节紊乱,脊柱或手足畸形,肌张力相关疼痛(开关期,清晨肌张力障碍,药物剂量,剂末肌张力障碍等)原因造成。Tinazzi等发现PD患者合并肌肉痛者存在疼痛中枢处理异常[10],激光诱发电位N2/P2振幅减少受到抑制,且与患者运动症状无明显相关。最近研究发现[4]肌肉骨骼疼痛的严重程度与运动症状的严重程度之间的相关性可以忽略不计,与运动并发症、自主神经症状、焦虑和抑郁症的严重程度之间存在微弱的相关性,而合并中枢致敏的特征较为明显。Clark等[11]认为慢性骨骼肌肉疼痛的主要机制是中枢痛觉处理异常。
3 PD骨骼肌肉疼痛的中枢机制
3.1 结构学 PD的骨骼肌肉疼痛同其它类型PD相关疼痛类型一样,有中枢性因素参与,可能与涉及伤害感受疼痛机制的解剖结构的病理改变有关,所以可以贯穿PD全程。例如有研究表明PD伴肩痛的患者,有中枢性的因素参与强化疼痛的处理[11]。有研究显示PD疼痛严重程度与PD小纤维神经病的严重程度没有关联[12],提示中枢因素可能更重要。另有研究表明[13],外周机制可能不像PD患者的疼痛处理中枢机制那么重要。
Fil等[14]将PD相关疼痛传入系统分为内侧疼痛系统和外侧疼痛系统(见图1),将疼痛感觉传递到更高中心的大脑神经元。外侧疼痛系统参与处理疼痛的性质识别、定位、持续时间和强度的信息,包括新脊髓丘脑束(脊髓丘脑侧束)、新三叉丘系、颈丛、后角束,终止于外侧丘脑、第一躯体感觉区、第二躯体感觉区、顶岛盖和岛叶,外侧疼痛系统在对疼痛的抑制方面有非常重要的作用。内侧疼痛系统参与疼痛的始动、情感、认知评价以及记忆和自主反应,包括脊髓丘脑前束、脊髓中脑束、脊髓网状束、脊髓臂旁下丘脑束,终止于从尾端到嘴端的臂旁核、蓝斑、导水管周围灰质、丘脑板内核和正中核、丘脑腹侧尾端小细胞核、腹侧尾端室间孔核、岛叶、被盖、第二躯体感觉皮质、额前扣带回、杏仁和海马等。很多下丘脑核团,尤其是含组胺的结节乳头体,以及脑室周围核团也属于内侧疼痛系统。这两种核团能产生后叶催产素和精氨酸抗利尿激素。组胺、后叶催产素、精氨酸抗利尿激素以及促肾上腺皮质激素释放激素都是具有抗疼痛作用的多肽。
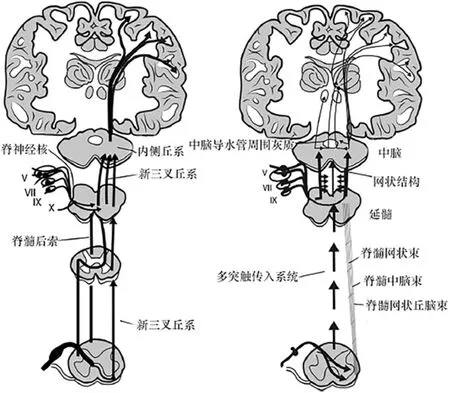
图1 内外侧疼痛传入系统[14]
下行调节系统[15]主要涉及脑导水管周围灰质(periaquedoctal grey,PAG)、延髓头端腹内侧区(rostral ventromedial medulla,RVM)、下丘脑、前扣带回、背延侧网状核、孤束核、杏仁核和脊髓等结构。PAG-RVM下行痛觉调制通路对脊髓背角神经元具有易化和抑制性驱动作用。这一通路的输出可能受到较高的结构,如下丘脑和边缘前脑的影响。PAG接受来自更高脑中心的输入,并能够激活一种强大的镇痛作用。RVM既可促进或抑制伤害性输入,又可作为控制下行疼痛易化的最终继电器。皮质和皮质下的部位可以通过这些中继站的结构来影响伤害性感觉。下行抑制的参与可以保护损伤后实验性神经病理性疼痛的发展,当下行抑制作用减弱时出现增强的疼痛。
众所周知Braak根据α-突触核蛋白阳性路易体和路易神经炎的沉积将PD病理分期分为6期:一期为周围自主神经系统、嗅觉系统(嗅球、前嗅核)、延髓(迷走神经背核、舌咽神经)受累;二期为脑桥(蓝斑、网状结构巨细胞部、中缝核下部)、脊髓灰质(特别是自主神经系统中枢)受累;三期为脑桥核、中脑黑质致密部、基底前脑(巨细胞核)、边缘系统(杏仁体的中央核)受累;四期是边缘系统(杏仁体基底外侧核和副皮质核、终纹间位核、腹侧屏状体)、丘脑(板内核)、颞叶皮质(前内侧颞叶中间皮质,海马C2区)等受累;五期为高级感觉联合区新皮质和前额叶受累;六期为一级感觉区和运动前区受累。从周围自主神经系统、嗅觉系统开始,自下而上,历经延髓、脑桥、中脑、基底节、丘脑、皮质。这些核团在PD进展过程中受到累及,路易小体沉积,所以伤害性的信息不能直接从脊髓传入至高级皮质中枢或者高级皮质中枢传出至脊髓。例如中缝核和巨细胞网状核区域在疼痛的下降调节中的作用是重要的,因为它是镇痛下行传导的最后一站。因此这6个分期有助于帮我们了解PD解剖结构在病情进展过程中发生变化,而导致的PD患者中疼痛矩阵也发生相应变化,故而产生疼痛。又有研究显示,中脑黑质致密部、腹侧被盖区(VTA)和下丘脑等多巴胺聚集区域与疼痛相关通路如中脑皮质通路、中脑边缘系统、黑质纹状体通路和结节漏斗系统均存在广泛联系[16~18]。脊髓导水管周围灰质、臂旁核、蓝斑、巨细胞核、延髓中缝核等结构,在脊髓伤害性下行抑制传递的调节中起重要作用,例如一个来自脊髓背角的抑制性刺激,会因为疼痛抑制区域的干扰而引起疼痛感觉的增加[19]。
3.2 神经递质学
(1)多巴胺:PD典型病理改变是中脑黑质致密部多巴胺能神经元变性缺失,导致纹状体多巴胺水平降低,而PD疼痛患者调整了多巴胺能药物后疼痛往往好转,因此,多巴胺水平降低可能参与PD疼痛的发病机制。多巴胺参与疼痛的调控,主要于脊髓、丘脑、基底节、扣带回和岛叶等结构进行调控[20]。Martikainen等研究认为纹状体D2受体和(腹侧纹状体)D3受体在介导脑内多巴胺能疼痛控制中起关键作用。D2和D3受体的可利用度可作为疼痛的预测因子。慢性肌肉骨骼疼痛如纤维肌痛和腰背痛等都与纹状体多巴胺D2/D3受体基础利用率低有关。在动物实验中,通过脑内微量注射选择性激动剂,激活纹状体多巴胺D2/D3受体,特别是在背外侧壳核,具有减轻疼痛相关行为的作用,而多巴胺D2/D3受体拮抗剂应用在不同类型的实验性疼痛中,发生疼痛行为增强[21]。
(2)5-羟色胺(5-HT)和去甲肾上腺素(NE):5-HT神经元轴突从中脑脊核发出,经脑桥中缝核和头端延髓腹内侧区,下行至脊髓。5-HT 可调节下行抑制和下行易化两条通路,因此其既有抑制伤害性感受又有易化伤害性感受的作用。Tong等研究发现在PD患者中外周血清5-HT水平低下[22]。PD患者予抗抑郁药5-HT和去甲肾上腺素再摄取抑制剂(SNRI)度洛西汀可以改善疼痛,提示5-HT主要发挥抑制疼痛作用。NE在中枢具有镇痛作用,其与阿片类药物有协同镇痛作用,其作用机制主要是通过刺激延髓-脊髓下行单胺能系统抑制通路上的臂旁核、蓝斑等结构,促进NE的释放,升高NE水平,促进γ-氨基丁酸和甘氨酸的释放,从而阻断脊髓的伤害反射[23]。
(3)γ-氨基丁酸 (GABA):GABA抑制性神经递质,由GABA能神经元产生,约占大脑神经元的40%,在中枢性感觉传导通路具有重要作用,当GABA与GABA-A受体结合时,细胞外Cl-流入神经元,从而降低膜电位并产生抑制作用[24]。PD患者在脊髓上行传导通路、下行镇痛通路中都有GABA系统失调,导致疼痛发生[25]。
(4)阿片肽:与阿片受体结合的肽,如μ-阿片受体(MOR)、δ-阿片受体(DOR)和κ-阿片受体(KOR)被称为阿片肽。所有类型的阿片受体都是GI蛋白偶联受体,这意味着它们在激活时抑制腺苷酸环化酶(AC)/环磷酸腺苷(cAMP)的活性。这些受体广泛分布于初级传入神经元和突触后神经元的树突中,并有两种内源性阿片肽大量释放到中间神经元:脑啡肽和强啡肽。这些肽抑制传入终末兴奋性神经递质的释放,从而降低神经元的兴奋性,最终减轻痛觉[24]。
4 治 疗
临床上PD伴骨骼肌肉疼痛和其它类型疼痛一样常常是被医生和患者忽视的,目前PD相关骨骼肌肉疼痛无规范化治疗方案。PD的疼痛治疗应该由多学科合作,包括综合药物和非药物治疗方法[26],常用的治疗方法如下。
4.1 药物治疗 目前药物治疗主要有:多巴制剂、口服止痛药物、外用贴剂、肉毒素以及脑深部电刺激(DBS)手术。多巴制剂包括左旋多巴和多巴胺激动剂,对疼痛的作用是至关重要的,可能是由于基底神经节参与疼痛加工。2007年就有研究表明左旋多巴摄入可以使疼痛感知异常正常化。但同时左旋多巴也可引起疼痛,但相对少见。口服止痛药物包括非甾体消炎药(NASID)类、钙离子通道拮抗剂、抗抑郁药物、阿片类等。但不同类型的药物都有其局限性,如左旋多巴急性不良反应为恶心、呕吐、直立性低血压,NASID类药物有众多胃肠道反应,贴剂容易过敏。2015年柳叶刀[27]有一研究用阿片类羟考酮-纳洛酮治疗PD疼痛,疼痛明显减轻,但同时伴有65%~70%的不良反应。肉毒素主要针对局部关节、肌肉肌张力障碍疼痛患者有效。
4.2 非药物及手术治疗 目前认为帕金森疼痛治疗最有效之一的治疗方法是丘脑底核(STN)-DBS,是一种创伤性手术,代价高。然而在2015JAMA[28]报道了关于STN-DNS手术治疗PD疼痛各种类型的研究,疼痛改善的有效率为67%,长达8 y,但合并有65%~70%的不良反应,同时文献中指出,STN-DBS对骨骼肌肉疼痛的疗效不那么明显,相反随着时间的推移,骨骼肌肉疼痛的发生率会逐渐增加。所以在这篇文章中同时指出了术前需要关注到骨肌肉骼疼痛的问题,另行方案解决。
近年来研究证明,非创伤性脑刺激治疗如重复经颅磁刺激(rTMS)和经颅直流电(tDCS)等神经调节技术可以通过改变大脑神经元可塑性来减轻疼痛[29]。2014年国际临床神经生理学联合会发布的TMS治疗指南[30]中指出:对疼痛对侧的初级运动皮质(M1)的高频rTMS具有镇痛作用,最常用的频率是10 Hz和20 Hz,证据A级。静息态功能核磁共振的研究发现,rTMS可以增强脑部感觉和运动网络的功能连接,从而减轻幻肢痛患者的疼痛[31]。rTMS激活远离刺激部位的大脑区域,类似长时程增强效应(LTP)的机制,增加镇痛类物质如内源性阿片类物质和单胺类、GABA神经递质的释放[32]。2011年1例个案[33]报道用低频M1区rTMS治疗PD关期小腿疼痛有效,但维持时间短暂。目前为止,非药物无创刺激性治疗一直未得到很好的关注,有较好的研究及应用前景。
综上所述,PD相关骨骼肌肉疼痛的中枢机制一直未得到很好地关注与识别,其影响因素众多,纷繁而复杂,有待进一步研究,更好的揭示其相关因素及可能存在的机制。同时在治疗方面,非药物无创刺激是一个潜在的可发展的方向,需更多的临床试验探索。
