高效液相色谱法测定不同类别食品中的叶黄素
2019-08-27222
222
(1.中国广州分析测试中心, 广东广州510070;2.广东省化学危害应急检测技术重点实验室, 广东广州510070)
叶黄素属于类胡萝卜素,是一种天然、营养和多功能的食品添加剂,素有“植物黄金”之称[1-3]。人体自身不能合成叶黄素,只能从食物中摄取[4]。我国卫生部已批准,叶黄素可添加到婴幼儿配方食品中,因此叶黄素一直都是功能食品领域研究的热点。
食品中添加的叶黄素有三种形态:叶黄素单体、叶黄素微囊粉或叶黄素酯。叶黄素化学结构中含有多个共轭双键,容易被氧化失去原有的生物活性,因此叶黄素单体的应用范围受到限制[5-6]。叶黄素微囊粉是通过微胶囊化技术对叶黄素单体进行包埋的微囊产品,可最大限度保持叶黄素的生物活性,同时还可以实现缓释吸收[6-7]。微囊中叶黄素的检测,需要先破微囊壁,再提取叶黄素。叶黄素酯是叶黄素与脂肪酸(如棕桐酸、月桂酸等)作用生成的酯类衍生物,属于新资源食品。叶黄素酯种类很多,但经过碱性皂化(水解)均可生成叶黄素单体[8]。叶黄素微囊粉和叶黄素酯稳定性远远高于叶黄素单体,更便于贮藏和应用。
叶黄素形态不同,决定了样品前处理方法不同。目前,在现行的标准方法和相关文献中,主要是根据样品基质选择样品前处理方法[9-13]。本文对不同类别食品中不同形态的叶黄素分别进行了研究,建立了有针对性的样品前处理方法。
1 实验
1.1 仪器与试剂
高效液相色谱仪—二极管阵列检测器( LC-20A 2300,日本岛津公司);KQ-2200型超声波清洗器(昆山市超声仪器有限公司);高速冷冻离心机(Hitachi);电热恒温水浴锅(上海浦东荣丰科学仪器有限公司);BT125D电子天平(Sartorius);KL512型氮吹仪(北京康林科技有限责任公司)。
甲醇(色谱纯 Merck );乙腈、乙醚、丙酮、石油醚、无水乙醇、抗坏血酸(分析纯 广州化学试剂厂);2,6-二叔丁基对甲酚(BHT 阿拉丁);蒸馏水。
乙醇提取剂:称取 0.75 g BHT于 500 mL容量瓶中,用无水乙醇溶解并定容。甲醇、丙酮和乙腈提取剂均含 0.15 % BHT。
1.2 标准物质
叶黄素(95.8 %,ChromaDex):精密称取0.010 44 g(精确至0.01 mg)于100 mL棕色容量瓶中,用无水乙醇溶解并定容至刻度,得到浓度为100 mg/L的标准储备液。分别移取 0.125、0.250、0.500、2.00、5.00、10.0 mL标准储备液于6个 100 mL 棕色容量瓶中,用无水乙醇定容,得到浓度为0.125、0.250、0.500、2.00、5.00、10.0 mg/L 的系列标准工作液。
1.3 样品前处理
含有叶黄素单体、叶黄素微囊粉或叶黄素酯的样品,前处理方法分别选用超声波辅助提取法、酶解—超声波提取法或碱皂化—液液萃取法。
1.3.1 叶黄素单体
非含油样品:称取0.05~5.0 g试样于 50 mL聚丙烯刻度离心管中,加入 40 mL乙醇提取剂,于冰水浴中超声提取 30 min,定容,过滤上机。
含油样品:前处理过程提取剂改为丙酮提取剂,其他步骤同“非含油样品”。
1.3.2 叶黄素微囊粉
微囊壁材种类很多,常见的叶黄素微囊壁材为水溶性壁材和蛋白质壁材[14-16]。
水溶性壁材:称取0.05~2.0 g试样于100 mL容量瓶中,加入水15 mL和0.1 g抗坏血酸,涡旋振荡溶解后于60 ℃ 水浴5 min,不断震荡使微囊壁材充分溶解后,加入无水乙醇80 mL,冰水浴超声提取30 min,用无水乙醇定容,过滤上机。
蛋白质壁材:称取0.05~2.0 g试样于100 mL容量瓶中,加入15 mL 水、0.1 g抗坏血酸和0.15 g胰蛋白酶,以下步骤同“水溶性壁材”。
1.3.3 叶黄素酯
叶黄素酯的碱皂化—液液萃取法已经成熟,前处理方法参考相关的标准方法[9,17]。
皂化:称取0.05~2.0 g试样于250 mL皂化瓶中,加入水10 mL、0.5 g抗坏血酸和无水乙醇40 mL超声混匀,再加入 50 %氢氧化钾溶液10 mL,摇匀,于75 ℃ 水浴皂化30 min,皂化后快速冷却;
萃取:将上述溶液移入250 mL分液漏斗中,用石油醚/乙醚(1/1,V/V)50 mL分3次洗涤皂化瓶,洗液并入分液漏斗中,振摇萃取5 min后静置分层。移取水层,重复萃取1次,合并醚层;
洗涤:每次用50 mL蒸馏水洗涤醚层,直至洗至中性;
浓缩定容:将醚层用氮气吹干,依据叶黄素的线性范围,用乙醇提取剂定容至合适的体积,过滤上机。
1.3.4 高脂肪、高蛋白食品
对于脂肪和蛋白含量高的食品,如:奶粉、蛋白粉和乳基粉,添加的原料主要是叶黄素单体或者叶黄素微囊粉。但由于样品基质的干扰和叶黄素含量较低,前处理过程需要选用碱皂化—液液萃取法,既可以减少基质干扰,还可以浓缩提取液,使其浓度落在叶黄素线性范围内。因此,前处理过程参照“1.3.3节”。
1.4 色谱条件:
色谱柱:迪马C18(4.6 mm×250 mm,5 μm);柱温:35 ℃;进样量:20 μL;检测波长:446 nm。流速:1.0 mL/min;流动相:水/甲醇(4/96,V/V)。
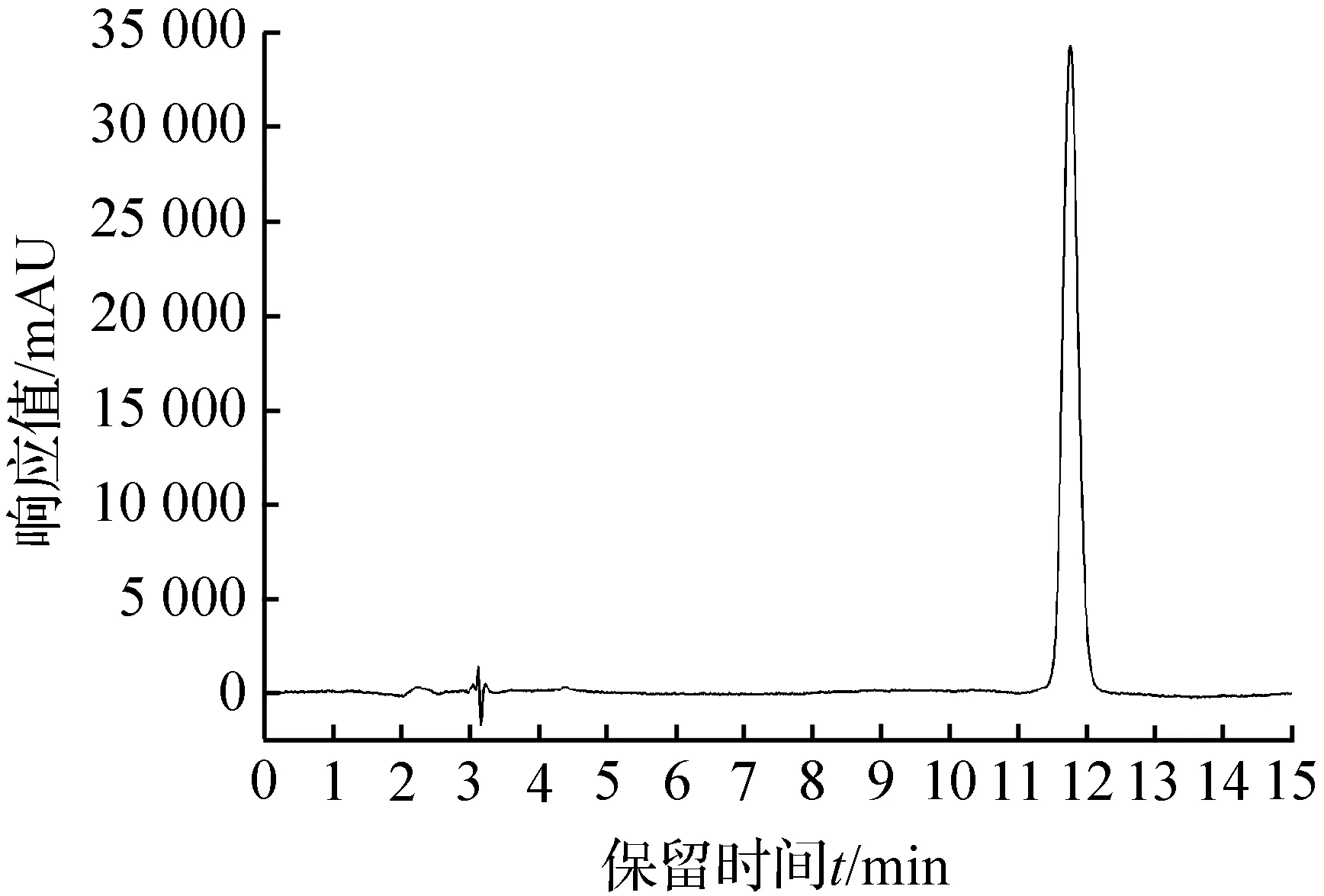
图1 叶黄素标准色谱Fig.1 Standard chromatogram of lutein
2 结果与讨论
2.1 选定检测波长
本仪器配备的是光电二极管阵列检测器,在检测的同时,还可以获取叶黄素的紫外可见吸收光谱图。叶黄素的最大吸收波长为446 nm,选定446 nm作为检测波长。
2.2 优化流动相
在现行的标准方法中[9],叶黄素的流动相为甲醇/水/叔丁基甲基醚。叔丁基甲基醚易挥发,有刺激性气味。优化后的流动相为水/甲醇(4/96,V/V),该条件简单易行,环境友好。叶黄素标准色谱见图1。
2.3 样品前处理方法选择
2.3.1 叶黄素单体选用超声波辅助提取法
提取剂的选择:叶黄素为脂溶性,可溶于大部分有机溶剂,分别选取甲醇、无水乙醇、丙酮和乙腈为提取剂。前处理过程同“1.3.1节”。结果表明:含油样品,丙酮溶解性最好,提取率最高;对于非含油样品,甲醇和无水乙醇提取率接近,综合考虑,选用无水乙醇为提取剂。
提取剂中BHT浓度 :由于叶黄素的化学性质不稳定,需要在提取剂中添加BHT抗氧化剂。前期研究工作表明提取剂中含0.15 %BHT时,提取率最佳[18]。
2.3.2 叶黄素微囊粉选用酶解—超声波提取法
在酶解过程中,需要水浴加热,加入抗坏血酸可减少叶黄素的氧化分解[19]。
水溶性壁材:该类壁材遇水即溶,因此加水破壁即可。水用量分别选择5.0、10.0、15.0、20.0 mL,其他参数条件不变(样品为乳基幼儿配方奶粉,称样量为2.0 g),具体详见“1.3.2节”。每个水平重复2次,取平均值,得出水用量与叶黄素含量的关系见图2。
水用量过少,不能充分溶解样品和破除微囊壁;水用量过多,影响叶黄素提取率和基质沉淀率。由图2可知,水用量为15.0 mL时,测得叶黄素含量最高,选定水用量15.0 mL。由于样品中叶黄素微囊粉含量不同,最佳水用量也不同,因此,测定不同含量的样品,需要重新优化水的用量。
蛋白质壁材:选择胰蛋白酶破除微囊壁。酶用量分别选择0.05、0.1、0.15、0.2、0.25 g,其他参数条件不变(样品为叶黄素微囊粉,称样量为0.05 g),具体详见“1.3.2 节”。每个水平重复2次,取平均值,得出酶用量与叶黄素含量的关系见图3。

图2 水用量对叶黄素含量的影响
Fig.2 Effect of water dosage ondetermining lutein content
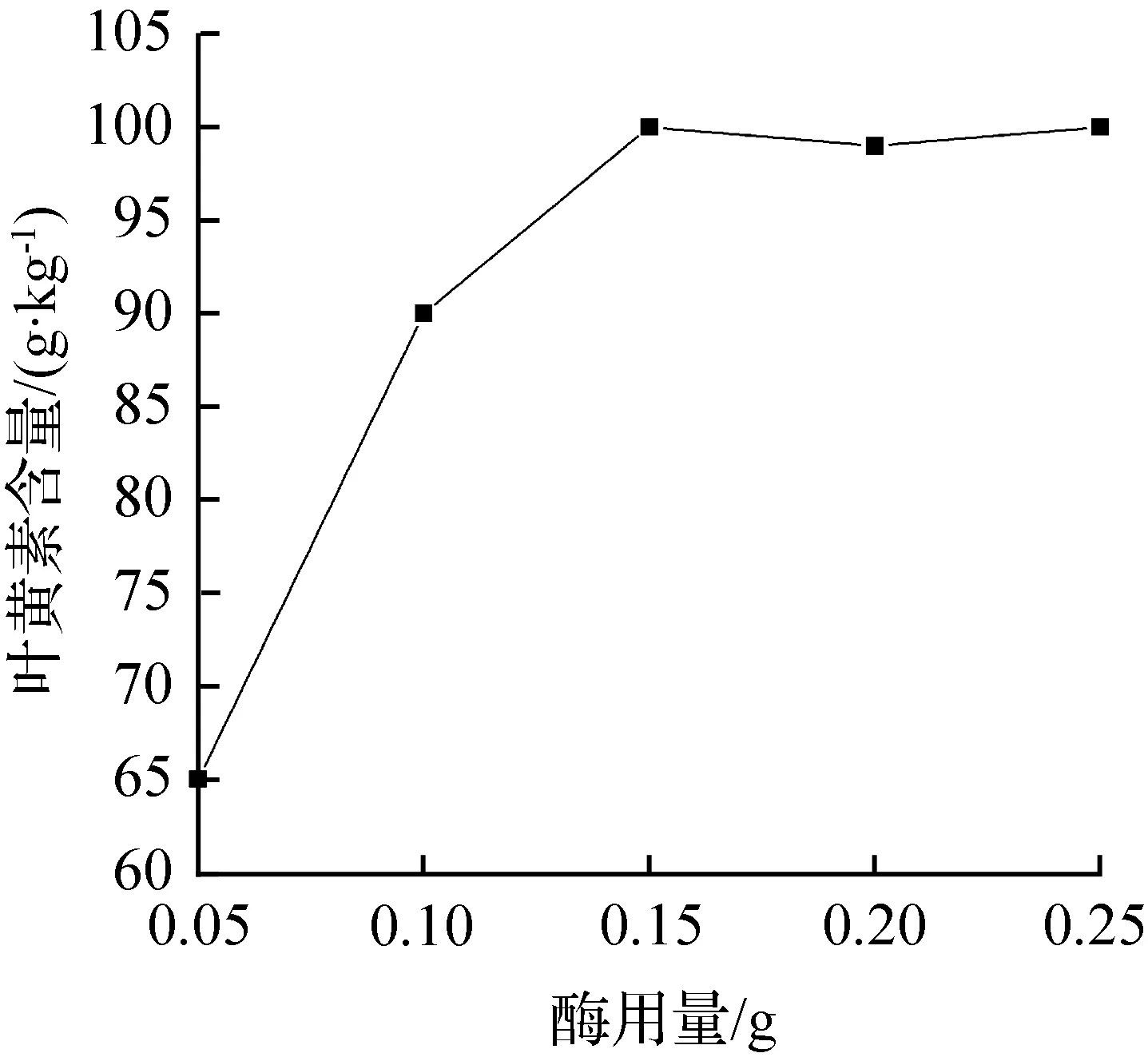
图3 酶用量对叶黄素含量的影响
Fig.3 Effect of enzyme dosage ondetermining lutein content
由图3可知,酶用量分别为0.15、0.20、0.25 g时,测得叶黄素含量基本相同。考虑到实验成本,选定酶用量0.15 g。由于样品中叶黄素微囊粉含量不同,最佳酶用量也不同,因此,测定不同含量的样品,需要重新优化酶用量。
2.3.3 叶黄素酯选用的碱皂化—液液萃取法
叶黄素酯选用的碱皂化—液液萃取法已经成熟,前处理方法参考相关的标准方法即可,具体步骤见“1.3.3节”。
2.4 方法的线性范围和检出限
在优化条件下,考察了叶黄素的线性范围和相关系数。结果显示:叶黄素在0.125~10.0 mg/L范围内,线性良好,相关系数为0.999 91。对于奶粉和蛋白粉等食品,当取样量为2.0 g、定容体积为5 mL 时,检出限为0.10 mg/kg(信噪比S/N=3)。
2.5 方法的加标回收率和相对标准偏差
采用“1.3节”测定样品中叶黄素含量,每个加标浓度均做平行样。求得加标回收率为90.0 %~ 102.2 %。平行 6 次实验,求得相对标准偏差为 2.29 % ~ 5.84 %,具体结果见表1。
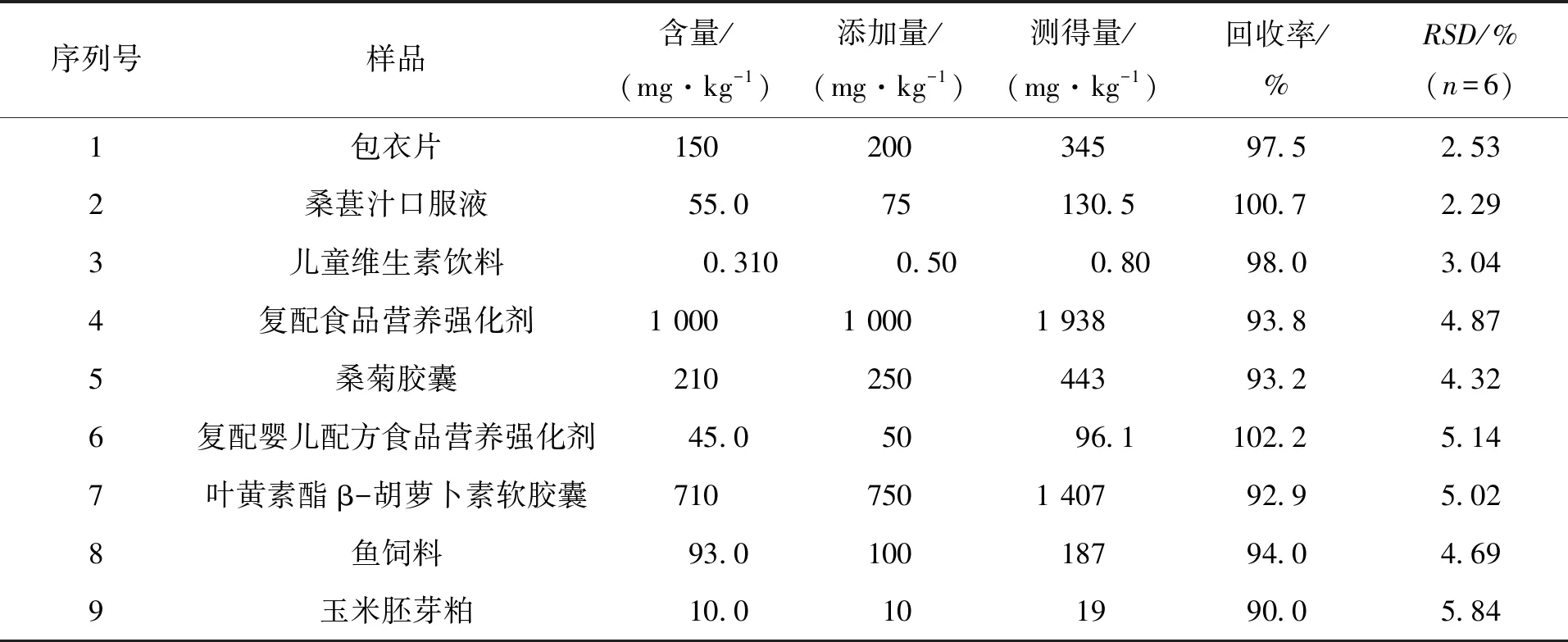
表1 叶黄素的加标回收率和相对标准偏差Tab.1 Recoveries and RSDs of lutein in the samples
2.6 食品中叶黄素的含量情况
通过对820个样品进行含量测定,结果表明,在所检测的样品中所含叶黄素含量均不同:①不同品牌、不同年龄段的食品中叶黄素含量不同;②叶黄素软胶囊的原料为叶黄素单体,硬胶囊为叶黄素微囊粉;③鸡蛋中叶黄素主要在蛋黄里,鸡的食源种类对蛋黄中叶黄素含量影响很大;④叶黄素微囊粉的壁材主要为水溶性壁材;⑤天然作物中可能同时含有叶黄素单体和叶黄素酯。样品前处理要参照“1.3.3节”。选取有代表性的样品进行列表,按叶黄素形态不同分为3个表,具体结果分别见表2~表4。
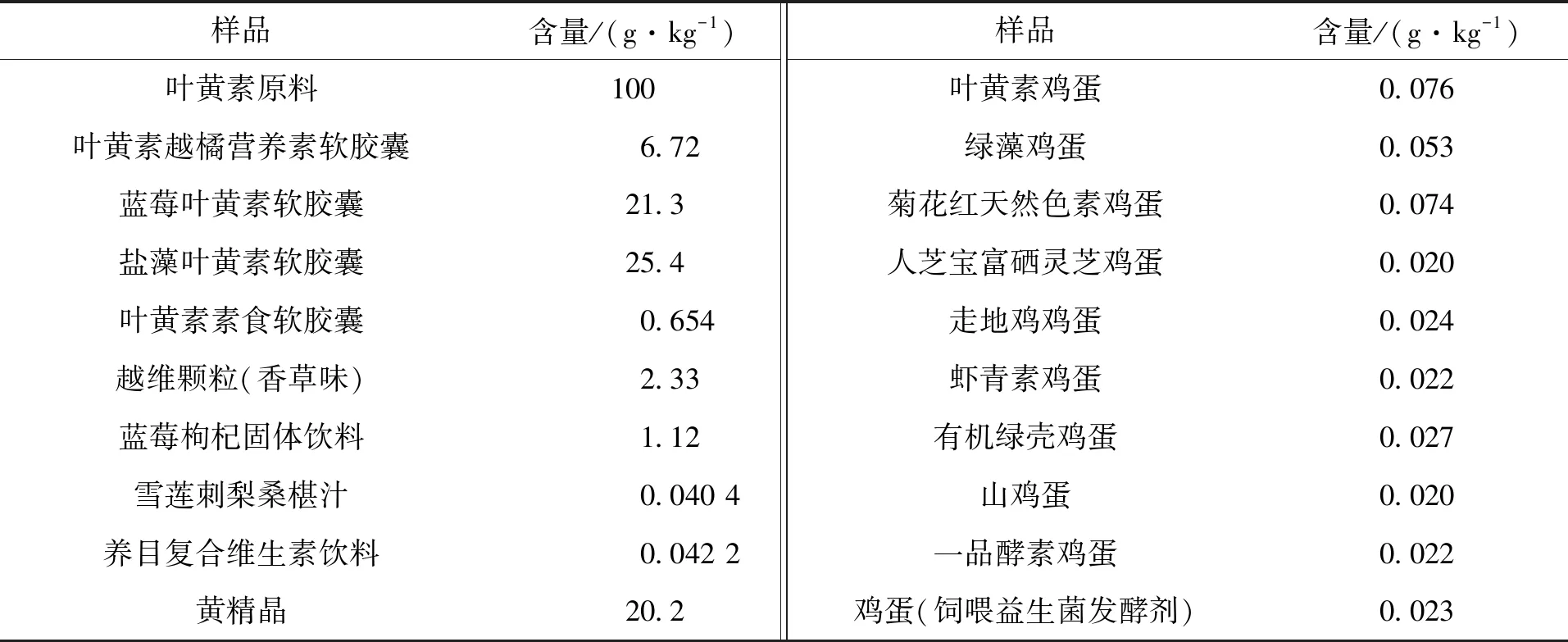
表2 叶黄素单体食品中的检测结果Tab.2 Test results of lutein in lutein monomer foods
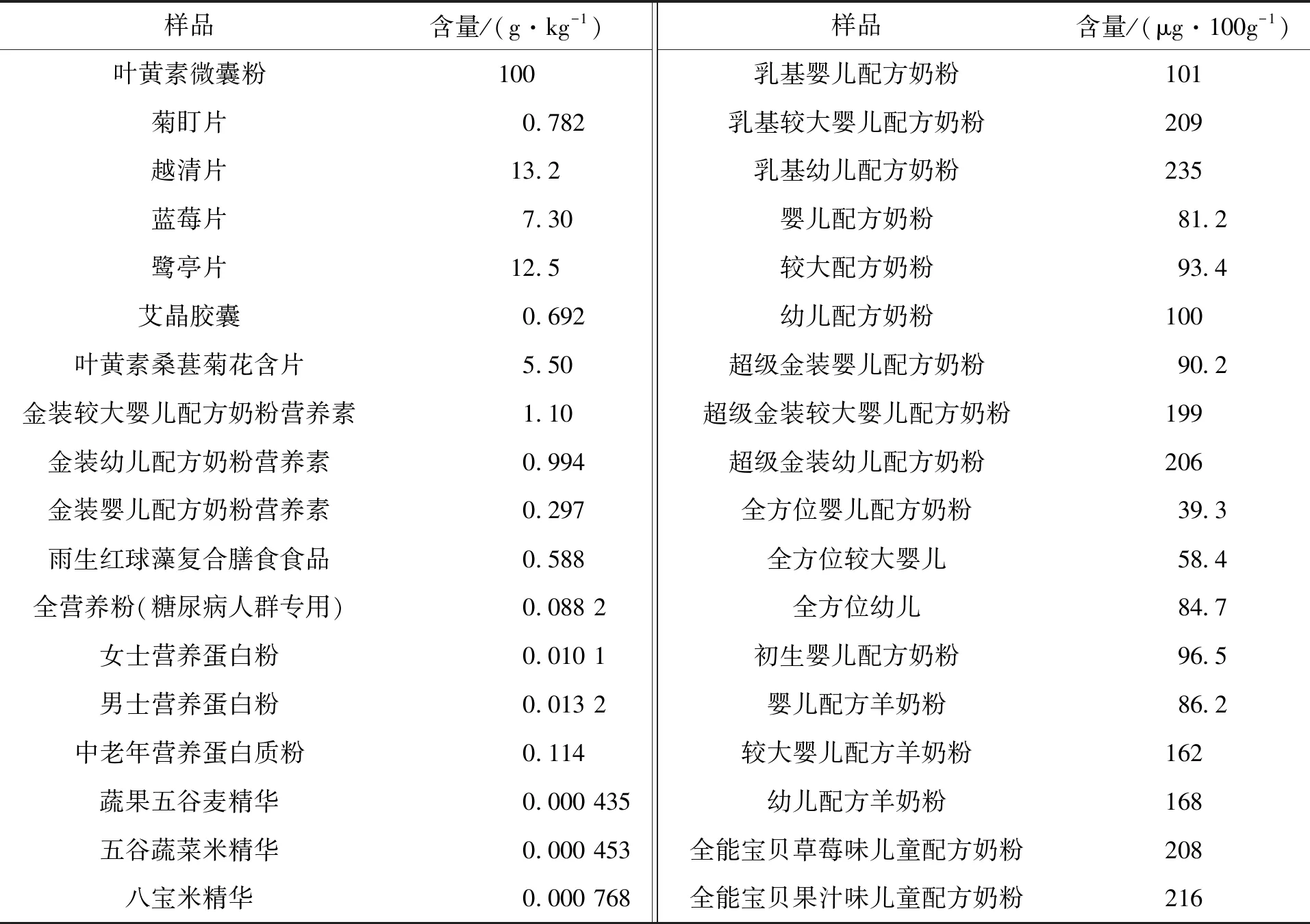
表3 叶黄素微囊粉食品中的检测结果Tab.3 Test results of lutein in lutein microcapsules foods
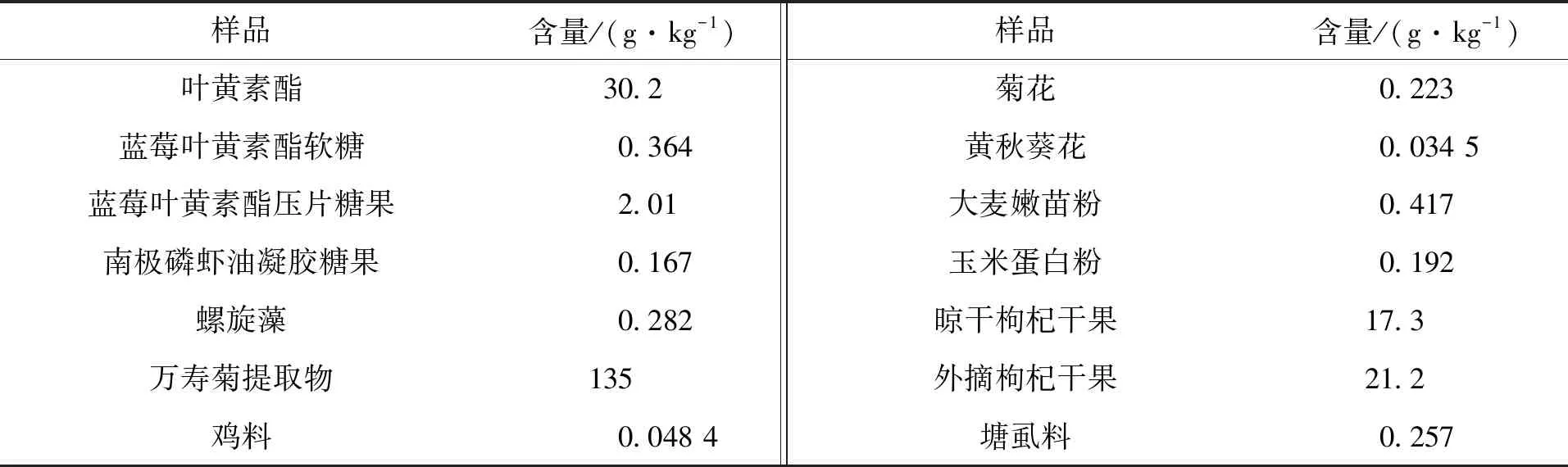
表4 叶黄素酯食品中的检测结果Tab.4 Test results of lutein in lutein esters foods
3 结论
本文根据样品基质和叶黄素形态不同,分别建立了超声波辅助提取法、酶解-超声波提取法、碱皂化-液液萃取法,同时对其色谱条件进行了优化。通过对实际样品进行测定,结果表明该方法适用范围广、针对性强、准确度高和重现性好,可满足各类食品中叶黄素的检测。通过对市售的820个样品进行测定,总结了常见样品中叶黄素的存在形式,明确了各类样品中叶黄素的含量情况,为消费者选择提供数据参考。
