香蕉低聚糖对双歧杆菌增殖条件的优化
2019-08-27范媛媛罗诗泳苏雪群王娟
范媛媛,罗诗泳,苏雪群,王娟
(1.顺德出入境检验检疫局综合技术服务中心,广东 佛山 528303;2.华南理工大学食品学院,广东 广州 510641)
低聚糖是指由3 个~10 个单糖分子通过糖苷键聚合而成的糖类化合物,是一类重要的生物信息分子,有多方面的生物功能,如增强免疫力、促进益生菌增殖、改善肠道微生态环境、抗氧化、增加某些必需矿物质元素的吸收等等。在健康人体消化道中的500 多种细菌中,其数量达100 兆以上,其中双歧杆菌是人体肠道内正常的菌群,是人类研究最广泛的益生菌,可以调节肠道菌群、预防和治疗腹泻及便秘、排除毒素、提高机体免疫力、抗癌等生理保健功能。双歧杆菌数量的减少或消失是“不健康”状态的标志,双歧杆菌是人体健康的晴雨表。双歧杆菌是有益菌,是人类研究最广泛的益生菌之一。经研究发现,低聚糖与益生菌协同作用,可以更好的发挥二者的在改善肠道微生态环境、预防和治疗腹泻及便秘等方面的生理功能[1-5]。
目前功能性低聚糖已成为生物技术方面研究亮点,而国内研究主要集中在壳低聚糖、果低聚糖、魔芋低聚糖及一些中药提取物中的低聚糖,针对香蕉中低聚糖的研究却相对匮乏,而香蕉低聚糖属于功能性低聚糖,不仅是双歧杆菌、乳酸菌等一些益生菌的增殖因子,而且它是替代蔗糖的新型功能性糖源[6-11]。除Wang 等报道了香蕉低聚糖、香蕉抗性淀粉、膳食纤维的润肠通便功能,并设计动物实验证实大蕉低聚糖具有促进肠道蠕动的效果外,有关香蕉低聚糖对乳杆菌增殖效果的研究却未见报道[12-18]。
文中以香蕉低聚糖为碳源,以纯度大于75%的低聚果糖为阳性对照,探寻香蕉低聚糖是否对双歧杆菌有增殖作用,以及双歧杆菌的最佳增殖条件及规律,为微生态制剂的研制、微胶囊保健品的开发、以及集营养、保健、食疗于一体的功效食品的生产提供基础数据和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
香蕉低聚糖(低聚糖含量:79.28%):华南理工大学食品科学与工程学院实验室自制;青春双歧杆菌(ATCC 15703):广东环凯微生物科技有限公司;低聚果糖(纯度>75%):广州菲博生物科技有限公司;基础培养基(不含葡萄糖)、双歧杆菌琼脂培养基:广东环凯微生物科技有限公司。
1.1.2 试剂与培养基的配制
试验组:10 mL 基础培养基 +(2 g/L~10 g/L)的香蕉低聚糖+1 mL 一定浓度的双歧杆菌菌悬液。
阴性对照组:10 mL 基础培养基+0 g/L 的香蕉低聚糖+1 mL 一定浓度的双歧杆菌菌悬液。
阳性对照组:10 mL 基础培养基+4 g/L 的低聚果糖+1 mL 一定浓度的双歧杆菌菌悬液。
1.2 仪器与设备
SANYO MIR-153 多功能培养箱:日本三洋公司;ESCO CLASSⅡType A2 生物安全柜:新加坡艺思高科技有限公司;Synbiosis Acolyte 菌落计数仪:英国Synbiosis 公司;BUGBOX 厌氧工作站:UK SUSKINN TECHNOLOGY LTD。
1.3 方法
1.3.1 香蕉低聚糖的提取、纯化及含量测定
用超声波法辅助提取香蕉低聚糖,粗提液经过凝胶柱层析纯化后,采用蒽酮-硫酸法测定低聚糖含量[19-21]。
1.3.2 基础培养基的配制
大豆蛋白胨5.0 g、酵母粉10.0 g、胰胨5.0 g、无机盐液 40 mL(每 1 L 含 K2HPO41.0 g、KH2PO41.0 g、CaCl20.2 g、MgSO4·7H2O 0.48 g、NaHCO310.0 g、NaCl 2.0 g、L-半胱氨酸0.5g)、蒸馏水1L[22]。121℃高压灭菌30min,pH 值调至 7.0~8.0。
1.3.3 制备菌悬液
无菌条件下,将标准菌株活化,即将青春双歧杆菌(ATCC 15703)标准菌株接种于无菌平皿内,及时将15 mL~20 mL 冷却至46 ℃双歧杆菌琼脂培养基倾注于平皿,混合均匀后,于36 ℃厌氧培养箱中培养48 h,从培养后的平板中挑取适量的菌落,接种于无菌生理盐水,搅拌均匀后,进行梯度稀释,再用无菌吸头吸取1 mL 菌悬液接种于无菌平皿内,同上操作后进行培养、计数[23-25]。根据计数结果,选取浓度在104CFU/mL~108CFU/mL 的菌悬液备用。
1.3.4 培养时间对双歧杆菌增殖数量的影响
将不同质量浓度的香蕉低聚糖(2、4、6、8、10 g/L)和1 mL 的5.2×106CFU/mL 的菌悬液,分别加入10 mL的pH 7.5 的基础培养基中;同时做阴性、阳性对照组。混匀,于(36±1)℃厌氧培养 48 h,双歧杆菌在 24 h 内增殖缓慢,培养期间,选取不同的时间点计数(12、24、28、32、36、40、44、48 h),每个时间点做 3 个平行,取平均值。
1.3.5 香蕉低聚糖的添加量对双歧杆菌增殖数量的影响
在 pH7.5、接种量为 1 mL 的 5.2×106CFU/mL 的双歧杆菌菌悬液的基础培养基中,添加浓度为2、4、6、8、10 g/L 的香蕉低聚糖,(36±1)℃厌氧培养 40 h,分别测定双歧杆菌的菌落数,取对数后与添加量作图,比较不同香蕉低聚糖添加量对双歧杆菌增殖数量的差异,得出最佳低聚糖的添加量。
1.3.6 初始菌液浓度对双歧杆菌增殖数量的影响
将 1 mL 不同浓度的双歧杆菌菌悬液(104、105、106、107、108CFU/mL)和 4 g/L 的香蕉低聚糖加入 10 mL的pH 7.5 的基础培养基中,混匀,(36±1)℃厌氧培养40 h,分别测定不同浓度的菌悬液中双歧杆菌的菌落数。每个浓度做3 个平行,取平均值。可知双歧杆菌菌落数最高时的初始菌液浓度。
1.3.7 基础培养基的初始pH 值对双歧杆菌增殖数量的影响
将4 g/L 的香蕉低聚糖和1 mL 的5.2×106CFU/mL的菌悬液,分别加入 10 mL 的 pH 值为 5.0、5.5、6.0、6.5、7.0、7.5、8.0 的基础培养基中,混匀,于(36±1)℃厌氧培养40 h,分别测定不同pH 值的菌悬液中双歧杆菌的数量。每个pH 值做3 个平行,取平均值。可知此双歧杆菌菌落数最高时的基础培养基初始pH 值。
1.3.8 Box-Behnken 中心组合试验设计
按照Box-Behnken 的中心组合试验设计原理,选择对双歧杆菌增殖有显著影响的4 个因素:培养时间(A)、低聚糖添加量(B)、初始菌液浓度对数值(C)和基础培养基初始pH 值(D),进行四因素三水平的响应面分析试验,每个处理测定3 次,取平均值。试验设计因素水平见表1。

表1 因素水平编码表Table 1 Factors and levels of Box-Behnken design
1.4 数据统计分析
利用统计分析软件Design Expert 建立回归模型,确定双歧杆菌最佳增殖数量的条件及各因素与响应值之间的真实关系,并对双歧杆菌增殖规律的数学模型进行方差分析,以验证真实值与预测值之间及检验方程的有效性。建立各因素间的回归优化响应曲面图,并对各因素间的交互作用进行方差分析与优化,通过回归模型得出双歧杆菌的最佳增殖条件。
2 结果与分析
2.1 培养时间对双歧杆菌增殖数量的影响
以双歧杆菌菌落数的对数与培养时间作图见图1。
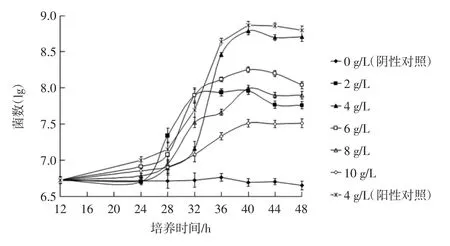
图1 培养时间对青春双歧杆菌增殖数量的影响Fig.1 Effect of culture time on the proliferation of bifidobacterium adolescentis
由图1可知,不同质量浓度的香蕉低聚糖(2、4、6、8、10 g/L),对双歧杆菌的增殖作用都是在培养40 h 左右达到高峰,然后双歧杆菌的生长进入稳定期。阴性对照组在48 h 的培养期间内,菌落数变化无显著性差异(P>0.05),阳性对照组在 36 h 起,双歧杆菌数量可达到108数量级,在40 h 达到高峰。此外,阳性对照组的菌数大于香蕉低聚糖添加量为4 g/L 的培养液中的菌数。说明香蕉低聚糖作为碳源对双歧杆菌的增殖作用没有低聚果糖强。
2.2 低聚糖添加量对双歧杆菌增殖数量的影响
以双歧杆菌菌落数的对数与低聚糖的添加量作图见图2。
由图2可知,不同浓度的香蕉低聚糖对双歧杆菌的体外生长有不同程度的影响。当低聚糖的添加量为4 g/L 时,双歧杆菌的增殖数量最多,可达到108数量级;当低聚糖的添加量为10 g/L 时,双歧杆菌的增殖数量明显最低,说明高浓度的低聚糖对双歧杆菌的生长有抑制作用。这可能是由于高浓度的低聚糖造成培养基的碳源量过高,双歧杆菌在代谢发酵后产酸,使培养基偏酸,造成了高渗透压的环境,双歧杆菌细胞脱水,从而抑制了生长。由此说明,低聚糖作为双歧杆菌的生长增殖因子有一定的浓度作用范围,过高或过低都不适宜双歧杆菌的生长[26-28]。
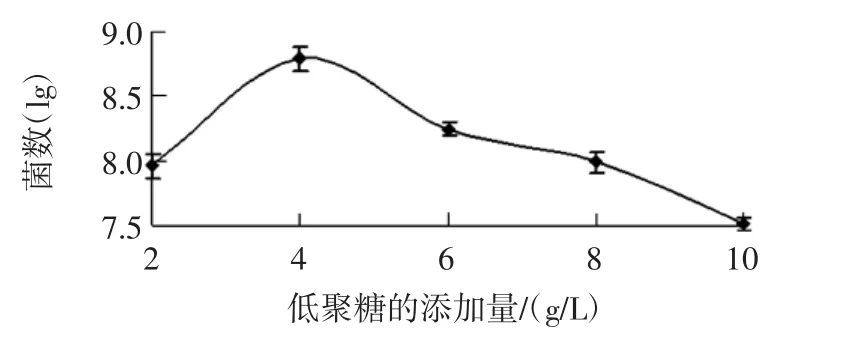
图2 香蕉低聚糖的添加量对青春双歧杆菌增殖数量的影响Fig.2 Effect of additive amount of banana oligosaccharide on the proliferation of bifidobacterium adolescentis
2.3 初始菌液浓度对双歧杆菌增殖数量的影响
以双歧杆菌菌落数的对数与初始菌液浓度作图见图3。
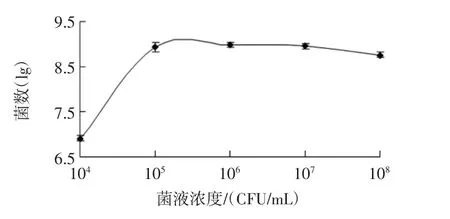
图3 初始菌液浓度对青春双歧杆菌增殖数量的影响Fig.3 Effect of concentration of bacteria suspensions on the proliferation of bifidobacterium adolescentis
由图3可知,不同浓度的初始菌液浓度对双歧杆菌的体外生长有不同程度的影响。在香蕉低聚糖的浓度为4 g/L、基础培养基的pH 值为7.5 时,初始菌液的浓度为106时,双歧杆菌的数量达到108数量级;当初始菌液浓度为105时,双歧杆菌的数量基本达到最大值。当初始菌液浓度小于105时,适应期较长;当初始菌液浓度大于106时,双歧杆菌的增殖速度较慢,基本维持在108数量级。这可能是由于培养基的营养物质和能量有限,菌液浓度过高时,菌体间会产生竞争性抑制,导致菌体数量的平衡或降低,从而使增殖速度减缓甚至停止。
2.4 基础培养基的初始pH值对益生菌增殖数量的影响
以双歧杆菌菌落数的对数与初始pH 值作图见图4。
由图4可知,香蕉低聚糖的浓度为4 g/L、菌悬液的浓度为106CFU/mL 时,对双歧杆菌的增殖效果最好的基础培养基的pH 值为7.5。当pH 值小于7.0 时,双歧杆菌的增殖速度慢、数量少,可能是由于培养基的酸度过高,不利于双歧杆菌的生长繁殖,所以延滞期长,而双歧杆菌生长又会产生乳酸等酸性物质,导致增殖数量一直比较低;当pH 值为8 时,培养基呈碱性,不利于其生长繁殖[26-28]。
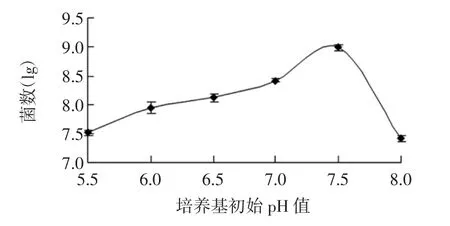
图4 基础培养基的初始pH 值对青春双歧杆菌增殖数量的影响Fig.4 Effect of pH of basic medium on the proliferation of bifidobacterium adolescentis
2.5 响应面试验结果与分析
2.5.1 响应面回归模型的建立与分析
响应面试验结果见表2,对表2数据进行回归分析,得二次多项式回归方程:
Y=-147.098 58+1.390 75A+0.294 41B+2.551 71C+32.412 79D+0.004 062 5AB-0.011 450AC-0.033 978AD+0.012 500BC+2.067 79×10-15BD-0.114 09CD-0.0131 21A2-0.060 395B2-0.103 68C2-2.070 41D2
为了检验方程的有效性,对双歧杆菌增殖规律的数学模型进行方差分析,方差分析结果见表3。
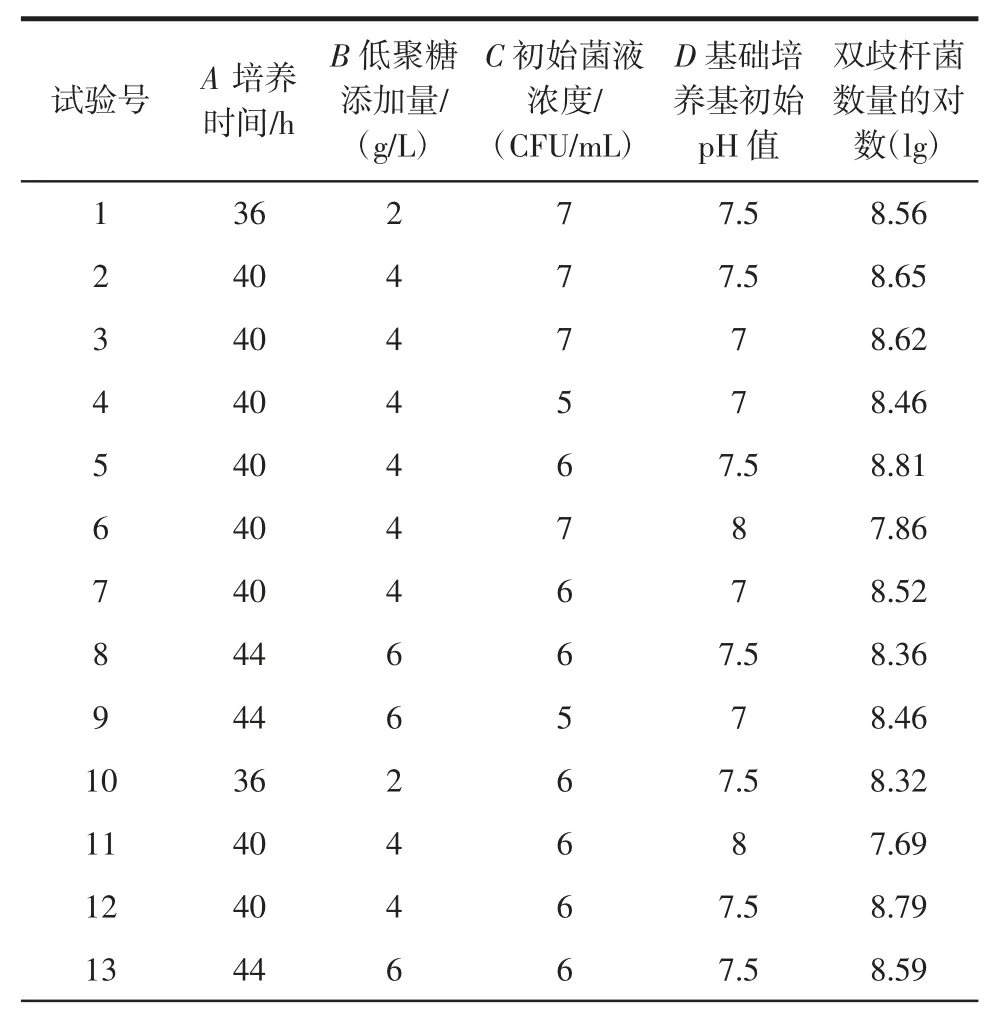
表2 响应面试验设计与结果Table 2 Box-Behnken design and test results
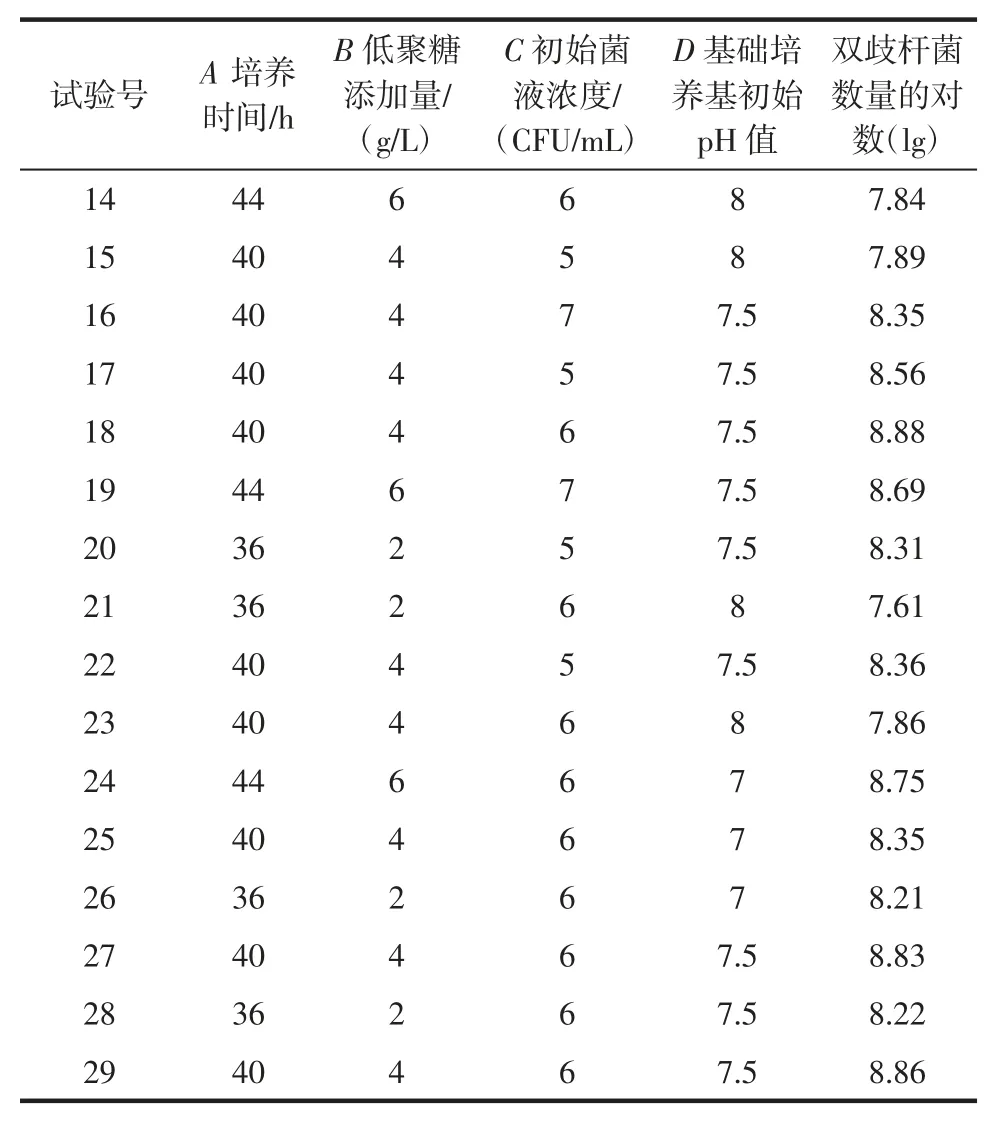
续表2 响应面试验设计与结果Continue table 2 Box-Behnken design and test results
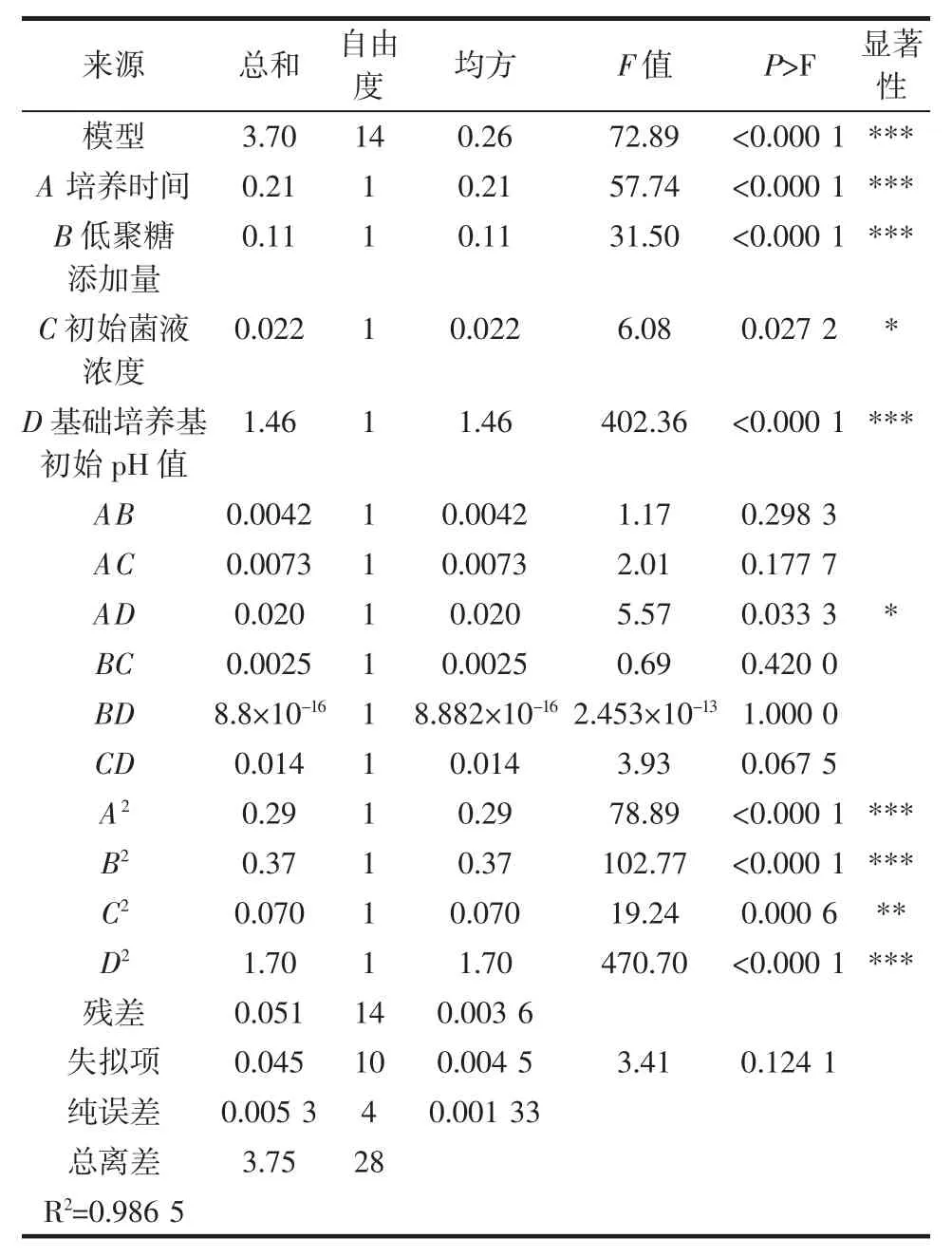
表3 回归模型方差分析Table 3 The variance analysis of regression equation
方差分析中模型P 值<0.0001 说明回归方程是极显著的(P<0.01),相关系数 R2=0.986 5 说明响应值的变化有98.65%来源于所选变量,即培养时间、低聚糖添加量、初始菌液浓度对数值和基础培养基pH 值。失拟项不显著,说明模型合适,回归方程对试验拟合情况好,可以较好的描述各因素与响应值之间的真实关系,可以利用该回归方程代替试验真实点对试验结果进行分析。
一次项中培养时间、低聚糖添加量和基础培养基pH 值的P 值均小于0.001,说明这3 个因素对结果的影响非常显著,且这3 个因素的平方项的P 值也小于0.001,说明这3 个因素的平方项对结果的影响也非常显著。一次项中初始菌液浓度的P 值为0.027 2,小于0.05,说明其对结果的影响显著。6 个交互项中只有培养时间和基础培养基pH 值交互作用的P 值小于0.05,说明二者交互作用对结果影响显著。
2.5.2 响应面交互作用的分析与优化
各因素的交互作用对双歧杆菌增殖数量的影响见图5~图10。
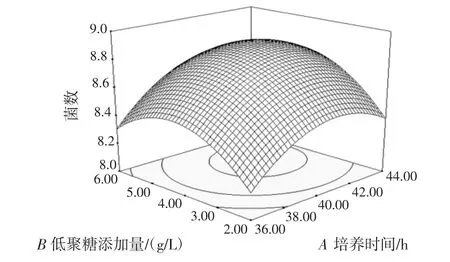
图5 培养时间与低聚糖添加量的交互作用对双歧杆菌增殖数量的影响Fig.5 Effect of culture time and additive amount of banana oligosaccharide on the proliferation of bifidobacterium adolescentis
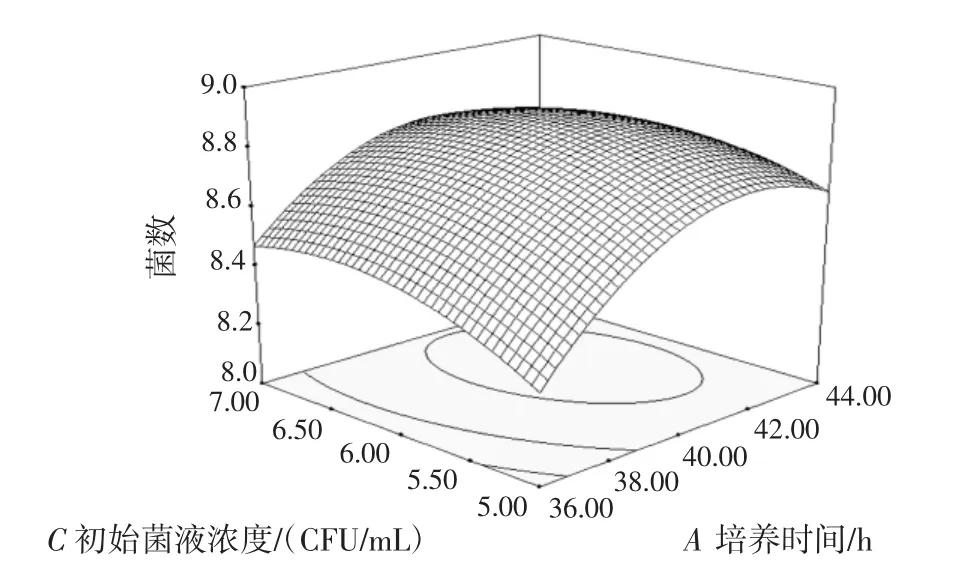
图6 培养时间与初始菌液浓度的交互作用对双歧杆菌增殖数量的影响Fig.6 Effect of culture time and concentration of bacteria suspensions on the proliferation of bifidobacterium adolescentis
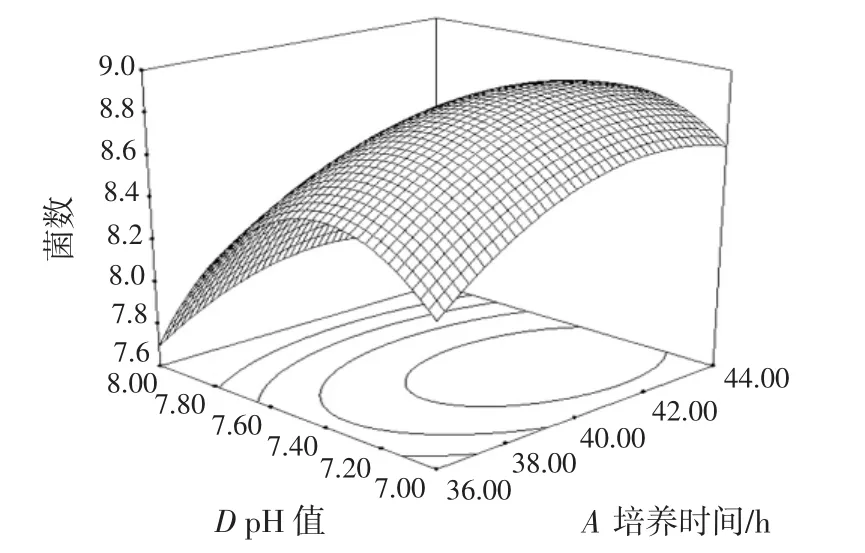
图7 培养时间与培养基的初始pH 值的交互作用对双歧杆菌增殖数量的影响Fig.7 Effect of culture time and pH of basic medium on the proliferation of bifidobacterium adolescentis
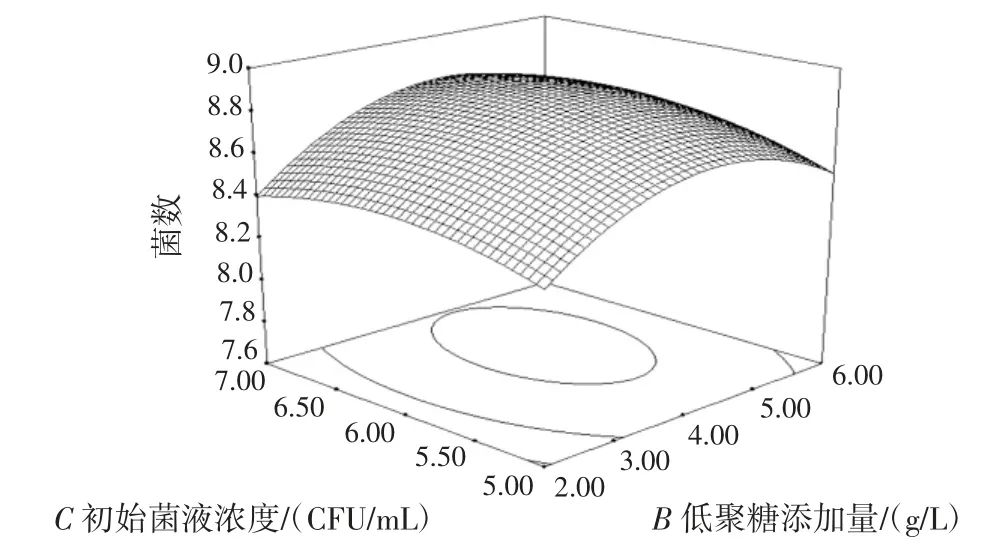
图8 低聚糖添加量与初始菌液浓度的交互作用对双歧杆菌增殖数量的影响Fig.8 Effect of additive amount of banana oligosaccharide and concentration of bacteria suspensions on the proliferation of bifidobacterium adolescentis
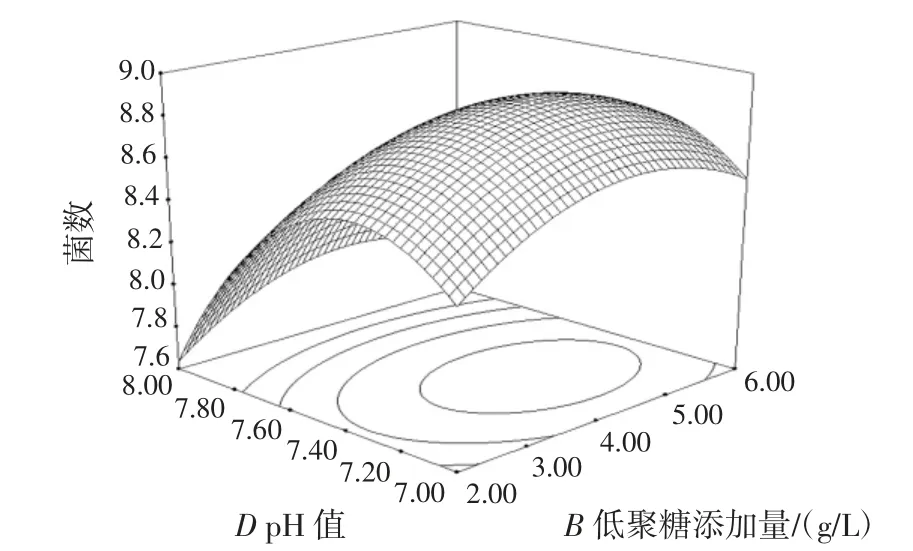
图9 低聚糖添加量与培养基的初始pH 值的交互作用对双歧杆菌增殖数量的影响Fig.9 Effect of additive amount of banana oligosaccharide and pH of basic medium on the proliferation of bifidobacterium adolescentis
响应曲面坡度越陡峭,说明响应值对于该因素的改变越敏感,而曲面坡度越平滑,说明该因素的改变对响应值的影响也就越小[29]。由各因子间的回归优化响应曲面图和方差分析可知,培养时间(A)与低聚糖添加量(B)、培养时间(A)与初始菌液浓度对数值(C)、低聚糖添加量(B)与初始菌液浓度对数值(C)、低聚糖添加量(B)与基础培养基初始pH 值(D)、初始菌液浓度对数值(C)与基础培养基初始pH 值(D)的交互作用对双歧杆菌的增殖影响不显著,培养时间(A)与基础培养基初始pH 值(D)的交互作用对双歧杆菌的增殖影响显著。
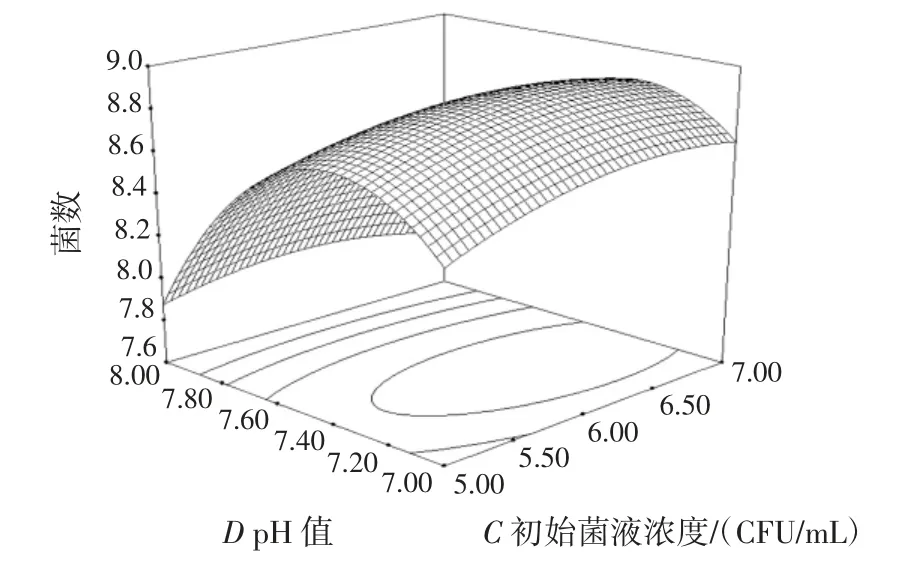
图10 初始菌液浓度与培养基的初始pH 值的交互作用对双歧杆菌增殖数量的影响Fig.10 Effect of concentration of bacteria suspensions and pH of basic medium on the proliferation of bifidobacterium adolescentis
2.5.3 最佳增殖条件的验证
通过回归模型得出的双歧杆菌最佳体外增殖条件为:培养时间为41.49 h,低聚糖添加量为4.48 g/L,初始菌液浓度的对数为6.26,即菌液浓度为1.82×106CFU/mL,基础培养基初始pH 7.31。在此条件下模型的预测值为8.944。考虑到实际操作,将最佳条件调整为:培养时间为41 h,低聚糖添加量为4.5 g/L,菌液浓度为1.8×106CFU/mL,pH 7.30。在此条件下,进行3 次重复试验,实际测得的双歧杆菌数量为8.6×108CFU/mL,取对数后得8.965,与预测值的相对标准偏差(relative standard deviation,RSD)值为 0.166%,提示此模型和方法的可行性和有效性较好。
3 结论
方程与实际操作所确定的双歧杆菌最佳增殖条件为:培养时间41 h,低聚糖添加量为4.5 g/L,菌液浓度为1.8×106CFU/mL,基础培养基初始pH 值为7.30。在此条件下,进行3 次重复试验,实际测得的双歧杆菌数量为8.6×108CFU/mL,取对数后得8.965,与预测值的RSD 值为0.166%。提示此模型和方法的可行性和有效性较好,本试验所得模型合适,回归方程对试验拟合度好,其最佳优化条件适合于双歧杆菌的增殖。
