咸丰鲊广椒中乳酸菌的分离与鉴定及其泡菜发酵特性评价
2019-08-27邓风张一涵罗芳会赵慧君郭壮张振东
邓风,张一涵,罗芳会,赵慧君,郭壮,张振东
(湖北文理学院食品科学技术学院,湖北 襄阳 441053)
泡菜是一种传统发酵食品,可以多种蔬菜为主要原料,经过发酵制成。因其操作简单,风味独特,品种多样,且具有良好的口感而深受大众的喜爱。在我国,主要以四川泡菜最为出名,其产品销量位居全国第一。据不完全统计,2009年四川泡菜产量就已经达到了120 万吨,产值90 亿元[1]。有研究表明,泡菜中存在着多种乳酸菌,如植物乳杆菌、肠膜状明株杆菌和短乳杆菌等[2]。乳酸菌不仅是泡菜发酵中最主要的菌群,还是其独特风味品质的良好来源[3]。
但传统的泡菜制作工艺由于发酵周期长,容易产生较多杂菌的原因会导致其在风味、口感等品质上变差,而通过人工接种菌剂的方式可以增强泡菜中特定乳酸菌的发酵优势,抑制其他杂菌的生长,增强泡菜品质。于是,可以筛选发酵能力优良的乳酸菌,如植物乳杆菌、干酪乳杆菌[4]、戊糖片球菌、肠膜状明串珠菌[5]等用于泡菜的发酵制作。植物乳杆菌(Lactobacillus plantarum)作为一种常见的乳酸菌,它不仅可以帮助调节人体肠道微生物,对于降低胆固醇也有十分重要的意义[6]。因此在众多的食品生产中应用广泛,尤其以发酵食品的生产最为突出,如泡菜[7]、米酒[8]、酱油[9]、酸奶[10]、食醋[11]等。鲊广椒是一种经过自然发酵的调味品,研究表明鲊广椒中蕴含了丰富的乳酸菌资源[12]。因此,本研究从恩施州咸丰地区采集自然发酵的鲊广椒样品,使用传统可培养法,对鲊广椒中的乳酸菌进行了分离、纯化与鉴定,并使用所分离到的乳酸菌发酵制作泡菜,对泡菜水进行品质评价,以期为发酵蔬菜产业提供候选菌株支持。
1 材料与方法
1.1 材料与试剂
豇豆、食盐:襄阳市襄城区鑫源超市;泡菜坛子:淄博海沃家具专营店;石蕊牛乳培养液:湖北文理学院食品科学技术学院实验室自制;MRS 培养基 [蛋白胨、牛肉膏、酵母膏、琼脂(均为生物试剂)、乙酸钠、柠檬酸二胺、磷酸氢二钾、葡萄糖(均为分析纯)]、甘油,氯化钠,磷酸,磷酸二氢钾:均为分析纯,国药集团化学试剂有限公司;鲊广椒样品:从恩施州咸丰地区农户家中采集了5 份不同来源的鲊广椒样品,装入无菌样品瓶,并使用样品箱迅速带回实验室。
1.2 主要仪器
LRH-150 生化培养箱:上海一恒科学仪器有限公司;LXJ-IIB 型低速大容量多管离心机:上海安亭科学仪器厂;SA402B 味觉分析系统(该系统包含AAE、CTO、CAO、COO、AEI 等 5 个测试传感器,2 个参比传感器):日本 Insent 公司;PEN3 电子鼻:德国 Airsense公司;LC202ADXR高效液相色谱仪:日本岛津公司;KH-100DY 超声波清洗机:昆山禾创超声仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离及纯化
从采集到的5 份恩施州咸丰地区鲊广椒中进行乳酸菌的分离:首先取样品2 g 加入到15 mL 无菌的石蕊牛乳培养基中,37 ℃培养48 h,然后用生理盐水将石蕊牛乳培养液稀释至梯度为10-5、10-6和10-7,涂布到含有1%碳酸钙的MRS 培养基中,置于厌氧工作站中37 ℃培养2 d。根据菌落的形态特征,挑选产生透明圈的菌株,进行革兰氏染色与过氧化氢酶试验[13]。将具有透明圈、革兰氏阳性且过氧化氢酶阴性的菌作为待定的乳酸菌在MRS 平板上进行连续划线分离纯化,将纯化后的菌株使用30%的甘油于-80 ℃超低温冰箱中保存。
1.3.2 乳酸菌的鉴定
具体方法参照王丹丹等[14]的方法。即将纯化后的乳酸菌接入MRS 培养基中收集菌体,进行菌株DNA的提取,然后以提取的DNA 为模板应用聚合酶链式反应(polymerase chain reaction,PCR)技术,将扩增后得到的产物连接载体和克隆进行基因组的测序,将测序后获得的乳酸菌166S rRNA 序列在NCBI 的GenBank中进行Blast 比对,选取同源性较高的菌作为模式菌株,构建乳酸菌分离菌株系统发育树,确定所分立的乳酸菌的系统分类地位。
1.3.3 泡菜的制作方法
泡菜制作的工艺流程:豇豆→清洗→沥干→装坛→加入盐水→接种→发酵→产品检测。具体操作为,菌种的准备:将分离并鉴定的乳酸菌使用MRS 液体培养基连续活化3 代,并使用生理盐水重悬。配制盐水:按照每升水称取40 g 食盐的比例溶解、煮沸、冷却晾凉;选材:豇豆无虫蛀,硬度好;装坛:称取豇豆250 g,切成5 cm 小段,装入坛中,再加入晾凉的盐水635.5 mL;接种:按照1%[15]添加量接入所分离的乳酸菌;发酵:将装坛并接种了乳酸菌的坛子在25 ℃条件下放置7 d。
1.3.4 泡菜水的电子鼻测定
具体方法参考杨成聪等[16]的方法,即首先量取15 mL 泡菜水样品装于样品瓶中,55 ℃水浴保温10 min 后,室温25 ℃下静置10 min,然后插入电子鼻探头进行顶空进样测试(注意避免样品沾到瓶盖)。电子鼻金属氧化电极测定时,在45 s 左右达到稳定,为避免测试误差,本研究选取49、50 s 和51 s 时的平均值作为数据分析。检测条件:清洗时间150 s,探头插入时间5 s,自动调零时间5 s,进样流速120 mL/min,内部流量120 mL/min。
1.3.5 电子舌的测定
183****8081:黄昏里,古巷中,老树下。老人机,发短信,求上墙。期中考,心好慌,求小意,上个墙。
样品的准备:首先分别量取150 mL 泡菜水样品,常温下10 000 g 离心5 min,然后收取上清液,再量取60 mL 上清液用无菌水稀释至一倍备用。样品检测:当电子舌系统进行传感器自检和诊断后,将经处理后的样品倒入样品测试杯中,然后参照Kobayashi 等[17]的方法进行操作,对不同样品的酸味、苦味、涩味、咸味、鲜味、后味A(涩味的回味)以及后味B(苦味的回味)7 个不同滋味进行检测分析。
1.3.6 泡菜水有机酸的测定
流动相的配制:配制0.01 mol/L 磷酸二氢钾的溶液,调节pH 值至2.3,进行抽滤,然后超声5 min 后备用。样品的前处理:吸取2 mL 的泡菜水到10 mL 容量瓶中,加入 200 μL 的 0.1 mol/mL 的磷酸溶液,加流动相至10 mL。将已处理好的样品溶液过0.22 μm 滤膜,取1 mL 装入样品瓶中进行测定。测定条件:使用反向C18 柱(4.6 mm×250 mm,5 μm)进行检测,检测器波长为 215 nm,流速为 1 mL/min,进样量为 20 μL,柱温为30 ℃。
1.3.7 数据分析
使用SPSS Statistics 17.0 的Kruskal-Wallis 对不同泡菜水样品进行显著性分析,作图均使用origin 8.5进行。
2 结果与讨论
2.1 乳酸菌的分离与鉴定
图1 部分乳酸菌分离菌株形态Fig.1 The morphology of the lactic acid bacteria isolates
将得到的20 株乳酸菌提取基因组DNA,并通过PCR 与测序,获得它们的16S rRNA 序列后,在Gen-Bank 数据库进行BLAST 比对,比对结果显示这些菌株的序列均与植物乳酸杆菌(Lactobacillus plantarum)、戊糖乳杆菌(Lactobacillus pentosus)及类植物乳杆菌(Lactobacillus paraplantarum)的模式菌的16S rRNA 序列之间的相似度均达到99%以上。从NCBI 数据库提取相似度较高的模式菌的16S rRNA 基因序列,使用MEGA7.0[18]构建系统发育树进行系统发育分析,结果见图2。
由图2可知,所分离的乳酸菌与植物乳酸杆菌、戊糖乳杆菌与类植物乳杆菌模式菌聚在同一分支上。有研究认为可以通过多位点序列分型(multilocus sequence typing,MLST)法将植物乳杆菌分成不同的类型[19],因此本研究通过16S rRNA 基因序列分析尚无法将植物乳杆菌群的乳酸菌鉴定到种,只能将所分离到的20 株乳酸菌鉴定为植物乳杆菌群(Lactobacillus plantarum-group)[20]。
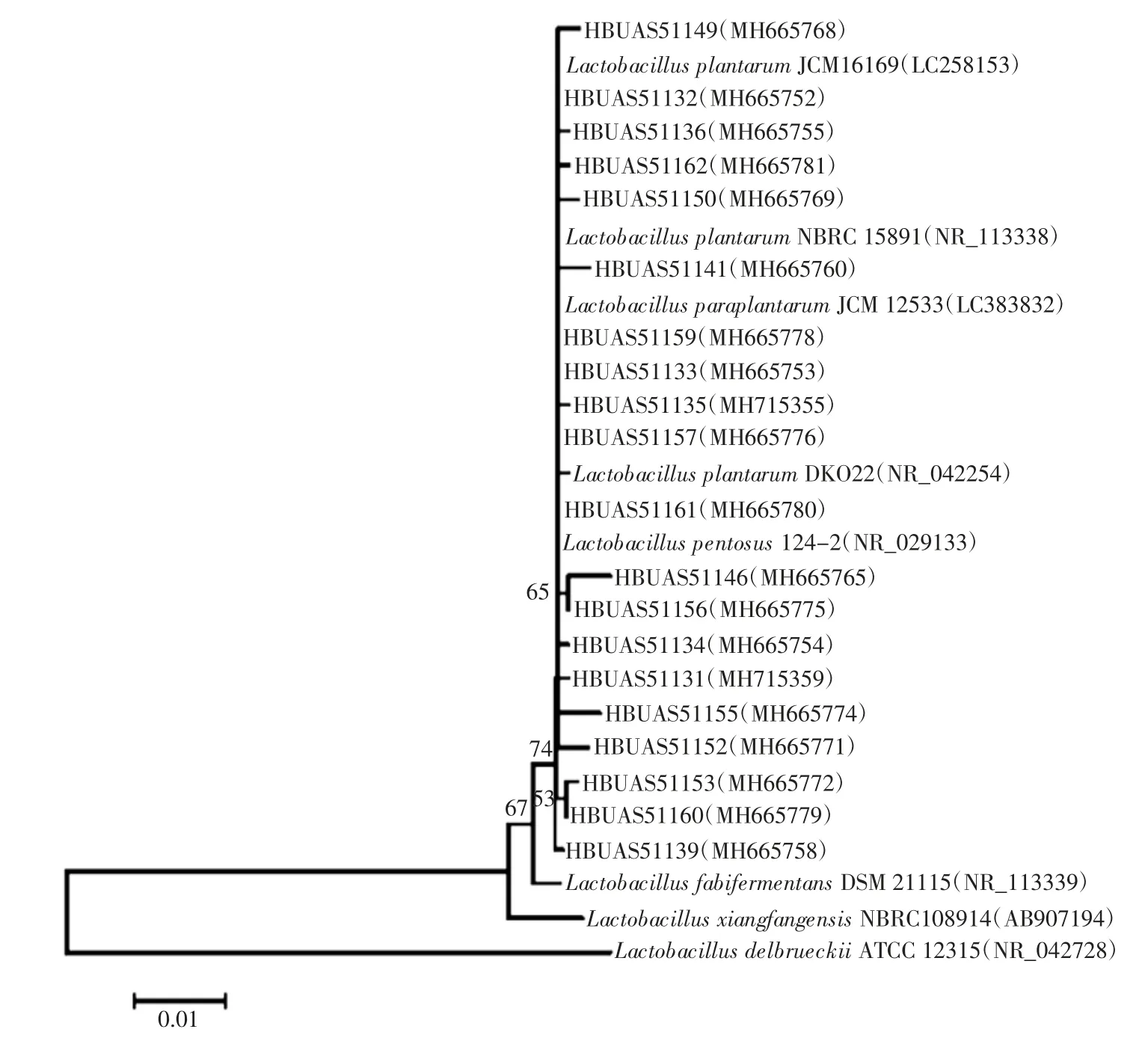
图2 基于16S rRNA 基因序列的乳酸菌分离菌株系统发育树Fig.2 The phylogenetic tree of lactic acid bacteria isolates based on 16S rRNA gene sequence analysis
2.2 发酵不同泡菜挥发性风味的分析
电子鼻是一个模仿生物嗅觉的系统,能够对大多数挥发性成分的气体进行分析和检测,主要由三部分组成:气体流量系统、传感器组和分析控制软件。其中传感器组是由10 个金属氧化气体传感器组成,分别为W1C、W5S、W3C、W6S、W5C、W1S、W1W、W2S、W2W、W3S。不同的传感器能够对不同种类的气味物质做出响应,并且不受到主观因素的影响,因此可以用来对食品的气味做出客观的评价。表1为不同种类的传感器对应性能描述。
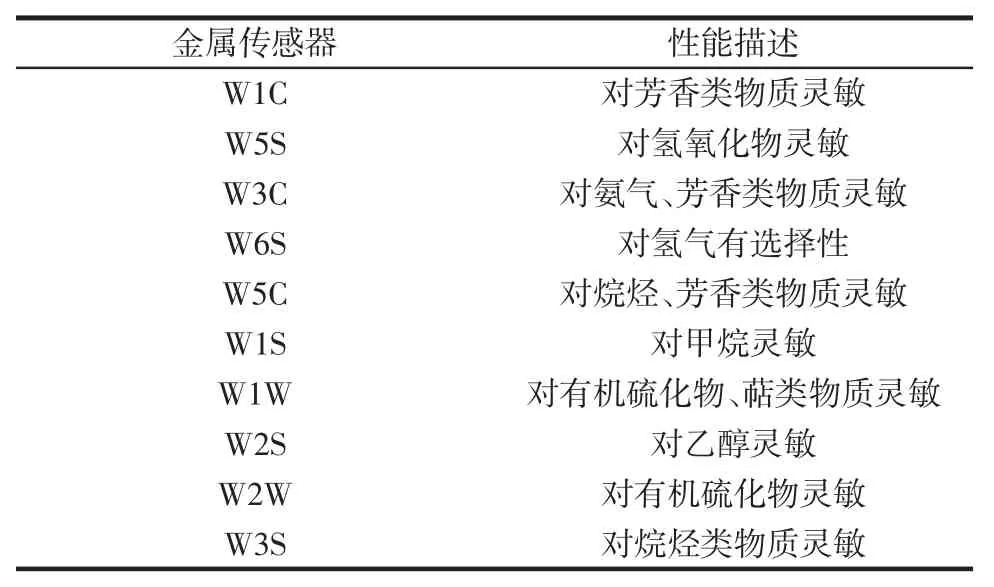
表1 电子鼻的传感器性能描述Table 1 Description of sensor performance of electronic nose
使用电子鼻对泡菜水中各风味物质进行检测分析,把测定的数据绘制成箱形图,见图3。
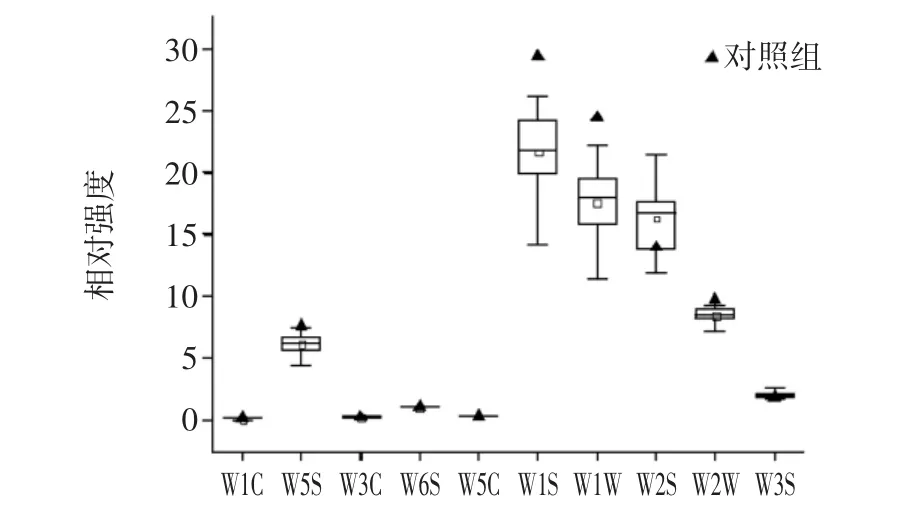
图3 添加不同乳酸菌发酵的泡菜水风味指标的箱形图Fig.3 Box map of various flavor indexes of pickle water fermented with different lactic acid bacteria isolates
由图3可知,本研究中添加了20 株植物乳杆菌发酵制作的不同泡菜水样品间的传感器W1S 及W1W和W2S 的差异性最大,极差值分别为15.19、12.91 和9.63,即所分离的植物乳杆菌对泡菜水中的甲烷、有机硫化物、萜类物质以及乙醇等风味物质有较大的作用,且不同的乳酸菌之间,作用差异较大(p<0.05)。使用传感器 W1C、W3C、W5C、W3S 与 W6S 对不同泡菜水样品测定的响应值不存在显著差异,即样品间的氨气、芳香味、烷烃与氢气类气味物质差异不明显。在泡菜的制作过程中,风味物质仅仅是影响泡菜品质的一个方面。为了进一步研究添加植物乳杆菌对泡菜品质的影响,本研究将以不同泡菜水样品测得的滋味指标做了进一步的分析。
2.3 植物乳杆菌对泡菜水滋味的影响
泡菜的口感是泡菜品质的重要体现,一般来说,酸辣可口,同时苦涩味较少的泡菜的品质较好。为确定分离到的乳酸菌的泡菜发酵特性,采用电子舌技术对泡菜水样品的滋味指标进行了评价,结果见图4。
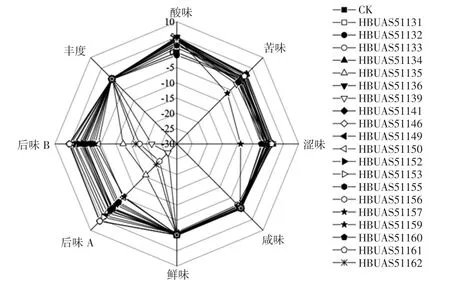
图4 添加不同乳酸菌发酵的泡菜水各滋味指标雷达图Fig.4 Radar map of the taste indices of pickles fermented with lactic acid bacteria isolates
由图4可知,接种了所分离乳酸菌发酵的泡菜水样品的咸味、鲜味和丰度与对照组相比,差异不显著。与未接菌对照处理相比,接种了乳酸菌HBUAS51135、HBUAS51141、HBUAS51146、HBUAS51153、HBUAS -51155、HBUAS51156、HBUAS51157 与 HBUAS51162的泡菜水样品的苦味与涩味无显著差异,而后味A 与后味B 均显著低于对照组(p<0.05);同时,接种了乳酸菌HBUAS51135、HBUAS51141、HBUAS51146、HBUAS -51153、HBUAS51155、HBUAS51156 与 HBUAS51157的泡菜水样品的酸味显著高于未接菌处理(p<0.05),具有酸爽的滋味,同时苦味与涩味及它们的回味也较低,因此可以用来进一步筛选,用作泡菜发酵剂开发的候选菌株。
2.4 泡菜水样品的有机酸分析
乳酸菌可以代谢糖类产生乳酸,形成泡菜的酸爽口感,为进一步说明泡菜水样品酸味产生的原因,使用高效液相色谱法(high performance liquid chromatography,HPLC)测定了泡菜水样品的有机酸组成。通过HPLC 系统,检测到泡菜水样品中的有机酸包括6 种,分别是酒石酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸,具体结果见图5。
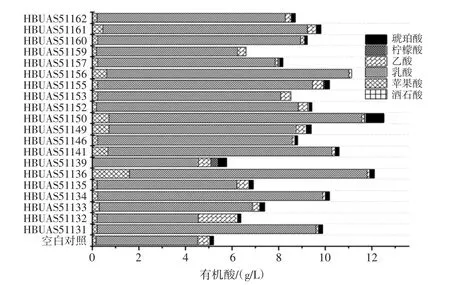
图5 添加不同乳酸菌发酵的泡菜水中有机酸含量Fig.5 The organic acids content in pickle water fermented with different lactic acid bacteria isolates
由图5,与其他有机酸相比,泡菜水样品中乳酸最高含量为4.34g/L~10.81g/L,添加了乳酸菌HBUAS51131、HBUAS51134、HBUAS51136、HBUAS51141、HBUA S-51146、HBUAS51149、HBUAS51150、HBUAS51152、HBUAS51155、HBUAS51156、HBUAS51160、HBUAS -51161 和HBUASS51162 的泡菜水中乳酸含量显著高于对照组,其中添加了乳酸菌HBUAS51131、HBUAS-51134、HBUAS51136、HBUAS51141、HBUAS 51150、HBUAS51155 和HBUAS51156 的泡菜水中乳酸含量高达9.20 g/L。乳酸主要由乳酸菌产生,酸味更加温和,表明这几株菌的产乳酸能力较强,除了能为泡菜的发酵营造一个酸性环境,从而抑制一些其他不耐酸的微生物活动,加快发酵的速度,缩短发酵周期外[21],也能赋予泡菜的更加柔和的滋味。相反,乙酸的酸味则较为刺激[22],从图5中也可以看出乳酸含量高的泡菜水样品的乙酸含量较少,因此乳酸含量较高的菌株,更适用于泡菜发酵剂菌株的开发。结合电子舌的滋味测定结果,乳酸菌HBUAS51141 和HBUAS51156 作为发酵剂制作的泡菜,苦涩味较轻,同时乳酸含量较高,因此更适于用作泡菜复合发酵剂开发的候选菌株。
3 结论
从湖北恩施州咸丰地区采集的5 份鲊广椒样品中共分离得到了20 株乳酸菌,均鉴定为植物乳杆菌。使用所分离到的乳酸菌进行了豇豆泡菜的发酵制作,并对豇豆泡菜水品质进行了品质评价,结果显示使用乳酸菌HBUAS51141 和HBUAS51156 发酵的泡菜水中乳酸含量高达9.20 g/L 以上,同时苦涩味较轻,是豇豆泡菜复合发酵剂开发的优良候选菌株。
