高效装载细胞内源蛋白工程化外泌体的构建
2019-08-27黄琳王殿冰顾宁张先恩
黄琳,王殿冰,顾宁,张先恩,2,3
高效装载细胞内源蛋白工程化外泌体的构建
黄琳1,2*,王殿冰2*,顾宁1,张先恩1,2,3
1 东南大学 生物科学与医学工程学院,江苏 南京 210096 2 中国科学院生物物理研究所 中国科学院生物大分子研究中心 生物大分子国家实验室,北京 100101 3 中国科学院大学,北京 100049
外泌体作为天然药物运送载体具有诸多优点,但其对细胞内源药物 (蛋白、核酸等) 的有限装载限制了其应用。文中以红色荧光蛋白mCherry为模拟细胞内源性货物,通过对供体细胞的基因改造及采用膜定位元件融合策略,将mCherry富集于细胞质膜,再经天然发生 (Biogenesis) 途径,高效分选进入外泌体。结果表明,在CAAX、PB、Palm和CD63四组膜定位元件中,CD63和Palm能有效提高靶蛋白mCherry在外泌体中的装载量。该研究可为工程化外泌体的设计、内源蛋白等货物的高效递送提供参考。
外泌体,药物运送载体,内源蛋白,膜定位元件,装载效率
外泌体是一种由细胞分泌到胞外的脂质双层纳米囊泡,尺寸介于30–150 nm[1]。研究表明,外泌体在自然发生过程中,能够包裹细胞中的生物活性成分(如蛋白质、脂质和核酸等),并将其携带到相邻或远端的细胞中发挥功能[2],因而被认为是细胞间通信的一类介质[3]。此外,外泌体中的成分还能调节细胞的生理病理过程,反映细胞状态变化[4-5]。这些性质使外泌体成为疾病诊断标志 物[6]和天然药物运送载体[7]的研究热点。其主要优点包括[8-10]:1) 外泌体来自身体各个组织,在体液中稳定存在,作为疾病标志物,易于检测,并能反映疾病异质性及发生发展;2) 外泌体起源于自身细胞,作为药物载体,免疫原性低、稳定,甚至能穿过血脑屏障;3) 在体外,由于蛋白活性及RNA稳定性都会受到外界因素影响,因此,外泌体能装载细胞内源药物的特点,使得其作为药物运送载体还具有保护药物活性及稳定性的优势。目前,外泌体已被用于多种药物的递送载体,包括小分子、蛋白质和核酸[11-16],显示较好的治疗效果[17-18]。然而,在自然发生(Biogenesis) 条件下,外泌体对胞内药物的装载量有限,尚难以推广应用[19]。
外泌体对药物的装载方式主要包括两种,即外源货物装载和内源货物装载[8]。其中,外源货物装载主要是通过电转、超声、冻融、挤出及转染等方法使外源药物载入外泌体中;内源货物装载主要是通过外泌体的生物起源使细胞内的药物装载到外泌体中。为了提高外泌体对药物的装载量,已有研究通过外泌体的生物起源成功实现了内源药物在外泌体中的有效装载[16, 20]。但更高效的药物装载,需要更清楚地了解外泌体对货物的包装机理,从而调控货物的分选。因此,如何使细胞内的货物能更好地富集到外泌体仍然是一个挑战。
基于外泌体膜起源于细胞质膜,并且会选择性分选含有某些特定物质膜的特点[21],在前期工作中,我们针对长链RNA药物难以高效递送的难题,发展了一种基于外泌体的新型光控纳米递送系统。该系统利用膜定位元件、光控元件以及外泌体的生物起源,通过microRNA-21治疗剂(miR-21海绵) 在细胞膜的高效富集、光控释放,实现了miR-21海绵的内源高效装载和对白血病细胞的靶向递送,为肿瘤个体化基因诊疗提供了新的途径[22]。本研究则聚焦于蛋白类货物在外泌体中的高效装载,其研究设想是,以红色荧光蛋白mCherry作为模拟装载货物,通过在外泌体供体细胞中融合表达mCherry与膜定位元件,探讨不同膜定位元件对mCherry在外泌体中装载量的影响,进而为外泌体高效递送蛋白类药物提供参考。
1 材料与方法
1.1 主要材料
Lipofectamin3000、蛋白预染marker、4 μm乳胶珠及细胞培养瓶购于Invitrogen公司。DMEM、胎牛血清(FBS) 及Opti-MEM medium购于GIBCO公司。RIPA细胞裂解液、BCA蛋白浓度检测试剂盒及ECL显色液购于碧云天生物技术有限公司。限制性内切酶购于NEB公司。感受态购于北京全式金生物技术有限公司。超滤管和聚偏二氟乙烯(PVDF) 薄膜均购自Millipore公司。抗体购于武汉爱博泰克生物科技有限公司。胶回收试剂盒购于美国Omega公司。PCR引物合成及DNA测序由生工生物工程(上海) 股份有限公司完成。
1.2 方法
1.2.1 质粒构建及慢病毒包装
为了构建相关质粒载体,首先将慢病毒载体PLVX用Ⅰ和Ⅰ酶进行双酶切,其酶切后的产物用胶回收试剂盒进行回收。Palm、CAAX和PB三个膜定位序列则设计到PCR引物上,通过PCR扩增与mCherry进行连接。CD63与mCherry通过RⅠ的酶切位点进行连接。上述连接后的产物与PLVX载体通过Ⅰ和Ⅰ位点进行连接。
上述表达质粒构建好后,先将293T细胞接种于6孔板中,待细胞融合度为60%–70%时,参照Lipofectamin 3000转染试剂使用说明书将目的质粒与辅助包装质粒pLP1、pLP2及VSVG以3︰1︰ 1︰1共转染入293T细胞中。转染48 h后,1 000 r/min离心10 min收集富含慢病毒颗粒的细胞上清。收集的病毒液分装至EP管中,−80 ℃保存备用。
1.2.2 慢病毒浸染及稳转细胞系的建立
将293T细胞在含10%胎牛血清及双抗(青霉素和链霉素) 的DMEM培养基中培养,并置于37 ℃、5% CO2条件的培养箱中。待细胞融合度为50%时,加入一定量的病毒液及4 μg/mL的聚凝胺 (Polybrene) 浸染细胞。24 h后用新鲜培养基替换含病毒的培养基,48 h后用荧光显微镜对细胞进行荧光检测。待观察到细胞有荧光时,加入含有嘌呤霉素(4 μg/mL) 抗生素的新鲜培养基对稳转细胞进行抗性筛选。
1.2.3 细胞培养及外泌体的分离
筛选得到上述稳转细胞后,对其进行扩大培养,待细胞长到60%–70%的汇度后,把培养基换成含有10%外泌体去除FBS的培养基进行培养。48 h后,收集细胞培养上清,并于4 ℃、500×离心5 min,以去除其中残存的细胞。然后,4 ℃、2 000×离心10 min,以去除上清中残存的细胞碎片,10 000×再次离心30 min可得到微囊泡体。最后,将上清于100 000×下离心120 min,即可得到外泌体沉淀。弃去上清,用PBS清洗沉淀后再次离心,即可得到较为纯净的外泌体。
1.2.4 外泌体的形态观察
首先,把10 μL一定浓度的外泌体滴加到300目铜网上,室温吸附5 min,滤纸吸除多余的液体。然后,滴加10 μL 4%的醋酸双氧铀,室温染色1 min,晾干。最后,通过透射电子显微镜(Transmission electron microscope,TEM) 对其进行成像分析。
1.2.5 外泌体的荧光分析
首先,把10 μL外泌体(或微囊泡体) 分别加入5 μL的乳胶珠(4 μm) 中,室温旋转孵育15 min。然后,用PBS稀释至500 μL,室温旋转孵育30 min。随后,通过加入500 μL含100 mmol/L甘氨酸和2% BSA的PBS终止反应,并用1%的BSA洗涤结合了外泌体的珠子3次。用400 μL PBS重悬后,即可用流式细胞分析仪对其进行荧光检测。
1.2.6 外泌体的蛋白免疫印迹分析(Western blotting,WB)
通过离心收集外泌体(或微囊泡体) 沉淀后,加入一定量的RIPA裂解液提取总蛋白,并根据BCA试剂盒说明书对提取的总蛋白进行定量检测。随后,向样品中加入上样缓冲液,开水煮沸5 min使蛋白充分变性。蛋白变性后,将 其加到12%的聚丙烯酰胺凝胶中进行电泳分离(200 V)。待电泳分离后,使用电转仪将蛋白转到PVDF膜上。然后,将PVDF膜放在5%的脱脂奶粉中室温封闭2 h,并依次加入特异性的一抗及酶标二抗进行孵育。最后,加入ECL发光液,并用凝胶成像分析系统对蛋白进行成像分析。
1.2.7 胞内体及外泌体的成像分析
构建好表达不同mCherry融合蛋白的稳转细胞系后,将其培养到玻底小皿中。待其长到一定密度后,即可通过结构光照明显微镜(Structure light illumination microscope, SIM)对细胞中的mCherry进行成像分析。外泌体则直接滴加到载玻片上,将其进行封片后,即可用SIM显微镜进行成像分析。
2 结果与分析
2.1 膜定位融合蛋白mCherry的设计与表征
为了使mCherry固定到细胞质膜上,3种膜定位肽和1种跨膜蛋白被用来与其融合表达,分别为PB、CAAX、Palm及CD63蛋白。四种膜结合元件与膜的相互作用原理如图1所示。其中,PB和CAAX融合在了mCherry的C端,Palm和CD63融合在了mCherry的N端,具体构建如图2A所示。表达融合蛋白的各基因片段构建好后,将其连接到慢病毒载体PLVX上。然后,通过慢病毒浸染的方法构建相应的稳转细胞系。虽然,融合膜定位元件后的mCherry可以固定到细胞膜上,但4种融合蛋白与膜的结合原理都不相同。因此,不同的mCherry融合蛋白在细胞中的分布也会不同,其成像结果如图2B所示。从图中的结果可以看到,没有融合膜定位元件的mCherry分布于整个细胞质中,融合PB和CAAX后的mCherry主要被固定到了细胞质膜上,而与CD63和Palm序列融合后的mCherry在细胞质膜和细胞内都有定位。
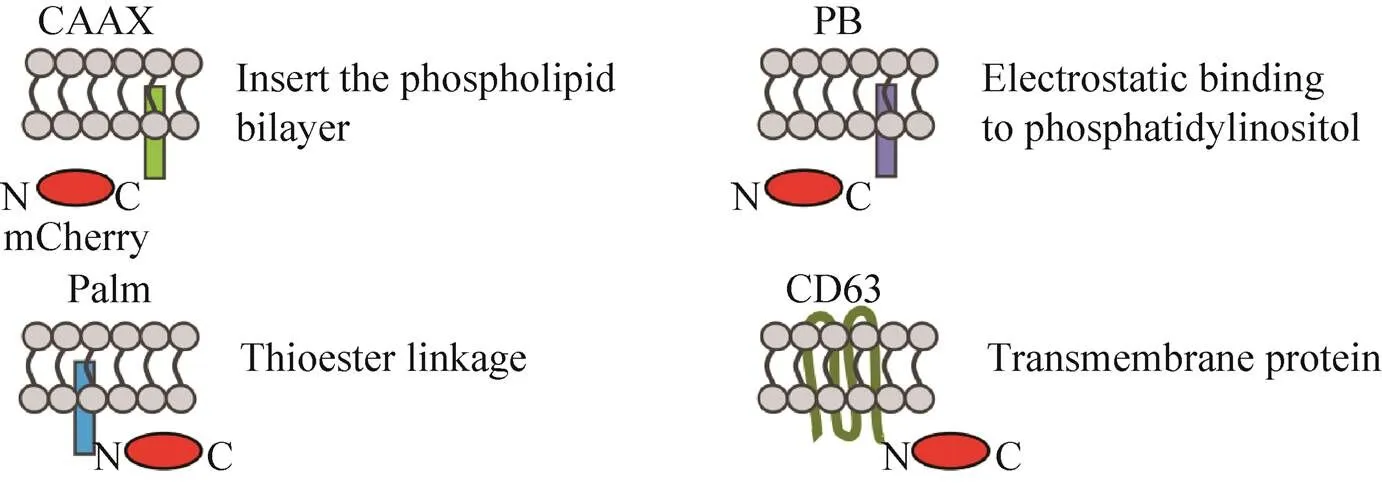
图1 四种膜定位元件与细胞膜相互作用原理[23-26]

图2 mCherry与不同膜定位元件融合表达设计与实验结果(A:用于表达融合蛋白mCherry的质粒示意图;B:表达不同mCherry融合蛋白稳转细胞系的荧光成像)
2.2 外泌体的表征
通过对5种稳转细胞系的扩大培养,采用差速离心法分别提取了相应细胞所分泌的外泌体,即所设计的工程化外泌体。接下来WB、TEM和SIM对提取物进行了外泌体性质表征。WB分析表明,5种细胞中只有过表达CD63的细胞才有相应的条带,而5种细胞所产生的外泌体均含有CD63,说明外泌体具有富集CD63的功能(图3A);在电镜下,提取物呈现茶托状,大小在150 nm左右(图3B)。
SIM成像进一步对所收集的外泌体进行了分析,以验证其中的确有mCherry的红色荧光,结果如图3C所示,没有表达mCherry细胞来源的外泌体中几乎没有红色荧光,而表达CD63-mCherry细胞来源的外泌体中有大量的红色荧光,说明mCherry被外泌体成功包装。
2.3 外泌体中mCherry装载量的分析
由于所选4种膜定位元件的细胞膜结合原理各不相同,它们分别与mCherry融合后可能导致不同的分选效率,因此,提取4种稳转细胞系所分泌的外泌体后,对其中的mCherry含量进行了WB分析比较。如图4A所示,除了无膜定位元件的mCherry对照组外,其余4种都含有mCherry,其中CD63组含量最高,Palm组次之,CAAX和PB组中mCherry的量很少。图4A中mCherry融合物具有不同的迁移率,这是因为融合了不同分子量的膜定位蛋白所致。流式细胞分析表明(图4B),CAAX、PB、Palm和CD63对应外泌体中mCherry的阳性率分别为8.9%、7.3%、23.2%和56.7%,而无膜定位元件的对照组中mCherry阳性率只有4%。上述结果表明,4种膜定位序列都具有将靶蛋白定位在细胞膜并分选入外泌体的能力,以CD63的效果最为明显。
2.4 微囊泡体中mCherry装载量的分析
微囊泡体中mCherry的分析结果如图5所示。其中,Western blotting结果表明,除了无膜定位元件的mCherry外,其余几种都含有mCherry。流式细胞分析结果表明,CAAX、PB、Palm及CD63对应微囊泡体中mCherry的阳性率分别为12.0%、10.8%、17.7%和20.6%。因此,在微囊泡体中,4种mCherry融合蛋白在其中的富集效果差别不大,且都不如外泌体中CD63-mCherry的富集效果好。
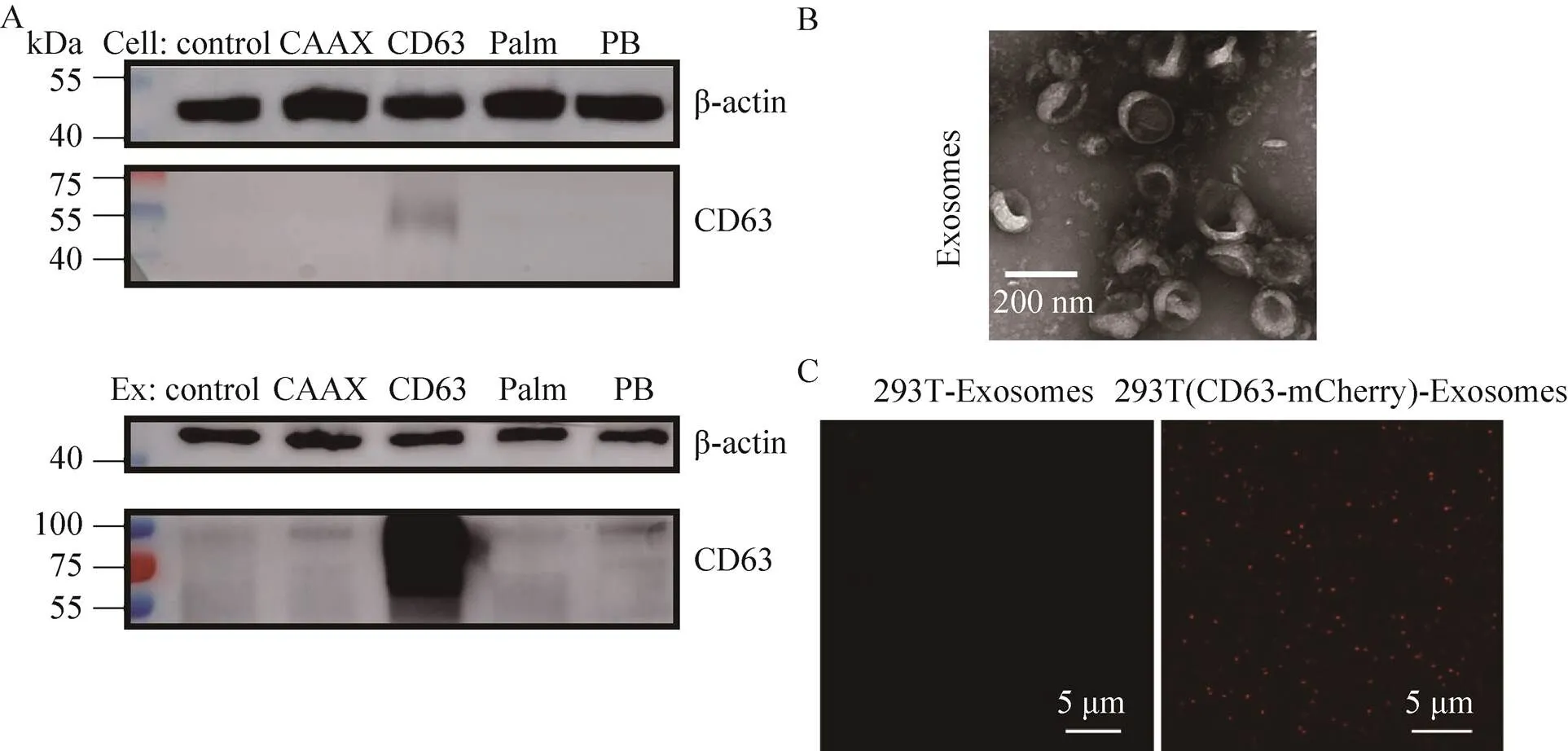
图3 外泌体的表征(A:外泌体中CD63和β-actin蛋白的WB分析;B:外泌体的TEM成像;C:外泌体的SIM超分辨显微成像)
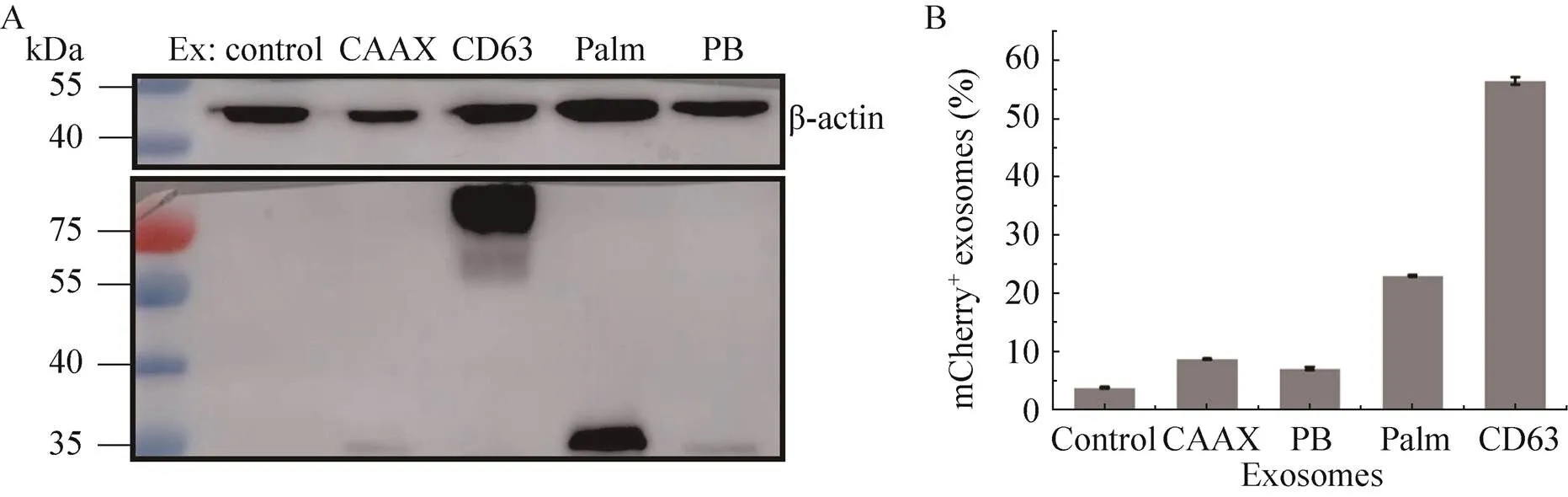
图4 外泌体中mCherry的定量分析
2.5 mCherry在细胞中的定位分析
不同mCherry融合蛋白在外泌体中存在装载量差异,这可能与外泌体的生物起源有关。如图6A所示,外泌体是通过细胞质膜的内吞、多囊泡体形成以及多囊泡体与细胞质膜融合释放所形成。为了分析分选量差异的原因,SIM超分辨成像技术对4种细胞中mCherry的定位进行了分析。结果表明,不同的膜定位元件会使mCherry被定位到细胞的不同膜结构(图6B)。其中,CAAX和PB序列能使mCherry定位到细胞质膜上,但几乎不定位在内囊泡膜上,而Palm和CD63会使mCherry同时靶向到细胞质膜和内囊泡膜(后者为细胞中红色聚集亮斑),CD63的这种功能最为明显。
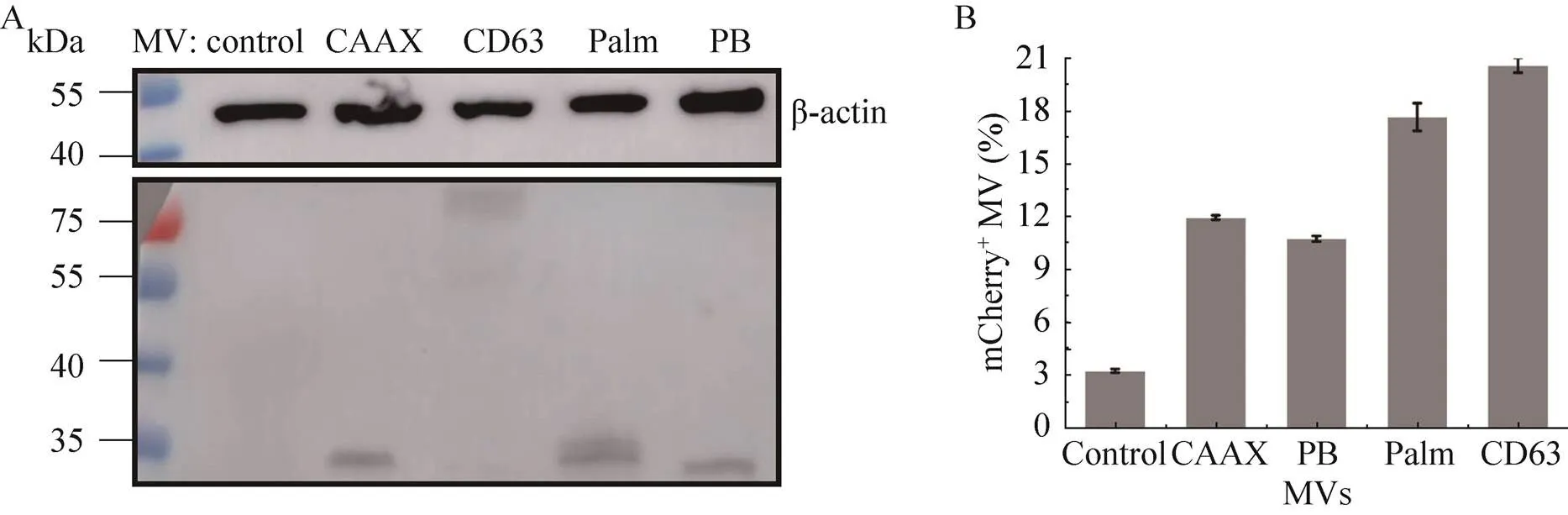
图5 微囊泡体中mCherry的定量分析
3 讨论
针对外泌体载药效率低的缺点,通过在蛋白一端融合表达膜定位元件使其富集到细胞质膜上的方法已有不少研究,例如,通过CD9[27]、CD63[28]、Lamp2a[29]和Palm[25]等的膜定位作用,已实现了细胞内源RNA和蛋白在外泌体中的富集。但由于外泌体中蛋白的分选机理也还未完全被了解,哪一种膜定位序列能更好提高蛋白在外泌体的装载效率也未见研究报道,因此,本文选择了几种具有不同细胞膜结合原理的元件对其进行分析,包括CAAX、PB和Palm三个膜定位肽,以及CD63跨膜蛋白。
Western blotting和流式细胞技术对5种稳转细胞系来源外泌体中mCherry的半定量分析表明,4种膜定位元件都能提高mCherry在外泌体中的装载量,但效率各不相同。如图1所示,PB携带正电荷,与细胞质膜上带负电的磷脂酰肌醇静电作用而固定到膜上[23]。CAAX是通过异戊二烯基团法尼基与细胞质膜上磷脂双分子层的相互作用而与膜结合[24]。Palm则通过半胱氨酸与脂肪酸棕榈酸之间的硫酯键作用与细胞质膜结合[25]。CD63是一个富集在外泌体中的四跨膜蛋白[26]。所以,上述4种膜定位元件可以使mCherry结合在细胞质膜的不同成分上,而外泌体对细胞质膜上不同成分的选择性分选富集,就会导致融合有不同膜定位元件的mCherry随与之相互作用的成分以不同的量分选到外泌体中。对此,细胞中mCherry的SIM成像分析也证明了4种膜定位元件使mCherry以不同量定位在了外泌体起源的内囊泡上。此外,微囊泡体中4种mCherry融合蛋白的装载量分析结果显示,4种融合蛋白在微囊泡体中的富集效果相似。其中,CAAX和PB与外泌体中的几乎相同,但CD63和Palm都没有外泌体中的效果好。虽然微囊泡体的膜是直接起源于细胞质膜,但mCherry在细胞质膜上的富集并没有使其在微囊泡体中产生大的富集量。该结果也可以说明外泌体会对细胞质膜上的成分进行选择性富集。而且,通过在细胞膜上富集的方法,外泌体比微囊泡体能更好地分选细胞内源蛋白。
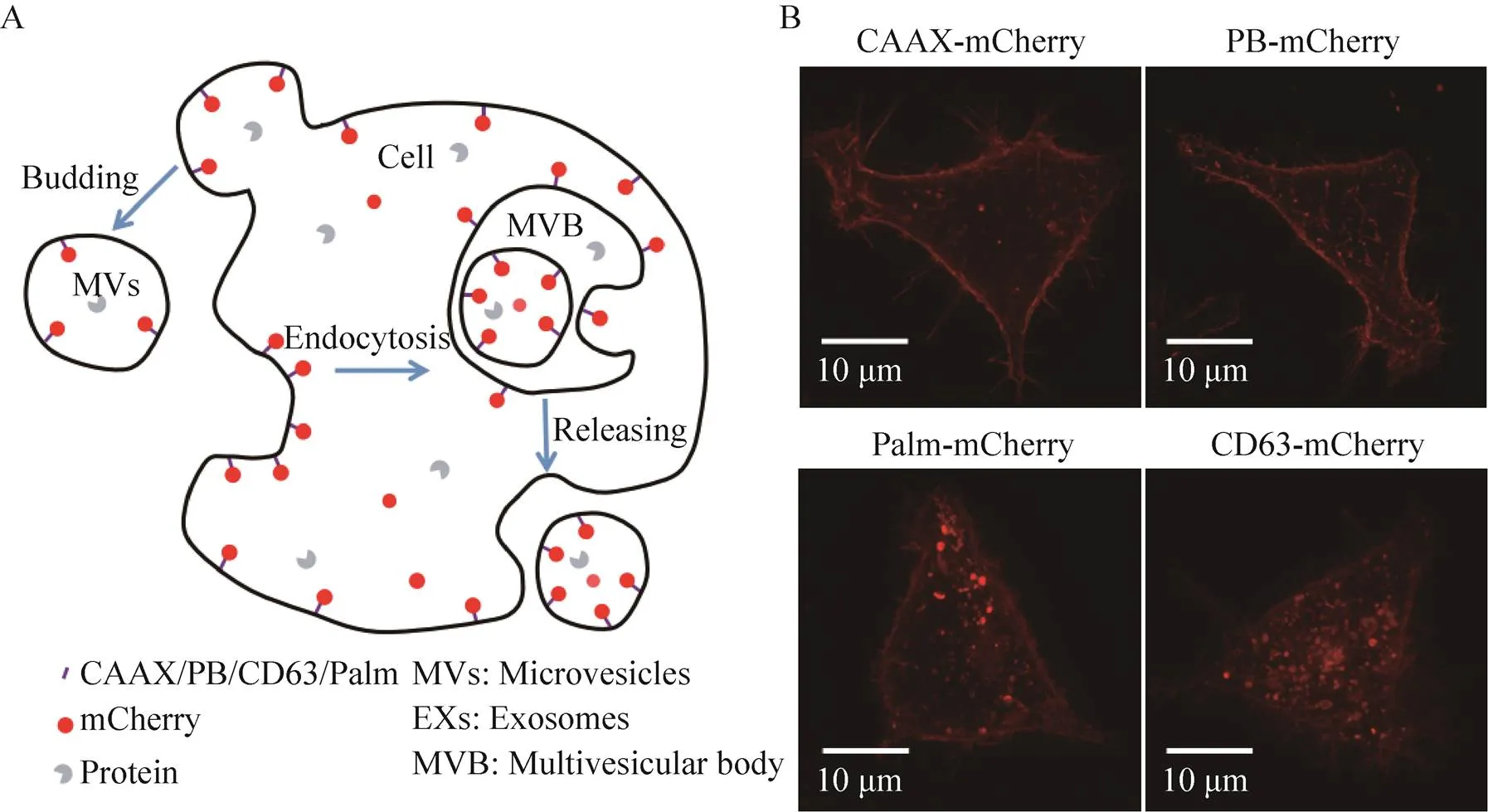
图6 mCherry在细胞中的定位分析(A:外泌体的生物发生起源示意图;B:mCherry融合不同的膜定位元件后在细胞中的SIM成像)
以mCherry作为模拟蛋白,虽然CD63蛋白和Palm都很好地提高了mCherry在外泌体中的装载量,但本研究只选择了部分膜定位元件进行分析,而更好地提高蛋白在外泌体中的分选量,还需基于外泌体对蛋白的分选机理,对更多的膜定位元件进行分析。而且,装载药物时该装载效率能否使之在细胞中达到治疗效果,以及该工程化外泌体所装载的药物是否具有活性都需验证。此外,由于外泌体对蛋白的分选具有复杂的机理,而不只是单一因素决定,因此不同膜定位元件是否对所有蛋白都具有相似的效果也需要进一步验证。
综上,本研究不仅证明了不同的膜定位元件可以使mCherry在外泌体中产生装载量的差异,还初步分析了其产生差异的可能原因,确定了CD63是其中能使靶蛋白更好分选入外泌体中的膜定位元件。
致谢:感谢生物成像中心(IBP-CAS),特别是李硕果,张龙龙等人对SIM、TEM工作的技术支持。
[1] Andaloussi SEL, Mäeger I, Breakefield XO, et al. Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov, 2013, 12(5): 347–357.
[2] Xu R, Rai AL, Chen MS, et al. Extracellular vesicles in cancer-implications for future improvements in cancer care. Nat Rev Clin Oncol, 2018, 15(10): 617–638.
[3] Tkach M, Théry C. Communication by extracellular vesicles: where we are and where we need to go. Cell, 2016, 164(6): 1226–1232.
[4] van Niel G, D’Angelo G, Raposo G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol, 2018, 19(4): 213–228.
[5] Momen-Heravi F, Getting SJ, Moschos SA. Extracellular vesicles and their nucleic acids for biomarker discovery. Pharmacol Ther, 2018, 192: 170–187.
[6] Soung YH, Ford S, Zhang V, et al. Exosomes in cancer diagnostics. Cancers, 2017, 9(1): 8.
[7] Vader P, Mol EA, Pasterkamp G, et al. Extracellular vesicles for drug delivery. Adv Drug Deliv Rev, 2016, 106: 148–156.
[8] Armstrong JPK, Stevens MM. Strategic design of extracellular vesicle drug delivery systems. Adv Drug Deliv Rev, 2018, 130: 12–16.
[9] Liang HX, Huang K, Su T, et al. Mesenchymal stem cell/red blood cell-inspired nanoparticle therapy in mice with carbon tetrachloride-induced acute liver failure. ACS Nano, 2018, 12(7): 6536–6544.
[10] He HL, Guo CQ, Wang J, et al. Leutusome: a biomimetic nanoplatform integrating plasma membrane components of leukocytes and tumor cells for remarkably enhanced solid tumor homing. Nano Lett, 2018, 18(10): 6164–6174.
[11] Qu MK, Lin Q, Huang LY, et al. Dopamine-loaded blood exosomes targeted to brain for better treatment of Parkinson’s disease. J Control Release, 2018, 287: 156–166.
[12] Zhuang XY, Xiang XY, Grizzle W, et al. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain. Mol Ther, 2011, 19(10): 1769–1779.
[13] Tian YH, Li SP, Song J, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials, 2014, 35(7): 2383–2390.
[14] Pascucci L, Coccè V, Bonomi A, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibittumor growth: a new approach for drug delivery. J Control Release, 2014, 192: 262–270.
[15] Lamichhane TN, Raiker RS, Jay SM. Exogenous DNA loading into extracellular vesicles via electroporation is size-dependent and enables limited gene delivery. Mol Pharmaceutics, 2015, 12(10): 3650–3657.
[16] Yim N, Ryu SW, Choi K, et al. Exosome engineering for efficient intracellular delivery of soluble proteins using optically reversible protein-protein interaction module. Nat Commun, 2016, 7: 12277.
[17] Johnsen KB, Gudbergsson JM, Duroux M, et al. On the use of liposome controls in studies investigating the clinical potential of extracellular vesicle-based drug delivery systems-a commentary. J Control Release, 2018, 269: 10–14.
[18] Cho E, Nam GH, Hong Y, et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. J Control Release, 2018, 279: 326–335.
[19] Hung ME, Leonard JN. A platform for actively loading cargo RNA to elucidate limiting steps in EV-mediated delivery. J Extracell Vesicles, 2016, 5(1): 31027.
[20] Wang QY, Yu JJ, Kadungure T, et al. ARMMs as a versatile platform for intracellular delivery of macromolecules. Nat Commun, 2018, 9(1): 960.
[21] Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Ann Rev Cell Biol, 2014, 30: 255–289.
[22] Huang L, Gu N, Zhang XE, et al. Light-inducible exosome-based vehicle for endogenous RNA loading and delivery to leukemia cells. Adv Funct Mater, 2019, 29(9): 1807189.
[23] He L, Jing J, Zhu L, et al. Optical control of membrane tethering and interorganellar communication at nanoscales. Chem Sci, 2017, 8(8): 5275–5281.
[24] Zhang W, Lohman AW, Zhuravlova Y, et al. Optogenetic control with a photocleavable protein, PhoCl. Nat Methods, 2017, 14(4): 391–394.
[25] Lai CP, Kim EY, Badr CE, et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nat Commun, 2015, 6: 7029.
[26] Van Niel G, Charrin S, Simoes S, et al. The tetraspanin CD63 regulates ESCRT-independent and-dependent endosomal sorting during melanogenesis. Dev Cell, 2011, 21(4): 708–721.
[27] Li ZL, Zhou XY, Wei MY, et al. In vitro and in vivo RNA inhibition by CD9-HuR functionalized exosomes encapsulated with miRNA or CRISPR/dCas9. Nano Lett, 2019, 19(1): 19–28.
[28] Kojima R, Bojar D, Rizzi G, et al. Designer exosomes produced by implanted cells intracerebrally deliver therapeutic cargo for Parkinson’s disease treatment. Nat Commun, 2018, 9(1): 1305.
[29] Sutaria DS, Jiang JM, Elgamal OA, et al. Low active loading of cargo into engineered extracellular vesicles results in inefficient miRNA mimic delivery. J Extracell Vesicles, 2017, 6(1): 1333882.
Construction of engineered exosomes with high loading efficiency of cellular endogenous proteins
Lin Huang1,2*, Dianbing Wang2*, Ning Gu1, and Xian-en Zhang1,2,3
1 School of Biological Science and Medical Engineering, Southeast University, Nanjing 210096, Jiangsu, China 2 National Laboratory of Biomacromolecules, CAS center for Excellence in Biomacromolecules, Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China 3 University of Chinese Academy of Sciences, Beijing 100049, China
Exosomes have many advantages as natural drug delivery carriers, but their application is limited by the inefficient loading of intracellular drugs (such as proteins and nucleic acids). In this study, mCherry, a red fluorescent protein, was used as the endogenous cargo target. Through gene modification of donor cells and fusion expression of membrane localization elements (PB, CAAX, Palm and CD63), mCherry was specifically sorted into exosomes through biogenesis. Results show that CD63 had the highest sorting efficiency, followed by Palm. PB and CAAX led enrichment of mCherry on the plasma membrane, but not in exosomes. The approach provides an alternative to facilitate packaging of cargo by exosomes and thus to increase the efficient delivery of endogenous protein drugs.
exosome, drug delivery carrier, endogenous protein, membrane localization element, loading efficiency
April 6, 2019;
May 20, 2019
Supported by: the Major Program of National Natural Science Foundation of China (No. 21890743), the National Key Research and Development Program of China (No. 2017YFA0205503).
Xian-en Zhang. Tel: +86-10-64888148; E-mail: zhangxe@ibp.ac.cn
*These authors contributed equally to this study.
国家自然科学基金重大项目 (No. 21890743),国家重点研发项目 (No. 2017YFA0205503) 资助。
2019-06-18
http://kns.cnki.net/kcms/detail/11.1998.Q.20190617.1050.004.html

黄琳, 王殿冰, 顾宁, 等. 高效装载细胞内源蛋白工程化外泌体的构建. 生物工程学报, 2019, 35(8): 1537–1545.Huang L, Wang DB, Gu N, et al. Construction of engineered exosomes with high loading efficiency of cellular endogenous proteins. Chin J Biotech, 2019, 35(8): 1537–1545.
(本文责编 郝丽芳)
