保存期间血小板中外泌体浓度变化及其对凝血功能的影响
2022-09-21米紫玥孔玉洁徐海霞
龚 丽,米紫玥,孔玉洁,徐海霞,田 力,刘 忠
作者单位:1安徽医科大学公共卫生学院,合肥 2300322中国医学科学院/北京协和医学院输血研究所,成都 6100523中国医学科学院输血不良反应研究重点实验室,成都 610052
血小板在保存期间可发生储存损伤(platelet storage lesion,PSL)[1],分泌细胞外囊泡(extracellular vesicles,EVs)。EVs数量随血小板保存时间延长而增加[2]。EVs已被证明具有促凝和促炎活性[3],参与类风湿性关节炎和动脉粥样硬化等血栓并发症[4]。血小板EVs主要包括两类:外泌体、微囊泡[5]。外泌体、微囊泡均为双层膜结构,粒径大小分别为30 ~ 150 nm,100 ~ 1 000 nm[6]。外泌体携带有丰富的蛋白质等生物活性物质[7]。近年来,研究者们关注于外泌体在各种生理病理状态下生物活性物质的变化及可能的影响机制,而对于随着血小板保存时间延长,外泌体浓度变化及其对凝血功能的影响的研究较少,血小板保存期间产生的外泌体是否参与EVs的促凝作用有待研究。因此,该研究着重探讨手工血小板中外泌体浓度与保存时间的关系,并在此基础上探究其对凝血功能的影响。
1 材料与方法
1.1 材料手工血小板,来自四川省德阳市中心血站。
1.2 仪器与试剂超速离心机(Beckman Coulter,美国贝克曼库尔特公司);纳米流式分析仪(福流,成都智予医学检验有限公司);透射电子显微镜(FEI TecnaiTMG 2 Spirit,捷克FEI公司);化学发光凝胶成像系统(CLINX ChemiScope 3000 mini,上海勤翔科学仪器有限公司);全自动凝血分析仪(Sysmex CS-2000 i,成都协和生物技术有限责任公司);血栓弹力图仪(CFMS LEPU-8800,北京乐普医疗科技有限责任公司);化学发光成像分析仪(ImageQuantTMLAS 4000,美国通用电气医疗公司);单克隆兔抗人CD 9抗体、多克隆鼠抗人TSG 101抗体、钙联蛋白Calnexin抗体、羊抗兔IgG抗体、羊抗鼠IgG抗体(Abcam,英国);PT检测试剂盒、APTT检测试剂盒(Simens,德国);血栓弹力图检测试剂盒(乐普,北京);多克隆兔抗人F 7抗体、单克隆鼠抗人β-actin抗体(美国Proteintech公司);5% BSA封闭液(Solarbio,北京)。
1.3 方法
1.3.1样本采集 先后分别取10人份、5人份手工血小板(每人份约50 ml),分别置于血小板常温[(22±2)℃]震荡保存箱中保存0(采集当天)、3、5 d(D 0、D 3、D 5)后在无菌条件下从血小板样本中取15 ml。血小板样本以5 480 r/min离心10 min,去除大部分血小板。取上清液至离心管中,-80 ℃保存。
1.3.2外泌体提取 血小板上清液4 ℃解冻后经1 380 r/min离心10 min,再经3 580 r/min离心10 min后吸取上清液,7 750 r/min离心30 min,去除大细胞碎片及微囊泡。吸取上清液至超速离心管中,使用0.45 μm滤膜进行过滤以去除小细胞碎片及微囊泡。使用超速离心机4 ℃下40 000 r/min离心1 h 30 min,保留沉淀,再加入一定量无菌磷酸盐缓冲液(PBS),4 ℃下40 000 r/min离心1 h 30 min 进行洗涤[8]。用200 μl无菌PBS重悬沉淀,-80 ℃冻存。
1.3.3外泌体的鉴定
1.3.3.1Western blot外泌体免疫标志物的鉴定 经RIPA 裂解后,吸取外泌体蛋白质溶液于EP管中,加入上样缓冲液(Loading buffer),98 ℃ 5 min金属浴进行蛋白变性,4 ℃下12 000 r/min离心5 min。以10% SDS-PAGE电泳分离蛋白,使用湿式转膜装置进行蛋白质转膜;采用5%脱脂奶粉TBST封闭液对PVDF膜室温下封闭1 h;于封闭液稀释的一抗TSG 101(1 ∶1 000)、CD 9(1 ∶1 000)以及阴性对照蛋白标志物Calnexin(1:1 000)中4 ℃孵育过夜;1×TBST 充分洗膜后,于封闭液稀释的相应二抗(1 ∶5 000)中室温孵育1 h,1× TBST充分洗膜。加入化学发光工作液反应5 min,采用CLINX化学发光凝胶成像系统进行曝光、显影。同时以Hela细胞裂解液作为对照样品。
1.3.3.2透射电镜鉴定外泌体形态 吸取外泌体样本10 μl滴加于铜网上沉淀1 min,滤纸吸去残液。吸取10 μl磷钨酸滴加于铜网上沉淀1 min,滤纸吸去残液。常温下干燥几分钟。于100 KV下进行电镜检测成像。
1.3.3.3外泌体粒径大小的鉴定 吸取外泌体悬液于EP管中,按一定比例加入PBS进行稀释后,充分混匀。按照纳米流式仪器操作说明设置检测参数,进行测量分析。
1.3.4不同保存时间血小板中外泌体对凝血功能的影响
1.3.4.1外泌体对血浆凝血功能的影响 取10 ml全血于枸橼酸盐抗凝管中(全血与枸橼酸盐的比例为9 ∶1),室温下静置5 min,水平离心机中 4 000 r/min 离心15 min,取180 μl离心后上层血浆于若干EP管中,分别向其中加入20 μl D 0、D 5血小板外泌体样本。同时,向180 μl新鲜血浆中加入20 μl无菌PBS作为对照组。室温下孵育30 min后使用全自动凝血仪检测加入外泌体、PBS后血浆的血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)指标,以秒(s)为单位。共采集5份不同健康人新鲜全血,以避免个体差异影响。其中每2份外泌体样本使用同一份血浆。
1.3.4.2外泌体中凝血因子VII定量检测 使用含有1% PMSF蛋白酶抑制剂的RIPA裂解液分别对50 μl D 0、D 5外泌体进行蛋白裂解,加入Loading buffer,98 ℃金属浴5 min,4 ℃下12 000 r/min离心5 min。以10% SDS-PAGE电泳分离蛋白,湿式转膜装置进行蛋白质转膜;按照蛋白Maker条带说明书将PVDF膜剪开;使用5% BSA封闭液对PVDF膜室温下封闭1 h;于封闭液稀释的一抗F 7(1 ∶1 000)、β-actin(1 ∶10 000)中4 ℃孵育过夜;1×TBST充分洗膜后,于封闭液稀释的相应二抗(1 ∶10 000)中室温孵育1 h,经1×TBST充分洗膜后加入化学发光工作液反应5 min,采用ImageQuant化学发光成像分析仪进行显影。使用ImageJ软件对其进行半定量分析。
1.3.4.3外泌体对全血凝血功能的影响 静脉采集五份不同健康人新鲜全血至枸橼酸钠的抗凝管中,颠倒混匀。取50 μl PBS及D 0、D 5外泌体样本分别加至1 ml新鲜全血中,室温下孵育1 h。在血栓弹力图仪的通道上装载普通杯,取上述含有外泌体、PBS的全血1 ml至试剂1瓶中,颠倒使之充分混匀,室温下静置4 min以激活血液,取340 μl试剂1瓶中血液至盛有20 μl试剂2的普通杯中。按照操作说明书使用血栓弹力图仪进行各样本的凝血时间(blood clotting time,R)、凝血速率(clotting rate,α角)、血块形成时间(clot formation time,K)、血块强度(clot intensity,MA)、凝血综合指数(blood clotting index,CI)等指标的检测。

图1 血小板外泌体鉴定 ×10 000

2 结果
2.1 血小板外泌体的鉴定血小板中外泌体经Western blot法鉴定显示,特异性免疫学标志物TSG 101和CD 9在外泌体中出现富集,而非特异性免疫学标志物Calnexin蛋白则在外泌体中未检出(图1A)。透射电镜分析显示为双层膜结构、类杯状外形(图1B)。纳米流式粒径分析表明血小板中外泌体粒径分布集中于60~80 nm,符合外泌体颗粒大小(图1C)。
2.2 血小板外泌体浓度随保存时间的变化纳米流式结果显示(表1、图 2),保存D 0、D 3、D 5血小板中外泌体颗粒浓度不同,分别为(13.86±7.93)×1012、(23.69±12.80)×1012、(45.81±25.87)×1012个/L。外泌体浓度随保存时间延长而增加,且不同保存时间的外泌体浓度差异有统计学意义;D 3外泌体浓度为D 0的1.8倍(P<0.01),D 5外泌体的颗粒浓度为D 0的4.0倍,差异有统计学意义(P<0.01)。D 5外泌体浓度约为D 3的2.2倍(P<0.05)。
2.3 不同保存时间血小板中外泌体对凝血功能的影响
2.3.1血小板中外泌体对血浆凝血功能的影响 不同保存时间血小板外泌体对凝血功能的影响结果如表2所示。与对照组相比,D 0与D 5组外泌体分别可使PT减小,差异均有统计学意义(P<0.01、P<0.001);同时,与对照组相比,D 0与D 5组外泌体分别使APTT减小,差异均有统计学意义(P<0.05、P<0.001)。

表1 不同保存时间手工血小板外泌体浓度

图2 血小板中外泌体浓度随保存时间的变化
2.3.2血小板外泌体中凝血因子VII的定量检测 Western blot实验结果显示凝血因子VII在血小板保存0 d与5 d所分泌的外泌体中表达量存在差异。进一步通过半定量软件ImageJ检测各条带灰度值验证了该结果,相较于D 0,D 5组VII因子含量是D 0组的1.4倍,差异有统计学意义(P<0.05)(图3)。
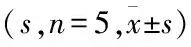
表2 不同保存时间血小板外泌体对PT、APTT的影响

表3 不同保存时间血小板外泌体的凝血作用

图3 血小板外泌体中凝血因子VII表达差异
2.3.3血小板中外泌体对全血凝血功能的影响 D 5与D 0血小板外泌体对新鲜全血凝血指标的影响见表3。凝血时间R值提示凝血因子活性,与PBS组、D 0组相比,D 5组外泌体使全血凝血时间降低,差异有统计学意义[(t=3.21,P<0.05)、(t=2.82,P<0.05)],表明外泌体样本具有促凝作用;与PBS组相比,D 0、D 5组外泌体可使K值减小,α角增大,CI指数升高,但差异无统计学意义。与PBS、D 0组相比,D5组外泌体样本可使血液中MA值变大,但差异无统计学意义。
3 讨论
已有相关文献[9]证明血小板制备与保存过程中高离心力、剧烈震荡、产生的激动剂(二磷酸腺苷、凝血酶)、低温(4 ℃)、碱性环境(pH >7.6)及酸性环境(pH<6.2)等因素都可使血小板发生活化,导致血小板EVs增加。微囊泡与外泌体作为血小板EVs两种主要组成成分,Gao et al[10]研究了常温震荡保存条件下单采血小板中微囊泡的变化,结果显示保存5 d时微囊泡含量是保存1 d时的3倍。而在本研究中则检测了常温震荡保存手工血小板时其外泌体随时间的变化,结果显示外泌体随着保存时间延长也呈增加趋势,与上述文献报道一致。
Sinauridze et al[11]研究显示血小板EVs促凝活性为活化血小板的50~100倍,其认为这不仅归因于促凝血磷脂的表面暴露,促凝血蛋白受体的密度增加也放大了促凝活性。研究[12]指出创伤导致的凝血障碍(trauma-induced coagulopathy,TIC)患者存活率降低时血小板EVs下降,Lopez et al[13]通过向出血大鼠模型输注血小板EVs证明其在体内发挥了促凝和改善酸中毒的作用。上述研究均未将微囊泡与外泌体分离,故无法明确二者作用大小。外泌体作为EVs重要组成部分,对其凝血功能的单独研究较少。在本研究中,通过比较保存D 0与D 5血小板中外泌体对血浆的凝血作用显示两组PT、APTT与对照组相比差异有统计学意义,血小板保存期间产生的外泌体可能通过内、外源性凝血途径发挥促凝作用。进一步检测两组血小板外泌体对全血凝血功能的影响,结果显示R值减小,提示凝血酶生成时间缩短,D 0与D 5外泌体中凝血因子活性存在差异。尽管两组的K值、α角、MA等数值上存在差异,但P值显示差异无统计学意义,可能是样本量不足的原因。尽管外泌体与微囊泡均含有血小板来源蛋白质、脂质、RNA等成分,但这些生物活性物质在外泌体与微囊泡上的表达并不一致。文献[14]已证明促凝物质PS在外泌体中不表达,外泌体可能存在与微囊泡相同的Va、Xa等各种凝血因子成分参与促凝作用。
本课题前期进行了不同保存时间血小板中外泌体蛋白谱学的研究,结果显示凝血因子VII在保存5天血小板外泌体中表达上调,因此对其进行定量检测以分析因子VII在促凝反应中的作用,结果显示因子VII在D 5组外泌体中含量是D 0组的1.4倍,因此可以推测血小板在保存过程中分泌的外泌体可富集因子VII发挥促凝作用。因子III与VIIa形成复合物后促进因子Xa形成,导致凝血酶生成。这些凝血酶可促进内源性凝血途径中凝血酶的生成。因子VII还可直接使因子IX裂解为IXa,从而进一步扩大内源性凝血途径的作用。因此,血小板保存过程中产生的外泌体发挥促凝作用,可能是由凝血因子VII参与内、外源性凝血途径介导的。此外,外泌体中富含的非编码RNA等生物活性物质可能也对其凝血作用产生调控作用。外泌体含量随着血小板保存时间的延长而增加,脂质在外泌体中不断积累[15],某些脂质成分也有可能导致其凝血作用增强。外泌体可能通过凝血因子、脂质、RNA等多种物质同时调节促凝作用,因此,对于血小板外泌体中调节促凝功能的某种或多种生物活性物质仍需进一步探究。
