风疹病毒结构蛋白多免疫显性区域诊断抗原的制备及其诊断效能评价
2019-08-27高健赵鼎
高健,赵鼎
风疹病毒结构蛋白多免疫显性区域诊断抗原的制备及其诊断效能评价
高健1,2,3,赵鼎1,2,3
1 郑州大学附属儿童医院检验科,河南 郑州 450000 2 郑州儿童医院检验科,河南 郑州 450000 3 河南省儿童医院检验科,河南 郑州 450000
对串联风疹病毒 (Rubella virus,RV) 3个结构蛋白6个免疫显性区域进行制备 (命名为B103),并将其应用于血清学诊断中。选取RV C aa 1–30 & aa 96–123、E2 aa 31–105和E1 aa 11–39 & aa 154–277 & aa 389–412等6个免疫显性区域,将其串联并基因合成;将此基因片段插入TRX和His标签之间构建表达质粒;蛋白B103在大肠杆菌BL21(DE3) 中诱导表达,并利用Streamline Chelating亲和层析和DEAE阴离子交换层析纯化目的蛋白,Sephadex G-25分子筛分析其折叠情况及均一性;利用免疫印迹技术对蛋白B103的抗原性进行鉴定,并建立RV-IgM抗体捕获法ELISA检测技术,初步评价此方法对阴阳血清样本的鉴别能力。蛋白B103以可溶性形式表达,其表达量约占菌体总蛋白的18.57%,经纯化后蛋白B103浓度为3.026 mg/mL,纯度为95.35%;免疫印迹实验表明蛋白B103能与RV急性期血清发生反应;对40份RV急性期血清及40份RV阴性血清进行检测发现可以很好地鉴别阴阳性血清标本;其灵敏度为92.50%,特异性为95.00%,阳性预测值为94.87%,阴性预测值为92.68%,符合率为93.75%,McNemer检验的结果提示与“金标准”诊断结果无差异,=0.900,提示两种方法诊断结果一致性优异。原核表达与层析纯化可以获取抗原性优异的RV血清学诊断抗原,可以应用于RV早期诊断中。
免疫显性区域,风疹病毒,原核表达,层析纯化,血清学诊断
风疹病毒 (Rubella virus,RV) 是风疹或者称为德国麻疹的病原体[1]。尽管大部分感染仅仅引起轻微的、自限型麻疹样疾病,但孕妇尤其是妊娠前3个月的感染将会引起严重的胎儿畸形甚至流产[2]。因此建立一种简单灵敏的RV检测方法具有重大的实际意义[3]。皮疹期RV-IgM在风疹患者中阳性率仅为50%,但皮疹后5 d此抗体在大部分患者中能被检测到[2],一般感染后10 d IgM首先被检测到,感染后4周达到峰值,急性感染后可持续超过7个月[4]。首次感染早期,IgG亲和力很低,3个月内才能逐渐成熟[4]。因此RV早期诊断血清学检测通主要依赖于RV-IgM指标[5]。
RV有3个结构蛋白,衣壳蛋白 (Capsid protein,C)、2种包膜蛋白 (Envelop protein,E) E2和E1。C富含精氨酸和脯氨酸残基,尤其在氨基末端,使其带正净电荷利于其在核衣壳形成过程中与基因组RNA发生反应[6-7]。E1和E2作为Ⅰ型膜蛋白,异二聚化后在病毒表面形成棘突复合体[8]。棘突复合体的主要功能为集合宿主细胞受体及介导病毒与宿主细胞膜融合[9]。E1拥有最主要的抗原决定簇,与血凝和中和表位相关[10]。针对E2和C蛋白的抗体也存在,但其表达水平和亲和力都很低[11]。研究发现,E1蛋白上免疫显性区域为aa 11–39、aa 154–179、aa 199–239、aa 226–277以及aa 389–412,衣壳蛋白为aa 1–30、aa 96–123,E2为aa 31–105[12]。有研究将不同表位进行串联表达,应用于RV-IgM检测发现诊断效能优异[13-14]。文中将RV的3个结构蛋白的免疫显性区域串联表达在一个蛋白上,并借此构建RV-IgM捕获法ELISA技术。
1 材料与方法
1.1 主要材料与试剂
DH5α、BL21(DE3)感受态细胞及TRX载体自备。Ⅰ和Ⅰ限制性内切酶以及T4 DNA连接酶购自美国NEB公司。Chelating Sepharose Fast Flow、DEAE Sepharose Fast Flow、Sephadex G-25 Fine层析介质购自美国GE公司。鼠抗人IgM二抗、鼠抗人IgM–HRP酶标物购自美国Thermo Fisher公司。商品化风疹病毒IgM诊断试剂盒为CFDA认证的诊断试剂盒。RV急性期阳性血清40份分别来自河南省儿童医院 (26份)、郑州大学附属儿童医院 (6份) 及郑州儿童医院(8份),阴性血清40份由郑州儿童医院提供,阴阳性血清样本都经过临床和实验室确诊,以风疹表现 (出现红色斑丘疹等) 及核酸检测阳性为金标准。3个月内接种风疹病毒疫苗妇女血清样本14份来自河南省儿童医院。
1.2 表达质粒B103的构建
根据参考文献[12,15-16],将RV C aa 1–30 & aa 96–123、E2 aa 31–105及E1 aa 11–39 & aa 154–277 & aa 389–412等6个免疫显性区域用GGGSGGGS连接臂进行串联,然后根据基因序列二级结构及其编码蛋白亲疏水特性优化基因并在5′端添加Ⅰ,3′端添加Ⅰ酶切位点,最后交由北京擎科新业生物技术有限公司合成 (将基因片段命名为B103F)。用Ⅰ和Ⅰ处理全基因合成产物将B103F双酶切下来,切胶回收后连接到相同酶切处理的TRX表达载体上,转化DH5α感受态细胞。次日挑取单克隆菌落培养后提取质粒进行测序和双酶切鉴定[17]。鉴定正确的质粒命名为B103质粒。
1.3 蛋白B103的制备
目的蛋白的表达与纯化参考苏秋东等发表的文献[17]。将转化B103质粒的BL21(DE3)接种于含氨苄霉素 (50 μg/mL) 的LB培养基(10 g/L 蛋白胨,5 g/L 酵母提取液,10 g/L NaCl) 中,进行小量 (1.5 mL) 和大量 (3 L) 表达。离心收集表达菌 (4 000 r/min,8 min,10 ℃)。小量表达菌体经处理后进行SDS-PAGE分析。大量表达菌体用缓冲液A (10 mmol/L Tris-HCl,0.5% Triton X-100,pH 8.0) 重悬后用超声仪破碎 (功率250 W,超声工作时间10 s,间歇时间20 s,共40个循环),离心 (12 000 r/min,8 min,10 ℃) 收集上清。将此上清补加终浓度为500 mmol/L的NaCl后上样于用缓冲液B平衡 (10 mmol/L Tris-HCl,500 mmol/L NaCl,pH 8.0) 的Chelating Sepharose Fast Flow层析介质中[17]。分别用60 mmol/L、300 mmol/L咪唑 (溶于缓冲液B中) 进行梯度洗脱。取300 mmol/L洗脱液于缓冲液C (10 mmol/L Tris-HCl,pH 8.0) 中进行透析去掉咪唑和NaCl成分。DEAE Sepharose Fast Flow层析介质用缓冲液C平衡后上样,分别用0、100、200、400 mmol/L NaCl (溶于缓冲液C中) 进行梯度洗脱并收集相应洗脱液。分别取样进行SDS-PAGE分析,观察目的蛋白的含量以及分布情况[17]。将SDS-PAGE分析评价优异的洗脱液于PBS (137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH 7.4)中透析,并于4 ℃保存备用。
取蛋白B103样品进行凝胶过滤层析分析蛋白的折叠情况及均一性。分子筛介质为Sephadex G-25 Fine,装柱体积为20 mL,缓冲体系为20 mmol/L 磷酸钠缓冲液,150 mmol/L NaCl,pH 7.0。实时监测Time-280数据并以此绘图。
1.4 蛋白B103的Western blotting分析
5 μL蛋白B103溶液进行SDS-PAGE (恒流40 mA,40 min),而后转膜至硝酸纤维素(NC) 膜上 (恒压15 V,30 min)。室温,用封闭液 (5%脱脂奶粉溶于PBST中[17]) 处理NC膜1 h。分别加入封闭液稀释的RV急性期阳性血清 (1∶20)、RV阴性血清 (1∶20),室温孵育1 h后用PBST洗膜5次。一抗都为鼠抗人IgM-HRP酶标物 (1∶3 000),室温孵育1 h后洗膜,最后1次用PBS洗膜后DAB显色,清水终止显色。
1.5 蛋白B103-HRP酶标物的制备及其诊断效能评价
B103与HRP的偶联参考HRP conjugation Kit说明书 (Abcam,UK)。简言之,每10 μL蛋白B103中加入1 μL Modifier reagent后与HRP Mix充分混匀 (B103∶HRP=1∶1)。室温避光静置3 h后,每10 μL蛋白B103加入1 μL Quencher reagent并充分混匀后加入等倍体积预冷甘油于−20 ℃保存备用。
利用蛋白B103-HRP酶标物建立血清RV-IgM抗体捕获法ELISA检测试剂盒,并对“金标准”确诊的血清样本以及风疹疫苗接种妇女血清样本进行检测,评价试剂盒对阴阳性血清标本的鉴别能力[17]。简言之,碳酸盐缓冲液稀释鼠抗人IgM二抗至终浓度25 ng/mL,100 μL/孔加入板条孔后37 ℃水浴孵育1 h,而后用封闭液37 ℃再孵育1 h,最后用PBST洗板5次,冷藏备用;室温平衡板条后加待测血清 (1∶10),37 ℃孵育1 h后洗涤;加入B103-HRP酶标物 (1∶5 000),37 ℃孵育1 h后洗涤;加A/B液显色,用酶标仪测定吸光度值 (450值)。
利用商品化RV-IgM检测试剂盒同样检测这些血清样本,具体操作步骤参见厂家说明书,最后用酶标仪测定吸光度值 (450值)。
1.6 统计学分析
运用GraphPad Prism 7.00软件绘制2组血清IgM抗体水平散点图并对两组血清450值均数进行检验。根据经验选取阴性血清450值均值2.1倍作为临界值,并以此计算新型检测试剂盒的灵敏度和特异性。两个样本均数比较应用独立样本的检验;多个样本两两比较,先应用方差分析 (ANOVA),再应用Dunnett’s检验。用McNemer检验及一致性检验评价两种检测方法的一致性。实验数据采用SPSS22.0软件进行统计学分析,<0.05表示差异有统计学意义。
2 结果与分析
2.1 原核表达层析纯化可获取高度均质的蛋白B103
B103的构建如图1所示,融合蛋白的氨基端为TRX标签,紧跟着依次为C aa 1–30 & aa 96–123、E2 aa 31–105及E1 aa 11–39 & aa 154–277 & aa 389–412等6个免疫显性区域,羧基端为His标签,连接臂为GGGSGGGS,以及合适的酶切位点 (如Ⅰ、Ⅰ和Ⅰ等)。B103F基因片段大小约800 bp,构建好的表达质粒经测序、双酶切鉴定及小量表达证实构建成功,命名为B103质粒。
小量表达SDS-PAGE结果发现,目的蛋白分子量与预期相同,约为44 kDa (图2A),表明B103蛋白可以在大肠杆菌中有效表达。蛋白B103可溶性表达,占菌体总蛋白的18.57% (图2B)。经亲和层析纯化后蛋白B103主要存在于300 mmol/L咪唑洗脱液中 (图2B),纯度为92.76%,浓度为3.286 mg/mL。经过阴离子交换层析后,蛋白B103主要分布于200 mmol/L NaCl洗脱液中,纯度为95.35%,浓度为3.026 mg/mL (图2B)。

图1 B103表达质粒示意图

图2 蛋白B103小量表达 (A)、大量表达及纯化结果(B)
经过凝胶过滤层析发现 (图3),纯化后的蛋白B103存在于单一洗脱峰中,峰尖而且分布优异表明其成分均一性优异,折叠成熟,可以作为检测抗原应用于ELISA检测中。
2.2 蛋白B103可以与RV急性期血清发生特异性反应
利用免疫印迹技术,初步鉴定蛋白B103的抗原性。结果显示,RV急性期血清作为一抗,鼠抗人IgM-HRP酶标物作为二抗,在蛋白分子量约44 kDa处有明显条带 (图4A);而RV阴性血清作为一抗,在NC膜上相应位置没有出现条带。并且无论是用RV相关阳性血清还是阴性血清,无蛋白B103表达菌都未见明显条带 (图4B),表明蛋白B103可以与RV阳性血清发生特异性反应。

图3 蛋白B103凝胶过滤分析
2.3 基于蛋白B103的捕获法ELISA技术可以很好地鉴别RV阴阳性血清标本
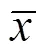

图4 蛋白B103的Western blotting分析

图5 蛋白B103在RV感染血清学诊断效果评价
商品化试剂盒检测血清结果发现,阳性结果34份 (34/40),阴性结果37份 (37/40),根据金标准计算出灵敏度为85.00%,特异性为92.50%,阳性预测值为91.89%,阴性预测值为88.10%,符合率为88.75%。与新型试剂盒进行比较见表1,进行卡方检验发现,0.799,高度一致性,说明新型试剂盒与此商品化试剂盒之间的差异不存在统计学意义,但相比于“金标准”,究其上述指标,新型试剂盒的诊断性能要更好。

表1 新型试剂盒与商品化试剂盒比较
3 讨论
仅依靠临床症状诊断风疹疾病是不可靠的,因为多数患者症状轻微,甚至多达50%的感染是亚临床的[2]。因此需要必要的实验室检测作为辅助。RV-IgG抗体可以持续存在于患者体内,而IgM一般在感染后2个月逐渐消失,因此检测IgM意义更大[18]。RV-IgM抗体检测是公认的风疹实验室检测方法[11]。目前监测RV抗体的诊断抗原大多为细胞培养抗原,其制备过程繁琐耗时耗力耗资,且抗原成分不均一,试剂盒的灵敏度和特异性不理想,给临床诊断带来干扰[19]。文中获取抗原性优异的诊断抗原来构建捕获法ELISA检测血清RV-IgM抗体水平。
大部分RV抗原决定簇 (包括主要的抗原决定簇) 都定位在E1蛋白[10],文中选取E1蛋白的3个免疫显性表位aa 11–39、aa 154–277和aa 389–412,涵盖了文献所验证的中和抗体表位[17,20]。E2的抗原位点由于与E1相互作用而被遮盖,但有证据显示E2包含独立特异性抗原[21],且中和抗体在体外也能中和病毒感染[22]。文中选取了E2蛋白的1个免疫显性区域aa 31–105。C蛋白是病毒中含量最高的病毒抗原[23],文中选取了C蛋白的2个免疫显性区域aa 1–30 & aa 96–123。融合蛋白的氨基端还添加了TRX前导肽,一是为了增加目的蛋白的表达,二是为了蛋白的折叠[24]。实验证实,蛋白B103以可溶性形式表达,且含量占菌体总蛋白的18.57% (图2B)。羧基端His-tag的存在,使之可以利用亲和层析有效纯化[25],进一步离子层析后,得到了浓度高纯度高 (图2B) 且构象高度均一 (图3) 的目的蛋白。
相对于单一抗原在抗体识别上的差异和局限,重组多表位抗原在对抗原成分选择上具有灵活广泛性[8]。每个表位之间加入了连接臂GGGSGGGS,使表位之间可以灵活转动,方便表位的展示及与抗体结合,大大提高了目的蛋白的抗原性[26]。Western blotting (图4) 及ELISA分析 (图5) 发现,蛋白B103抗原性优异,可以在体外与相应抗体发生反应。多个表位的存在同时增加了识别抗体的数量,大大提高了检测的灵敏度。
文中是对RV-IgM诊断抗原的初步研究,还存在着很多的不足:一是样本量偏小,由于笔者所在医院主要针对儿童人群,儿童人群中RV-IgM阳性率极低 (约占1.9%[27]),且主要分布于9月龄和10月龄婴儿 (共约占61.7%[27]),因此阳性血清样本的收集难度大,后续实验将加大检测样本量;二是风疹IgM诊断常见的假阳性来自Rh因子,由于文中假阳性样本量太小,后续实验将查明此试剂盒对Rh因子阳性血清的检测结果;三是针对疫苗接种后IgM的动力学分析的研究意义重大,但具体操作繁琐困难,也将在后续实验中实施;四是还未使用中国食品药品检定研究院提供的系列风疹血清作为监测,后续实验将引进系列血清盘,并制备相应的血清参考品。
蛋白B103集合了RV主要的免疫显性区域,经过原核表达和层析纯化后以可溶性形式存在,以此构建的RV-IgM捕获法ELISA可以很好地鉴别RV急性期阴阳性血清,为RV感染的早期诊断治疗以及防控工作提供有效的血清学依据。
[1] Sakata M, Mori Y. The life cycle of Rubella virus. Uirusu, 2014, 64(2): 137–146.
[2] Lambert N, Strebel P, Orenstein W, et al. Rubella. Lancet, 2015, 385(9984): 2297–2307.
[3] Chagnon A, Gilker JC, Roy L, et al. Diagnosis of rubella virus infections. Intervirology, 1974, 3(5/6): 359–368.
[4] Thomas HIJ, Morgan-Capner P, Enders G, et al. Persistence of specific IgM and low avidity specific IgG1 following primary rubella. J Virol Methods, 1992, 39(1/2): 149–155.
[5] Zhang T, Tian F, Long L, et al. Diagnosis of rubella virus using antigen-conjugated Au@Pt nanorods as nanozyme probe. Int J Nanomed, 2018, 13: 4795–4805.
[6] Mangala Prasad V, Willows SD, Fokine A, et al. Rubella virus capsid protein structure and its role in virus assembly and infection. Proc Natl Acad Sci USA, 2013, 110(50): 20105–20110.
[7] Liebhaber H, Gross PA. The structural proteins of rubella virus. Virology, 1972, 47(3): 684–693.
[8] Baron MD, Forsell K. Oligomerisation of the structural proteins of rubella virus. Virology, 1991, 185(2): 811–819.
[9] Duncan R, Muller J, Lee N, et al. Rubella virus-induced apoptosis varies among cell lines and is modulated by Bcl-XLand caspase inhibitors. Virology, 1999, 255(1): 117–128.
[10] DuBois RM, Vaney MC, Tortorici MA, et al. Functional and evolutionary insight from the crystal structure of rubella virus protein E1. Nature, 2013, 493(7433): 552–556.
[11] Wandinger KP, Saschenbrecker S, Steinhagen K, et al. Diagnosis of recent primary rubella virus infections: significance of glycoprotein-based IgM serology, IgG avidity and immunoblot analysis. J Virol Methods, 2011, 174(1/2): 85–93.
[12] Mitchell LA, Décarie D, Tingle AJ, et al. Identification of immunoreactive regions of rubella virus E1 and E2 envelope proteins by using synthetic peptides. Virus Res, 1993, 29(1): 33–57.
[13] Miao WH, Qu LL, Pang L, et al. Construction, expression, purification and evaluation of diagnostic effects of rubella virus compound epitope peptide. Chin J Clin Lab Sci, 2015, 33(12): 889–891, 894 (in Chinese). 缪卫华, 渠利利, 庞露, 等. 风疹病毒复合多表位肽的构建、表达、纯化及其诊断效能的初步评价. 临床检验杂志, 2015, 33(12): 889–891, 894.
[14] Sun WG, Yang LK, Liu YH, et al. Research on the soluble fusion expression and serological diagnosis of rubella virus glycoprotein 2-nuclear protein dominant antigen epitope pronucleus. Chin J Health Lab Technol, 2016, 26(16): 2351–2354 (in Chinese). 孙卫国, 杨栗坤, 刘艳华, 等. 风疹病毒糖蛋白2-核蛋白优势抗原表位原核可溶性融合表达与血清学诊断研究. 中国卫生检验杂志, 2016, 26(16): 2351–2354.
[15] Chaye H, Ou DW, Chong P, et al. Human T- and B-cell epitopes of E1 glycoprotein of rubella virus. J Clin Immunol, 1993, 13(2): 93–100.
[16] McCarthy M, Lovett A, Kerman RH, et al. Immunodominant T-cell epitopes of rubella virus structural proteins defined by synthetic peptides. J Virol, 1993, 67(2): 673–681.
[17] Su QD, Guo MZ, Qiu F, et al. The preparation of epitope-based recombinant Rubella virus diagnostic antigen. Chin J Virol, 2016, 32(3): 249–255 (in Chinese).苏秋东, 郭敏卓, 邱丰, 等. 风疹病毒多表位诊断抗原的制备与评价. 病毒学报, 2016, 32(3): 249–255.
[18] Petrova EK, Dmitrieva AA, Trifonova EA, et al. The key role of rubella virus glycoproteins in the formation of immune response, and perspectives on their use in the development of new recombinant vaccines. Vaccine, 2016, 34(8): 1006–1011.
[19] Li ZM, Chu FL, Wen HL, et al. R237 and H238 are key amino acids in the rubella virus E1 neutralization epitope. Viral Immunol, 2014, 27(9): 422–429.
[20] Newcombe J, Starkey W, Al-Mumin S, et al. Recombinant rubella E1 fusion proteins for antibody screening and diagnosis. Clin Diagn Virol, 1994, 2(3): 149–163.
[21] Ou D, Chong P, Choi Y, et al. Identification of T-cell epitopes on E2 protein of rubella virus, as recognized by human T-cell lines and clones. J Virol, 1992, 66(11): 6788–6793.
[22] Green KY, Dorsett PH. Rubella virus antigens: localization of epitopes involved in hemagglutination and neutralization by using monoclonal antibodies. J Virol, 1986, 57(3): 893–898.
[23] Karounos DG, Wolinsky JS, Thomas JW. Monoclonal antibody to rubella virus capsid protein recognizes a β-cell antigen. J Immunol, 1993, 150(7): 3080–3085.
[24] Holmgren A. Thioredoxins//Roberts GCK, Ed. Encyclopedia of Biophysics. Berlin, Heidelberg: Springer, 2013: 2613–2615.
[25] Spriestersbach A, Kubicek J, Schäfer F, et al. Purification of his-tagged proteins. Methods Enzymol, 2015, 559: 1–15.
[26] Baldo BA. Safety of Biologics Therapy: Monoclonal Antibodies, Cytokines, Fusion Proteins, Hormones, Enzymes, Coagulation Proteins, Vaccines, Botulinum Toxins. Switzerland: Springer, 2016: 263–307.
[27] Zhao ZR, Tao ZL, Wang CX. Analysis of the detection results of rubella virus IgM in 4 860 children. Chin J Health Lab Technol, 2017, 27(18): 2708–2710 (in Chinese). 赵宗瑞, 陶占领, 王春霞. 4860例儿童风疹病毒IgM抗体检测结果分析. 中国卫生检验杂志, 2017, 27(18): 2708–2710.
Design of a chimeric antigen containing multiple immunodominant epitopes and its use in detection of IgM antibodies against Rubella virus
Jian Gao1,2,3, and Ding Zhao1,2,3
1 Department of Laboratory Medicine, Children’s Hospital Affiliated of Zhengzhou University,Zhengzhou 450000, Henan,China 2 Department of Laboratory Medicine, Zhengzhou Children’s Hospital,Zhengzhou 450000, Henan,China 3 Department of Laboratory Medicine Henan Children’s Hospital,Zhengzhou 450000, Henan,China
A chimeric antigen designated B103 containing six immunodominant regions derived from three structural proteins of Rubella virus (RV) was designed and its utility in serological diagnosis was assessed. Protein B103 is comprised of aa 1–30 & aa 96–123 of C protein, aa 31–105 of E2 protein, as well as aa 11–39, aa 154–277 & aa 389–412 of E1 protein. In addition, it contains thioredoxin (TRX) at the N-terminal and His tag at the C-terminal. B103 was expressed inBL21(DE3) and purified by Streamline Chelating affinity and DEAE anion exchange chromatography. Based on the antigenicity of B103 as verified by Western blotting analysis, we constructed and evaluated a novel capture ELISA for RV-IgM detection. B103 was expressed in a soluble form, accounting for 18.57% of the total bacterial proteins. After purification, the concentration and purity of protein B103 were 3.026 mg/mL and 95.35%, respectively. Western blotting analysis demonstrated that protein B103 could react with acute-phase serum of RV. By ELISA, 40 negative sera and 40 RV-acute phase sera were detected. The sensitivity, specificity, positive predictive value, negative predictive value and coincidence rate of the ELISA were 92.50%, 95.00%, 94.87%, 92.68% and 93.75%, respectively. The McNemer analysis suggested that there was no statistical difference between the ‘Gold standard’ and the novel ELISA with acoefficient of 0.900, indicating excellent consistency. B103 chimeric protein with excellent antigenicity obtained from prokaryotic expression followed by chromatography purification could prove useful for early diagnosis of RV infection.
immunodominant region, Rubella virus, prokaryotic expression, chromatography purification, serological diagnosis
January 15, 2019;
March 13, 2019
Ding Zhao. Tel/Fax: +86-371-85515776; E-mail: zhaoding_henan@126.com
2019-03-20
http://kns.cnki.net/kcms/detail/11.1998.Q.20190319.1146.001.html

高健, 赵鼎. 风疹病毒结构蛋白多免疫显性区域诊断抗原的制备及其诊断效能评价. 生物工程学报, 2019, 35(8): 1529–1536.Gao J, Zhao D. Design of a chimeric antigen containing multiple immunodominant epitopes and its use in detection of IgM antibodies against Rubella virus. Chin J Biotech, 2019, 35(8): 1529–1536.
(本文责编 陈宏宇)
