HSD3B1在前列腺癌治疗中的研究进展
2019-08-26陈振杰黄应龙丁明霞
陈振杰 黄应龙 丁明霞
昆明医科大学第二附属医院泌尿外科,云南省泌尿外科研究所(昆明 650101)
前列腺癌(prostate cancer,PCa)是导致全球男性死亡的主要恶性肿瘤之一。据估计,2018年全美新增近164 690例PCa,而全世界有近130万新发PCa病例和359 000例相关死亡病例,占全球男性患者恶性肿瘤发病率的第2位,也是男性癌症死亡的第五大原因[1-2]。在我国,随着人口老龄化的加剧,PCa发病率也逐年上升,现已高居我国男性恶性肿瘤第6位[3]。
PCa的发生、发展高度依赖于雄激素受体(AR)信号传导的激活物——睾酮(T)及双氢睾酮(DHT)[4]。因此,长期以来对进展性前列腺癌的标准治疗方法是通过药物或手术去势的方式进行雄激素剥夺治疗(androgen deprivation therapy,ADT)[5]。然而,患者在接受18 ~ 24个月的ADT后,几乎不可避免地发展为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC),尽管已有一些药物可用于CRPC的治疗,但CRPC仍然无法治愈,预计存活期为2~3年[6-7]。了解PCa从激素敏感到去势抵抗的进展机制是开发新型治疗策略的关键。而目前最为公众所认可的是多因素引起的雄激素受体(AR)重激活机制,其中就包括肿瘤内雄激素的合成[8]。有证据表明,即使在系统性ADT期间PCa细胞也能够通过从胆固醇从头合成或从肾上腺雄激素脱氢表雄酮(DHEA)转化获得产生T和DHT的能力。而在肾上腺雄激素向T和DHT转化过程中HSD3B1基因起着至关重要的作用,且有研究表明,HSD3B1在CRPC进展期间被显著上调[7,9]。此外,早在 2008 年ROSS 等[10]就通过临床研究证明了HSD3B1基因的多态性与晚期前列腺癌患者ADT期间的进展时间显著相关。而在“The Lancet.Oncology”中,HEARN等[11]也通过一项多队列的回顾性临床研究揭示了HSD3B1基因的种系遗传多态性N367T(AAC > ACC,rs1047303)与ADT抵抗性之间的密切关系。总而言之,大量的研究证明HSD3B1与PCa的进展及治疗有着密切关系,本文就HSD3B1在PCa中的作用及最新研究进展进行综述。
1 HSD3B1基因
1.1 HSD3B基因的分类及功能人类共有两个HSD3B家族基因,即HSD3B1和HSD3B2,均位于1号染色体上,分别编码3β-羟基类固醇脱氢酶-1(3β-HSD1)和3β-羟基类固醇脱氢酶-2(3β-HSD2)两种同工酶。HSD3B1主要在外周组织中表达,如前列腺、胎盘、皮肤和乳腺。其表达的3β-HSD1的作用是将循环中前体类固醇转化为外周组织中的下游类固醇,包括T、DHT和雌激素。而HSD3B2编码的3β-HSD2几乎仅在肾上腺、卵巢和睾丸中被发现,其生理作用主要与生成皮质醇、醛固酮以及雌性和雄性激素所需的类固醇前体的合成有关[12-13]。因此,HSD3B2基因与PCa密切相关,而且最新研究表明HSD3B2的表达上调与PCa的早期生化复发有关[14]。此外,据报道,HSD3B2的突变可导致3β-HSD2缺陷,即使在HSD3B1基因正常表达的情况下,也可引起突变的个体发生先天性肾上腺增生[15-16],这表明两种同工酶的表达具有组织特异性,并且各自受到严格的调控。
1.2 HSD3B1基因的调控迄今为止,HSD3B1在前列腺组织中的转录调节尚未完全阐明。早年有学者研究发现白细胞介素-4和白细胞介素-13可以上调几种外周组织中的HSD3B1,包括正常前列腺上皮、永生化角质形成细胞、宫颈癌细胞、结肠癌细胞、正常乳腺上皮细胞和乳腺癌细胞。然而,未发现这些细胞因子在前列腺癌细胞系(LNCaP或PC3)或绒毛膜癌(JAR和JEG-3)细胞系中诱导HSD3B1表达[17-18]。
近年来针对高表达HSD3B1胎盘组织中HSD3B1调节的多项研究表明,锌指GATA家族的转录因子,特别是GATA2,能够起到调节HSD3B1表达的作用[19-20]。而HETTEL 等[21]的研究结果则表明,GATA2可与人前列腺癌细胞(LNCaP)中的HSD3B1启动子结合,这说明前列腺癌组织也能够通过GATA2来调节HSD3B1。此前,ZHAO等[22]在其研究中则指出,GATA2是通过增强AR与周围雄激素调控元件(ARE)的结合而充当AR的辅助因子。
此外,HETTEL等[21]在研究中还发现,通过阉割VCaP异种移植肿瘤的小鼠可抑制HSD3B1的表达,进而明确了HSD3B1是受雄激素调节的基因。而且在多个CRPC模型中的研究发现,通过人工合成的雄激素(R1881)刺激AR也可诱导HSD3B1转录上调,导致3βHSD1蛋白水平增加,并且这种作用可以被恩杂鲁胺(AR拮抗剂)消除。而与此相一致的是,一份针对转移性CRPC患者的阿比特龙(肾上腺雄激素合成抑制剂)与恩扎鲁胺治疗的随机Ⅱ期临床试验结果显示,与阿比龙相比,恩杂鲁胺可显著降低患者血清 PSA[23]。HETTEL 等[21]认为这可能与直接阻断AR的此种潜在作用有关。
1.3 HSD3B1基因的突变及影响CHANG等[24]在前列腺癌细胞系模型中首次发现具有潜在临床意义的HSD3B1(1245A>C)突变体的存在,而且HSD3B1(1245A>C)可以由纯野生型等位基因患者在CRPC的肿瘤中发生体细胞突变而获得。尽管HSD3B1(1245C)等位基因可通过突变获得,但它也能通过单核苷酸多态性(SNP;rs1047303)的形式遗传。据报道,在一般人群中发现HSD3B1种系变异等位基因频率约为30%,而在所有患晚期前列腺癌的患者中约有10%是纯合变体[11,25]。另有报道称,HSD3B1中的N367T(A > C,rs1047303)多态性在白种人人群中出现频率最高(31%),在非裔美国人中次之(11.7%),在亚洲男性中最低(8.5%)[26]。而HSD3B1中的种系变异体HSD3B1(1245A>C)是由于HSD3B1的1245位点的A转化为C,致使最终编码的3βHSD1氨基酸367位点处的天冬酰胺(N)被苏氨酸(T)所替换,使3βHSD1对多泛素化和随后的蛋白酶体降解具有抗性,这显着增加了3βHSD1的半衰期,进而导致性腺外前体类固醇向DHT的合成增加[24]。
2 HSD3B1与雄激素分泌的关系
成年男性体内雄激素主要来源于睾丸(95%)和肾上腺(5%),HSD3B1主要与肾上腺来源的雄激素合成有关[6]。在人体内经典的雄激素合成途径为:首先胆固醇在细胞色素P450 11A1(CYP11A1)的作用下转化为孕烯醇酮;随后通过3β-羟基类固醇脱氢酶(3β-HSD)将孕烯醇酮转化为孕酮。而CYP17A1再将孕烯醇酮和黄体酮分别转化为脱氢表雄酮(DHEA)和雄烯二酮(AED);此外,DHEA也可通过3β-HSD转化为雄烯二酮。雄烯二酮通过17β-羟基类固醇脱氢酶3(HSD17B3)或醛酮还原酶1C3(AKR1C3)转化为睾酮,随后通过类固醇 5-α-还原酶(SRD5A1)转化为 DHT。DHEA也可以通过HSD17B3或AKR1C3转化为雄烯二醇,然后再通过3β-HSD转化为睾酮[27-29]。而在PCa中,前体类固醇向DHT的转化可通过经典途径、5α-二酮途径以及后门途径发生。由于胆固醇和3β-HSD1的底物孕烯醇酮、17α-羟基孕烯醇酮、脱氢表雄酮和雄烯二醇均具有3β-羟基和Δ5结构,必须转化为3-酮基和Δ4结构,才能进一步转化为睾酮和DHT。因此,所有3种途径均取决于3β-羟基3-酮基转化活性和3β-HSD1的Δ5→Δ4异构化活性(图1)[30]。
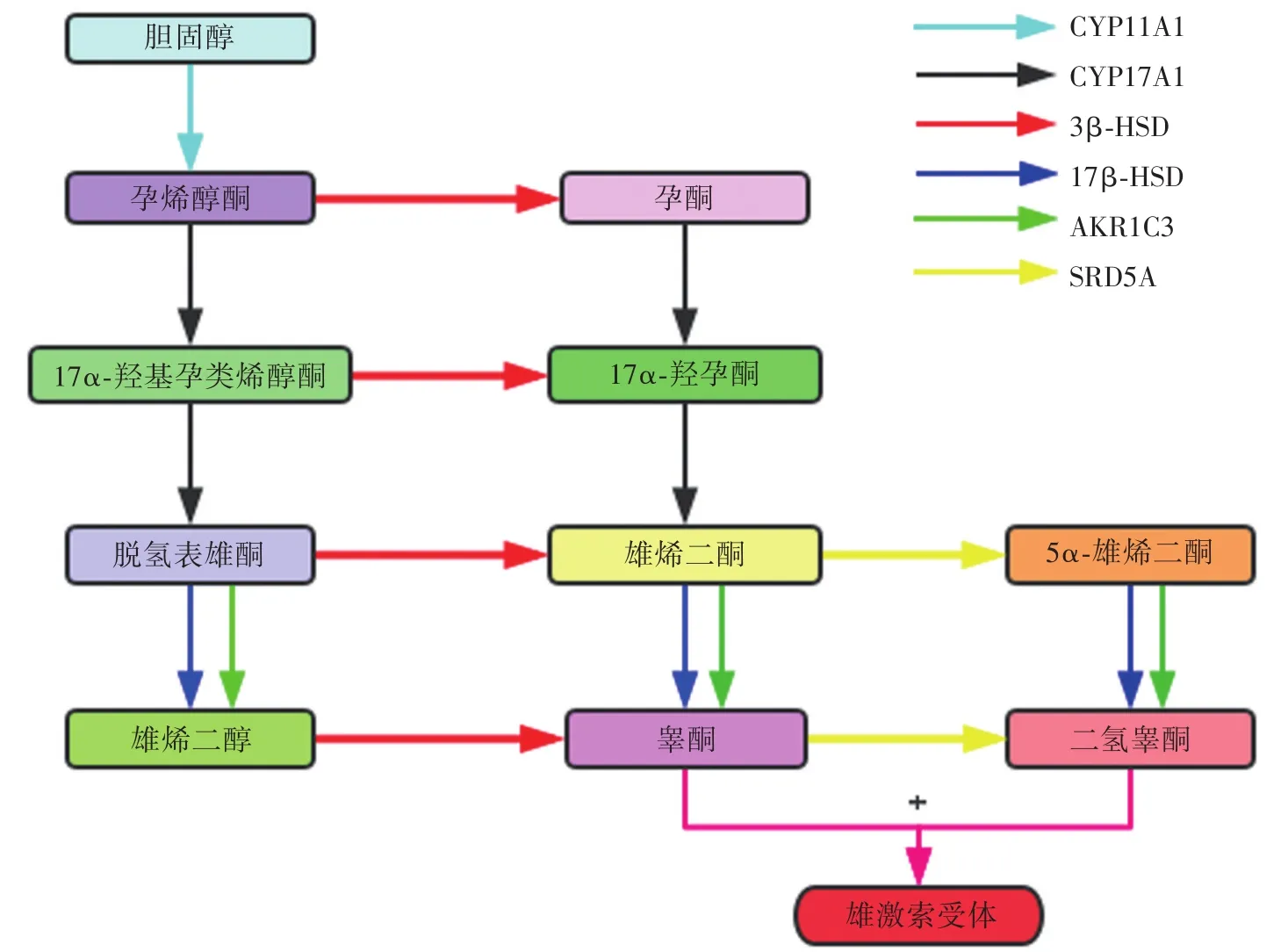
图1 雄激素合成简图Fig.1 Diagram of androgen synthesis
3 HSD3B1基因的突变对ADT的影响
睾丸最初是PCa所依赖的雄激素(主要是睾酮)的主要来源,故临床上一线内分泌治疗通常是通过雄激素剥夺疗法(ADT)抑制性腺睾酮的合成来达到治疗进展性前列腺癌的目的。但通过ADT抑制性腺睾酮合成的同时,肿瘤的生长仍可受到性腺外雄激素合成的调节,其主要由肾上腺前体类固醇来维持。这在MOSTAGHE等[31]最近的研究中也得到证实。而当HSD3B1基因1245位点发生突变时,由于其显著增加了3βHSD1的半衰期,引起肾上腺前体类固醇向DHT的合成进一步增加,使得具有HSD3B1变异等位基因的患者更快地向CRPC发展[24]。
HEARN等[11]通过3个独立队列研究发现,不同基因型的PCa患者从接受ADT到进展为CRPC的无进展生存期存在显著差异,纯合野生基因型、杂合基因型和纯合变异基因型患者的中位无进展生存期分别为6.6、4.1和2.5年。由此可见,PCa患者无进展生存期与HSD3B1基因型显着相关,而且与遗传的HSD3B1(1245A>C)变异等位基因数量负相关。此外,HEARN等[32]在他们的研究中发现等位基因1245C的遗传与局限性前列腺癌患者放疗后早期生化复发的趋势有关。而WU等[33]通过临床病例研究HSD3B1基因突变对CRPC的影响发现,HSD3B1基因突变可明显增加CRPC的转化率,但并不会影响患者的生存时间和增加患者的死亡率,这与HEARN等的研究结果基本一致。综上,继发HSD3B1变异的晚期前列腺癌患者在接受ADT 治疗时的预后更差[11,25,32-33]。因此,HSD3B1(1245 A>C)变异等位基因的遗传是对去势敏感性前列腺癌患者ADT反应差的预测生物标志物,这在ALMASSI等[34]的研究中也得到证实。
4 HSD3B1对CYP17A1抑制剂阿比特龙的影响
4.1 基于CRPC发生机制所提出的新型治疗方法近年来,针对转移性去势敏感性前列腺癌(mCSPC)的治疗,许多文献报道提出了新方案,如建议在ADT时加入雄激素受体拮抗剂或CYP17A1抑制剂等。其中阿比特龙是一种有效的甾体类CYP17A1抑制剂,可减少性腺外雄激素合成,当与泼尼松联合使用时,可有效延长CRPC患者的存活时间[35-36]。而当醋酸阿比特龙(AA)加泼尼松与ADT一起预先给药用于治疗mCSPC时,其具有更大的生存获益[37-40]。因此,ADT联合醋酸阿比特龙和泼尼松治疗有望成为转移性去势抵抗性前列腺癌患者治疗新标准[41-46]。
4.2 HSD3B1与CYP17A1抑制剂阿比特龙的体内代谢CYP17A1抑制剂阿比特龙具有与DHEA和其他3βHSD催化底物相同的3β-羟基和Δ5-类固醇结构,因此阿比特龙可被3βHSD催化代谢。阿比特龙通过3β-HSD代谢为Δ4-阿比特龙(D4A),其保留了作为CYP17A1抑制剂的特性,并获得了作为AR拮抗剂和有效雄激素生物合成所需的其他酶抑制剂的能力[47]。但是,D4A随后可被类固醇-5α-还原酶代谢为3-酮-5α-阿比特龙(图2),而3-酮-5α-阿比特龙被证明是在异种移植物模型中促进肿瘤进展的雄激素受体(AR)激动剂,并且其在血中的含量比Δ4-阿比特龙更高[48-49]。

图2 阿比特龙的体内代谢路径简图Fig.2 Pathways of abiraterone metabolism
4.3 HSD3B1变异体对CYPI7A1抑制剂(阿比特龙)代谢的影响ALYAMANI等[50]在30例转移性CRPC患者的转化研究中发现HSD3B1(1245C)变异与3-酮-5α-阿比特龙的增加相关,即3-酮-5α-阿比特龙随着HSD3B1(1245C)变体等位基因遗传数量的增加而增加,而且在纯合子变体的患者中观察到3-酮-5α-阿比特龙的水平最高。其可能的机制是在具有HSD3B1(1245 A>C)变体的患者中,由于3βHSD1对降解具有抗性,使得体内3βHSD1含量增加,进而加速了阿比特龙的代谢,导致3-酮-5α-Abi的水平更高[51]。值得注意的是,在该研究中,HSD3B1(1245A>C)变异者的D4A并没有增加,这可能是由于尽管HSD3B1(1245C)变体遗传引起了D4A的生成增加,但由于D4A被5α-还原酶快速还原为3种下游代谢物(3-酮-5α-Abi,3α-OH-5α-Abi和 3β-OH-5α-Abi)(图2),因此其并未积累[50]。虽然 3-酮-5α-阿比特龙是低效的AR激动剂,其作用也弱于DHT,但其在性腺和性腺外雄激素剥夺治疗后几乎完全不存在内源性雄激素的情况下仍然是有害的。由此,笔者认为,对于携有HSD3B1(1245C)变异基因的CRPC患者在行阿比特龙治疗时加入5α-还原酶抑制剂是必要。而且大量研究表明,5α-还原酶1型在CRPC中过表达,其在产生DHT的后门途径中具有关键作用[29]。
此外,ALYAMANI等[52]在另一项研究中发现,另一种甾体类CYP17A1抑制剂Galeterone,存在同样依赖于3β-HSD的类似代谢途径,其代谢物之一5α-galeterone也是一种适度的AR激动剂。因此这些研究表明,存在HSD3B1(1245 A>C)遗传变体的患者比野生型基因型患者更快地将甾体类CYP17A1抑制剂阿比特龙代谢为D4A,最终导致大量AR激动剂5α-Abi的产生而促进肿瘤进展,这可能部分地降低了这些患者阿比特龙的治疗效果[50],但目前尚无足够证据证明这一观点。然而,种系HSD3B1(1245C)变体并不能预测晚期前列腺癌患者对阿比特龙的反应持续时间。这一发现可能是由于AA代谢物在雄激素信号传导中既可以发挥激动剂(3-酮-5α-阿比特龙)也可以作为拮抗剂(D4-阿比特龙)的作用[53]。那么与甾体类CYP17A1抑制剂相比,HSD3B1基因对非甾体类CYP17A1抑制剂是否也有同样的影响值得探讨。
4.4 HSD3B1变异体对非甾体类CYP17A1抑制剂的影响与甾体类CYP17A1抑制剂阿比特龙相反,非甾体类CYP17A1抑制剂酮康唑的代谢过程中似乎并无类似的促进肿瘤生长的代谢物产生;ALMASSI等[37]在研究中发现,在ADT加入非甾体类CYP17A1抑制剂酮康唑可改善HSD3B1(1245C)变异患者的无进展生存期。且对于CRPC患者使用酮康唑治疗,其受益程度可随着HSD3B1(1245C)变异等位基因数量的增加而增加。因此,有学者提出HSD3B1(1245C)变异等位基因可作为选择非甾体CYP17A1抑制剂治疗的患者理想的预测生物标志物[30-34,53]。
5 总结与展望
总而言之,目前的研究数据一致表明,伴有HSD3B1(1245 A>C)变异的前列腺癌患者会因为促进性腺外雄激素的合成而导致其ADT预后更差。而,对于甾体类CYP17A1抑制剂阿比特龙而言,在伴有HSD3B1(1245 A >C)变异的PCa患者中,可能会通过影响其代谢,而导致其疗效受到影响。因此,HSD3B1(1245 A>C)等位基因有望成为PCa患者预后及选择性治疗的预测性标志物。
虽然预测性生物标志物可以帮助个性化治疗的选择,然而,目前临床上并没有有效的预测性标志物常规用于晚期PCa的治疗。随着研究的深入,HSD3B1基因有望成为针对该患者群体引入的第一个预测性生物标志物。此外,对HSD3B1变体进行检测还有望为临床试验选择更适合的患者,甚至开发针对HSD3B1靶点的药物以改善ADT疗效,进而推动PCa治疗领域的发展。
