长链非编码RNA RP11-356I2.2对胃癌的调控作用研究
2019-08-26李歆冯金鑫杨素冰刘高杰张相良
李歆 冯金鑫 杨素冰 刘高杰 张相良
广州医科大学附属肿瘤医院1检验科,2腹外科(广州510095)
胃癌在我国所有恶性肿瘤的发病率和死亡率中名列第二位[1]。其预后差,临床仍需探索出新的早期诊断方法、预后指标以及寻找有效治疗靶点[2]。
长链非编码RNA(long noncoding RNA,lncRNA)通过多种机制(如基因印记、染色质重塑、细胞周期调控、剪接调控、mRNA降解和翻译调控等)在多种层面上(如表观遗传学、转录调控及转录后调控等)调控基因的表达水平[3],与蛋白质、RNA和DNA相互作用。越来越多的研究证实,LncRNA在肿瘤中异常的表达水平与肿瘤的发生发展关系密切,可作为双重调控因子参与肿瘤发生发展的多种过程[4-5]。笔者在前期研究中,通过应用高通量LncRNA表达谱芯片及定量RT-PCR发现RP11-356I2.2在胃癌病人血清中异常表达,且经精准腹腔热灌注化疗后RP11-356I2.2上调明显[6],但是RP11-356I2.2对胃癌细胞的增殖、迁移及成瘤的调控机制目前尚未完全阐明。本研究通过实验检测胃癌细胞株BGC-823、SGC-7901细胞中RP11-356I2.2的表达变化,并过表达RP11-356I2.2对胃癌细胞SGC-7901增殖、迁移能力的影响,将转染了过表达RP11-356I2.2质粒的胃癌细胞SGC-7901/RP11-356I2.2注入裸鼠皮下观察SGC-7901/RP11-356I2.2细胞成瘤能力的改变。
1 材料与方法
1.1 细胞及主要试剂正常人胃黏膜细胞株GES-1以及人胃癌细胞株SGC-7901、BGC-823均来自广州医科大学附属肿瘤医院细胞库。各细胞系均用含10%FBS的DMEM培养基培养,置于37℃、5%CO2的恒温孵箱中常规进行传代培养。DMEM培养液由美国Gibco公司生产,实时荧光定量PCR试剂盒购自于日本Takara公司,RP11-356I2.2质粒由上海吉玛公司提供,Lipofectamin2000、TRIzol购于美国Invitrogen公司。结晶紫染液、MTT试剂盒等购自美国Sigma公司,细胞培养皿、Transwell小室、离心管等一次性耗材购自美国BD公司。
1.2 胃癌细胞的RP11-356I2.2表达水平检测实验采用Real-Time PCR法检测胃黏膜GES-1细胞和胃癌BGC-823、SGC-7901细胞中的RP11-356I2.2表达水平的差异。首先,应用Trizol法提取组织和细胞中的总RNA,用逆转录试剂盒合成cDNA,用TakaraSYBR Premix Ex Taq试剂盒检测样品中RP11-356I2.2及内参GAPDH的相对表达量,具体操作步骤按说明书进行。RP11-356I2.2上游引物序列为:5′-TGCCCATGTCCACCCATAAG-3′,下游引物序列为:5′-TCGGGGACTGGCATTTTCAC-3′;内参 GAPDH上游引物序列为:5′-CCATGAGAAGTATGACAAC-3′,下游引物序列为:5′-GAGTCCTTCCACGATACC-3′,以 2-ΔΔCt法表示 RP11-356I2.2 相对表达量。
1.3 RP11-356I2.2对胃癌细胞增殖、迁移的调节作用观察
1.3.1 分组将胃癌SGC-7901细胞分为RP11-356I2.2过表达组、空质粒组,分别转染SGC-7901过表达质粒、空质粒,转染试剂均应用Lipofectamin2000试剂,实验步骤均按其说明书进行操作,转染后37℃恒温培养24 h。
1.3.2 各组胃癌细胞增殖能力观察MTT法:收集对数期细胞,调整细胞悬液浓度,每孔加入100 μL,铺板使待测细胞调密度至103~104个/孔,5%CO2、37℃孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物,细胞贴壁后即可加药。每组6个复孔,每孔加入20 μL的MTT反应液,合并加入150 μL二甲基亚砜,为充分溶解结晶物,将体系置于水平摇床上以最低速振荡12 min。在酶标仪波长490 nm条件下测得各孔的OD490。
克隆形成实验:取对数生长期的细胞,0.25%的胰蛋白酶消化,离心,将转染后各组细胞以每孔500~800个细胞的密度接种于6孔板中,放入孵箱,调整细胞密度到103/mL,每3~4 d更换培基,连续培养2~3周,培养结束后以纯甲醇固定30 min,再以0.1%结晶紫染液染色20~30 min,最后以清水漂洗干净,倒置晾干后取照,将培养板置于显微镜下计数克隆数。
1.3.3 各组胃癌细胞迁移能力观察Transwell小室实验:先让细胞撤血清饥饿12~24 h,去除血清的影响。应用胰酶消化细胞,含血清培养基终止消化,1 000 r/min离心弃去培养基,用PBS洗涤1至2遍,用无血清培养基重悬细胞。利用计数仪调整细胞密度至105~106个/mL。取细胞悬液100~200 μL加入Transwell小室。将小室置入预先添加有500 μL含FBS的培养基,37℃恒温培养 24 h。无菌棉签轻柔拭去小室内表面细胞,纯甲醇固定滤膜20~30 min。固定结束,以0.1%结晶紫染色25 min,显微镜下统计穿膜细胞总数。
细胞划痕实验:转染后24 h,在各组细胞培养孔内用10 μL Tip头划3~5条均匀的平行线,定期更换含1%FBS的培养基,连续定期监测48 h,测算划痕愈合率。
1.4 RP11-356I2.2构建及成瘤观察
1.4.1 RP11-356I2.2构建(1)胃癌细胞株SGC7901在无菌条件下培养至状态良好;(2)转染前,取对数期细胞用胰酶消化,并接种六孔板中培养;(3)A液:无血清培养基稀释RP11-356I2.2过表达质粒及空质粒;B液:无血清培养基稀释Lipofecta-
min2000转染剂;(4)A液、B液室温下各自孵育5 min后,将A液和B液混匀并孵育15 min,即配置成含有RP11-356I2.2过表达及空质粒转染剂;(5)当细胞密度达50%时,用六孔板PBS漂洗2~3遍,更换无血清培养基,同时分别加入含有RP11-356I2.2过表达的转染剂及空质粒转染剂,轻摇后置入培养箱;(6)6 h后将含有Lipofectamin2000的培养基洗去,更换新培基;(7)转染72 h后,行效果监测及相关实验。
1.4.2 RP11-356I2.2成瘤观察取20只约5周龄的雌性裸鼠,并随机均等分为RP11-356I2.2对照组及过表达组,每组10只裸鼠,分别在其背部皮下注射转染处理后24 h的RP11-356I2.2过表达组细胞和空质粒组细胞约1.5×106个,3周后处死小鼠,并测量肿瘤体积和质量。计算体积(V)公式:V=(L×W2)/2,其中 L是肿瘤的最大径线长度,W是肿瘤的最大宽度。
1.5 统计学方法统计应用GraphPad Prism 6和SPSS 20.0软件。数据以(±s)表示,组间应用方差分析以及独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BGC-823、SGC-7901、GES-1细胞中RP11-356I2.2相对表达量比较 BGC-823、SGC-7901细胞中RP11-356I2.2的相对表达水平分别是GES-1的(0.45±0.22)、(0.37±0.25)倍,相对表达水平均显著低于GES-1细胞(P<0.05)。
2.2 各组胃癌细胞增殖能力比较各组别胃癌SGC-7901/RP11-356I2.2的细胞OD490以及克隆形成总数见表1,RP11-356I2.2过表达组的OD490值、克隆形成数均低于空质粒组(P<0.05)。
表1 各组胃癌BGC-823、SGC-7901细胞OD490值和克隆形成数比较Tab.1 Comparison of OD490value and cloning number of BGC-823 and SGC-7901 cells in each group ±s

表1 各组胃癌BGC-823、SGC-7901细胞OD490值和克隆形成数比较Tab.1 Comparison of OD490value and cloning number of BGC-823 and SGC-7901 cells in each group ±s
注:与siRNA对照序列组相比,*P<0.05;与空质粒组相比,#P<0.05
组别RP11-356I2.2siRNA组siRNA对照序列组RP11-356I2.2过表达组空质粒组OD490 BGC-823细胞0.86±0.08*1.22±0.05 0.69±0.06#1.44±0.03 SGC-7901细胞1.39±0.25*1.89±0.10 1.13±0.04#1.74±0.06克隆数(个)BGC-823细胞109.76±9.50*302.51±11.74 83.20±21.33#141.00±11.51 SGC-7901细胞124.67±12.79*284.33±13.50 71.78±23.54#118.02±14.98
2.3 各组胃癌细胞迁移能力比较RP11-356I2.2过表达组SGC-7901细胞穿膜细胞数低于空质粒组[(241.16 ± 7.95)vs.(433.41 ± 13.71),P< 0.01,图1-2]。RP11-356I2.2/SGC-7901及空质粒/SGC-7901细胞划痕愈合率分别为(17.67±1.53)% 、(62.67±2.52)%,差异统计学意义(P<0.05,图3)。
2.4 RP11-356I2.2过表达组、对照组裸鼠肿瘤体积及质量的比较SGC-7901/RP11-356I2.2组裸鼠肿瘤体积、小于对照组裸鼠肿瘤体积分别为[(322.61± 161.53)mm3vs.(718.30 ± 246.43)mm3,P=0.017],见图4A、B;SGC-7901/RP11-356I2.2组裸鼠肿瘤质量亦小于对照组[(0.42± 0.22)mgvs.(0.88±0.36)mg,P=0.041],见图4C)。
3 讨论
胃癌在我国的发病率和死亡率近几年均居高不下,并有缓慢上升的趋势[7],临床上缺乏有效的早期筛选生物标记物,胃癌患者的总体预后较差,若出现远处转移,5年生存率低于10%。
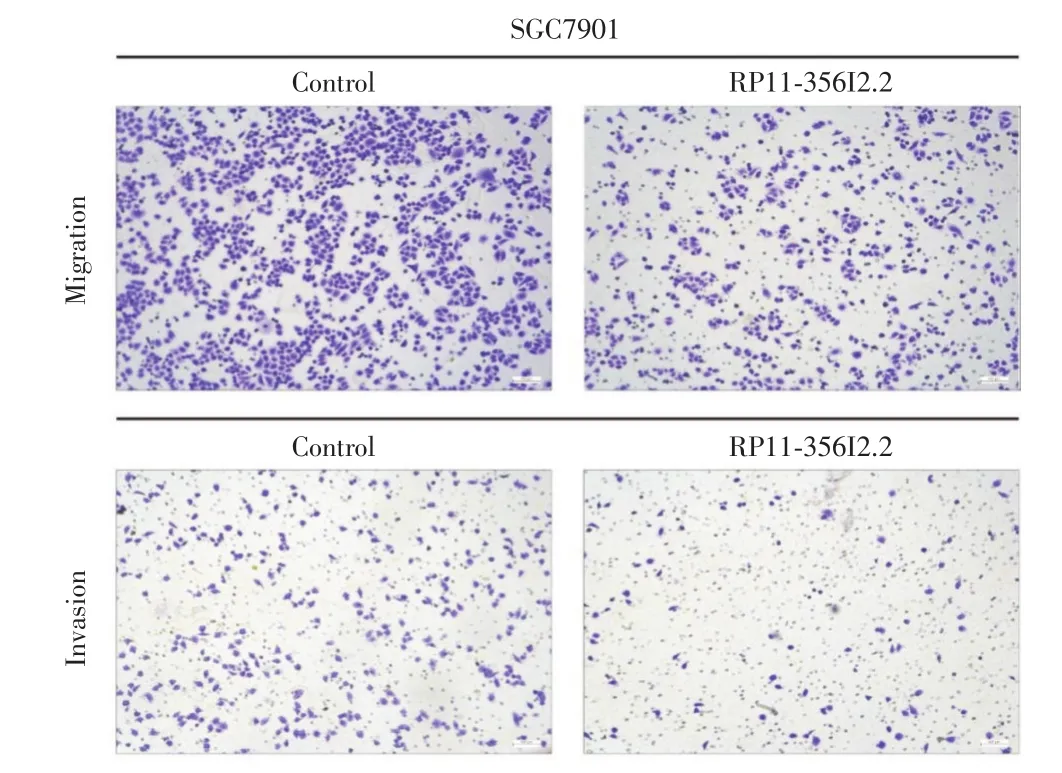
图1 Transwell小室实验(显微镜下观察迁移至下室细胞,200×)Fig.1 TranswellChamber experiment(microscopically,the cells migrated to the lower ventricle with a magnification of 200×)

图2 Transwell实验(任意选择9个高倍镜视野,统计侵袭迁移至下室细胞数目)Fig.2 Transwell experiment(Select 9 high power microscopic fields randomly and count the number of invasive cells migrating to the lower ventricle)

图3 划痕实验检测过表达RP11-356I2.2对胃癌细胞迁移能力的影响Fig.3 Scratch assay was used to detect the effect of overexpression of RP11-356I2.2 on migration of gastric cancer cells

图4 裸鼠动物模型Fig.4 Nude mice model
既往诸多研究揭示,LncRNA几乎全程参与胃癌的发生发展。其中包含肿瘤细胞的侵袭转移、增殖凋亡、自噬、多药耐药及预后等多个过程[8-11]。例如,有学者证实LncRNA DGCR5在胃癌组织和胃癌患者血浆样本中下调,其下调与晚期TNM分期及淋巴转移阳性有关,DGCR5过表达可以抑制肿瘤生长,抑制miR-23b和增殖抗原Ki-67的表达,同时调控PTEN和BTG1在体内的表达[12]。JIN等[13]研究表明,Lnc00165在胃癌组织和细胞系中表达上调,Lnc00165的高表达与胃癌的肿瘤结节浸润深度、转移分期和总生存期存有密切关系。功能实验表明,Lnc00165基因的下调抑制了GC细胞的增殖、迁移和侵袭,Lnc00165基因的过表达刺激了GC细胞的增殖、迁移和侵袭;在机制上,Lnc00165可促进GC细胞的上皮间质转化。ZHANG等[14]研究表明LncRNA HOXC-AS3在体外和体内均可调节细胞增殖和迁移,RNA下拉质谱分析发现YBX1与HOXC-AS3相互作用,RNA-seq分析发现YBX1敲除后差异表达的基因与HOXC-AS3转录调控的基因明显重叠,说明YBX1参与了HOXC-AS3介导的基因转录调控在胃癌的发生发展过程中发挥重要作用。在胃癌细胞系中LncRNA H19可通过H19/miR-675/FADD/caspase 8/caspase 3通路调节胃癌细胞的生长[15]。此外,LIU 等[16]研究表明,RUNX1的引入抑制了H19/miR-675诱导的Akt/mTOR通路激活,以及随后AGS细胞的增殖和侵袭,RUNX1作为H19/miR-675轴与Akt/mTOR信号通路之间的链接,是H19/miR-675诱导胃癌进展的关键中介因子。
LncRNA水平的异常表达与多种人类疾病包括癌症有关,可通过DNA或组蛋白甲基化、染色质重塑,从而改变基因的表达。还具有吸附miRNA的海绵功能[17-18]。LncRNA在调控组织分化的重要机制已取得大量研究成果,其在胃癌及结直肠癌中的作用也逐渐被揭晓。目前仍存在争议的是,其在肿瘤中究竟发挥促进亦或抑制的作用[19-20]。本研究发现胃癌细胞中RP11-356I2.2显著低于正常胃黏膜上皮细胞的表达水平,这与笔者前期研究中利用GEO数据库进行胃癌相关基因分析得出的RP11-356I2.2是胃癌相关抑癌基因的结论一致。采用胃癌SGC-7901细胞系过表达RP11-356I2.2,能显著抑制胃癌细胞的增殖和侵袭迁移能力。裸鼠成瘤实验进一步验证,注入稳定表达SGC-7901/RP11-356I2.2细胞系后,裸鼠体内裸鼠成瘤能力显著减弱。其证实RP11-356I2.2在调控胃癌细胞增殖、侵袭迁移、成瘤能力等各方面均具有重要作用,初步阐明RP11-356I2.2在胃癌发生发展过程中的作用机制。以上研究结果提示,RP11-356I2.2参与胃癌的发生发展过程,可作为胃癌早期诊断和评判胃癌预后的重要潜在分子标志物。但是,其调控下游基因转录和蛋白质翻译的作用,通过何种信号转导通路发挥此作用,以及介导上游因子的调控机制,都有待更进一步的研究。
