紫菜多糖抑制哮喘大鼠模型NF-κB 信号通路
2019-08-26李智红
刘 璟, 李智红, 胡 玲
(重庆三峡医药高等专科学校, 重庆404120)
NF-κB 转录因子及其抑制物I-κB 共同构成的NF-κB 信号通路, 普遍存在于哺乳动物各种细胞中。 研究表明, NFκB 信号通路被激活后, 可通过调节树突细胞的表型表达[1]来干预T/B 细胞活化、 分化[2], 调节细胞因子(如TNFα、 白介素)、 免疫受体、 急性期蛋白等分泌, 在支气管哮喘的炎症病程中具有中心调节的作用[3-4]。 本实验以此为切入点, 研究紫菜多糖对哮喘大鼠模型肺组织中NF-κB 信号通路表达的作用。
1 材料
1.1 动物 SPF 级健康大鼠30 只, 9 ~10 周龄, 雌雄各半, 体质量(200±20) g, 由成都达硕实验动物有限公司提供, 动物许可证号SCXK (川) 2013-24。
1.2 试药 紫菜多糖由西安斯诺特生物技术有限公司提取, 含有量90%。 TNF-α、 IL-1β、 IL-4、 IL-6 ELISA 检测试剂盒购于武汉华美科技有限公司; 兔抗鼠p-NF-κB p50 抗体、 兔抗鼠p-NF-κB p65 抗体、 HRP 标记的羊抗兔IgG、 βactin 购自美国Santa Cruz 公司。
1.3 仪器 轮转式切片机(德国徕卡公司); CX31-LV320数码显微镜 (日本奥林巴斯公司); Image Analysis Syste11.0 软件成像系统; DW-86L286 超低温冰箱(青岛海尔股份有限公司); BSC-1000ⅡA2 生物安全柜(苏州安泰空气技术有限公司); Multiskan MK3 酶标仪(芬兰雷勃公司); DYY-4C 电泳仪(北京六一仪器厂); Wizard5 扫描仪(上海中晶科技有限公司); Quantity one 7.0 分析软件(美国Bio-Rad 公司)。
2 方法
2.1 建模和分组 参考陈一平等报道[5-6], 第0、 14 天大鼠腹腔注射卵清蛋白, 每只注射量为100 μg, 第21 天开始进行5%卵清蛋白雾化, 连续7 d, 每次30 min, 以大鼠呼吸道分泌物涂片镜检判定建模成功。 结果, 成功建立模型大鼠20 只, 10 只作为模型组; 另外10 只腹腔注射紫菜多糖, 给药量为200 mg/kg, 作为干预组; 另取10 只健康大鼠作为正常组。 然后, 按预设评估标准考察大鼠症状,给药24 h 后取肺泡灌洗液, 处死后取肺组织进行相关处理。
2.2 评估标准 根据大鼠临床症状设置评估标准, 见表1, 采取叠分制计算, 无效分值1~3 分, 缓解分值4~6 分,显效分值7~9 分。
2.3 细胞因子检测 -4 ℃下10 mLPBS 分3 次灌洗大鼠右肺, 收集肺泡灌洗液, 1 500 r/min 离心10 min, 取上清液,按照试剂盒说明书步骤测定。

表1 大鼠临床症状评估标准
2.4 肺组织病理变化检查 取大鼠左肺下叶组织, 4%甲醛固定, 24 h 后冲洗, 石蜡包被, 苏木精-伊红(HE) 染色, 切4~5 μm 厚薄制片, 光镜下观察。
2.5 肺组织NF-κB 表达检测 取大鼠左肺上叶组织50 mg, 匀浆细胞, 常规制备组织蛋白裂解液, 提取细胞总蛋白, 以5%浓缩胶、 10%分离胶进行SDS-PAGE 电泳。 电转移至PVDF 膜上后, 5%脱脂奶粉封闭2 h, 加入兔抗鼠p-NF-κB p50 抗体(1 ∶1 000 稀释)、 兔抗鼠p-NF-κB p65 抗体(1 ∶1 000 稀释), 4 ℃下孵育12 h, TBST 洗涤3 次,加入HRP 标记的羊抗兔IgG (1 ∶2 000 稀释), 37 ℃下孵育1 h。 显色用增强发光显色系统, 条带用凝胶图像处理系统分析, NF-κB 蛋白相对表达量以NF-κB/β-actin (灰度值之比) 表示。
2.6 统计学分析 通过SPSS 18.0 软件进行处理, 数据以s) 表示, 组间比较采用单因素方差分析, 检验水准α=0.05, 以P<0.05 为差异有统计学意义。
3 结果
3.1 大鼠症状 模型组大鼠观察到进食改变, 呛咳喘息,腹部凹陷, 呼吸节律不齐、 频率加快, 精神狂躁, 抓挠口鼻, 严重者有攻击倾向; 紫菜多糖组大鼠呼吸逐渐平稳,进食和活动恢复, 反应灵敏。
3.2 肺组织病理变化 图1 显示, 模型组大鼠肺组织水肿, 炎细胞散在浸润, 细小支气管管壁肿胀增厚, 上皮细胞明显受损, 肺泡间距增大; 紫菜多糖组大鼠黏膜基本无水肿, 有极少散在炎细胞, 细小支气管管壁接近正常组大鼠的组织状态。

图1 各组大鼠肺组织病理变化(HE, ×200)
3.3 NF-κB 表达 图2~3、 表2 显示, 模型组NF-κB p50、NF-κB p65 表达显著高于正常组(P<0.01); 紫菜多糖组两者表达显著低于模型组(P<0.01), 但仍显著高于正常组(P<0.05)。
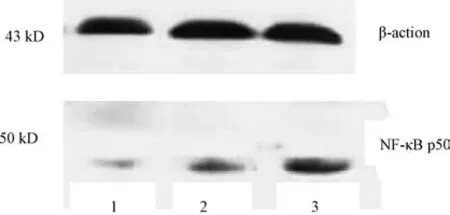
图2 各组NF-κB p50 蛋白表达
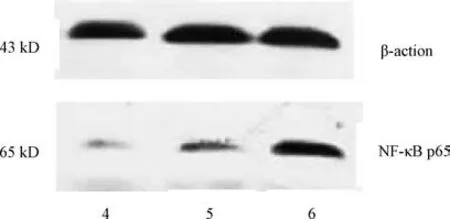
图3 各组NF-κB p65 蛋白表达
表2 紫菜多糖对NF-κB p50、 p65 蛋白表达的影响n=10)
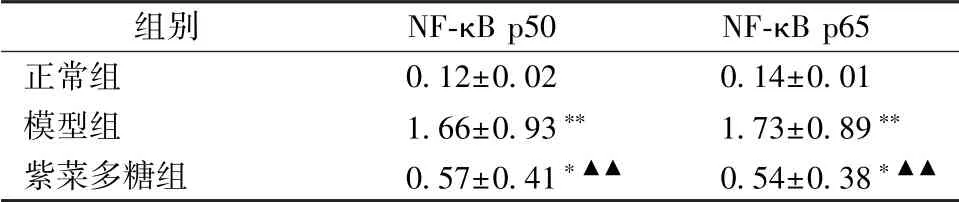
表2 紫菜多糖对NF-κB p50、 p65 蛋白表达的影响n=10)
注:与正常组比较,* P <0.05,** P <0.01;与模型组比较,▲▲P<0.01
images/BZ_213_1284_1842_2242_1891.png正常组 0.12±0.02 0.14±0.01模型组 1.66±0.93** 1.73±0.89**紫菜多糖组 0.57±0.41*▲▲ 0.54±0.38*▲▲
3.4 炎症因子水平 表3 显示, 与正常组比较, 模型组TNF-α、 IL-1β、 IL-4、 IL-6 水平显著升高(P<0.01); 与模型组比较, 紫菜多糖组四者水平显著降低(P<0.01), 但仍显著高于正常组(P<0.05)。
表3 紫菜多糖对TNF-α、 IL-1β、 IL-4、 IL-6 水平的影响 n=10, pg/mL)
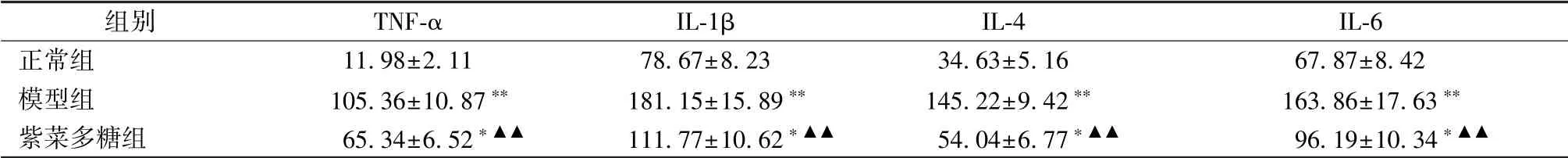
表3 紫菜多糖对TNF-α、 IL-1β、 IL-4、 IL-6 水平的影响 n=10, pg/mL)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,▲▲P<0.01
images/BZ_213_236_2472_2244_2522.png正常组 11.98±2.11 78.67±8.23 34.63±5.16 67.87±8.42模型组 105.36±10.87** 181.15±15.89** 145.22±9.42** 163.86±17.63**紫菜多糖组 65.34±6.52*▲▲ 111.77±10.62*▲▲ 54.04±6.77*▲▲ 96.19±10.34*▲▲
4 讨论
紫菜多糖在常见食物坛紫菜、 条斑紫菜中含有[7], 具有多种免疫调节作用, 谢好贵等[8-9]报道它可干预NK 细胞、 巨噬细胞功能, 对细胞因子表达进行调节, 从而起到抗肿瘤的作用; 邓青芳等[10]发现, 它可通过抗自由基损伤等机制治疗药物或酒精性肝损伤; 时超岚等[11-12]研究显示, 它通过TH 细胞亚群分化和表达的双向性免疫调节,在食物过敏中发挥作用, 但尚无对其他I 型超敏反应的研究。 因此, 本实验以NF-κB 信号通路的炎症调节功能为切入点, 将紫菜多糖干预哮喘动物模型。
造模后, 大鼠先后出现呼吸频率急促、 节律不齐、 用力呼吸、 精神狂躁等呼吸窘迫症状, 肺组织有重度炎性渗出和水肿, 细小支气管管腔狭窄明显; NF-κB 表达较正常组明显升高, 相关炎症因子水平也异常上升, 表明NF-κB信号通路激活后可升高TNF-α、 IL-1β、 IL-4、 IL-6 等炎症介质表达与释放, 导致大量单核-巨噬细胞和中性粒细胞趋化和浸润, 免疫细胞释放过量的致炎因子, 加重呼吸道炎症反应, 引起炎性损伤, 同时这些炎症因子又会反馈影响NF-κB 信号激活和表达, 形成恶性循环, 与前期报道一致[13-19]。 紫菜多糖干预后, 大鼠呼吸窘迫症状逐渐缓解,进食量、 活动、 精神状态基本恢复正常; 肺组织黏膜水肿基本消失, 细小支气管管腔肿胀减轻, 仅见极少炎细胞浸润; NF-κB p50、 p65 较模型组降低, NF-κB 信号蛋白表达亦然; TNF-α、 IL-1β、 IL-4、 IL-6 水平明显低于模型组,进一步证实该成分通过影响NF-κB 信号来干预这些相关细胞因子表达。 另外, 结合病理学检查发现紫菜多糖干预后大鼠肺组织仍有残余炎症反应, 可能与给药剂量、 时间有关, 同时与其他药物的比较与协同作用也不明确, 尚待进一步研究。
综上所述, 紫菜多糖对哮喘大鼠模型气道炎症有明显缓解作用, 其机制可能与NF-κB 信号通路及相关细胞因子表达有关。
