槲皮素对非酒精性脂肪性肝炎大鼠的影响
2019-08-26刘鸣昊张丽慧马庆亮赵文霞
刘鸣昊, 张丽慧, 马庆亮, 赵文霞
(河南中医药大学第一附属医院, 河南 郑州450004)
随着人民生活水平提高, 非酒精性脂肪性肝病发生率不断上升, 成人为20% ~33%[1], 非酒精性脂肪性肝炎和肝硬化分别占10% ~20% 和2% ~3%[2]。 其中, 非酒精性脂肪性肝炎已经成为21 世纪第二大肝脏疾病[3], 目前对其治疗以减肥降脂药物、 饮食运动、 行为纠正为主, 但他汀类药物在降脂的同时有着肝损害等副作用, 从而限制了临床应用[4]。
槲皮素是一种黄酮类化合物, 存在于芦荟等许多中药中, 具有一定抗炎、 抗氧化作用[5-6], 也能通过抑制炎性因子释放、 减少脂质合成、 改善胰岛素抵抗等治疗非酒精性脂肪性肝病, 但具体作用机制尚未阐明。 本实验探讨槲皮素对非酒精性脂肪性肝炎大鼠的影响, 以期明确该成分相关机制与靶点。
1 材料
1.1 动物 36 只SPF 级雄性SD 大鼠, 体质量(150±10) g, 合格证号11400700116588, 购自北京维通利华实验动物技术有限公司, 饲养于河南中医药大学实验动物中心, 实验动物许可证号SXYK(豫) 2015-0005。 实验前, 大鼠适应性喂养1 周。
1.2 仪器 ABI 7300 型荧光定量PCR 仪(美国Applied Biosystems 公司); PCR 配套分析软件、 电泳仪、 凝胶成像分析系统(美国Bio-Rad 公司);MK-3 酶标仪 (荷兰Thermo Labsystems 公司);Fresco 低温冷冻离心机(美国Thermo 公司); 全自动BS-220 生化分析仪(深圳迈瑞生物医疗电子股份有限公司); BX-43 光学显微镜(日本Olympas公司)。
1.3 试药 水合氯醛(批号20141025) 购自天津市光复精细化工研究所; F4/80 抗体、 Anti-PI3 Kinase p85 抗 体、 Anti-AKT1/2 抗 体、 Anti-AKT1(phospho T308) 抗 体、 Anti-NF-κB p65 抗 体、Anti-NF-κB p65 ( phospho S536) 抗 体 ( 批 号GR225009-2、 ab180967、 ab188099、 ab66134、ab16502、 ab86299) 购自英国Abcam 公司; 苏木素染液, 伊红、 油红O、 Masson 三色染色试剂盒,DAB 显 色 试 剂 盒 (批 号20151112、 20141124、08010、 20151207、 16155A01) 购自北京索莱宝科技有限公司; Trizol Reagent RNA 提取试剂(批号103105) 购自美国Life Technologies 公司; 荧光定量RT-PCR 试 剂 盒、 RNA 扩 增 试 剂 盒 (批 号4368814、 4367659) 购自美国Applied Biosystems公司; β-Actin 抗体(批号20536-1-AP) 购自美国ProteinTech 公司; PI3K、 AKT1、 AKT2、 β-actin 目的 基 因 引 物 ( 货 号 E01467-06、 E02414-02、E02414-04、 E01467-08) 委托南京金斯瑞生物科技有限公司设计合成。 槲皮素(批号PS000434) 购自成都普思生物科技股份有限公司。
2 方法
2.1 造模 大鼠按体质量分层随机分为空白组、模型组及槲皮素高、 低剂量组, 每组9 只。 空白组大鼠给予普通饲料, 其余各组大鼠给予高脂饲料(1%胆固醇+5%蛋黄粉+10%猪油+84%普通饲料)建模, 持续10 周。
2.2 给药 造模第2 周开始灌胃给药, 槲皮素用1%羧甲基纤维素钠助溶, 高、 低剂量组分别为80、 40 mg/kg, 而空白组、 模型组均为等体积1%羧甲基纤维素钠。
2.3 指标检测
2.3.1 组织学 造模第10 周结束后大鼠隔夜禁食, 次日腹腔注射10%水合氯酸(0.3 mL/kg) 麻醉, 取肝组织, 称取肝湿重以计算肝指数。 冰生理盐水冲洗大鼠肝脏, 从肝左叶取3 块0.5 cm×0.5 cm×0.2 cm 肝组织, 置于4%多聚甲醛中固定,石蜡包埋切片, 进行HE、 Masson 染色, 光镜下观察肝脏病变程度; 取1 块相同大小肝组织, 低温转送至河南中医药大学第一附属医院病理科作新鲜冰冻病理切片, 进行油红染色。 参照2010 年修订版《非酒精性脂肪性肝病诊疗指南》[1]中NAS 评分来考察造模是否成功, 标准为(1) 肝细胞脂肪变性, 0 分 ( <5%), 1 分 (5% ~33%), 2 分(34% ~66%), 3 分(>66%); (2) 小叶内炎症,0 分(无), 1 分(<2 个), 2 分(2 ~4 个), 3 分(>4 个); (3) 肝细胞气球样变性, 0 分(无), 1分(少见), 2 分(多见), NAS<3 分可排除非酒精性脂肪性肝炎, NAS>4 分可诊断, 介于两者之间者为有可能[7]。 然后, 对大鼠肝组织脂肪变性、炎症、 纤维化按照标准计分进行判定, 并采用双盲读片法, 由河南中医药大学第一附属医院病理科2位医师同时盲法阅片协助评估。
2.3.2 免疫组化F4/80 以F4/80 为Kupffer 细胞标志, 免疫组化染色检测各组大鼠肝脏Kupffer 细胞活化水平, 按试剂盒说明书进行操作(F4/80 一抗∶1%BSA=1 ∶200)。
2.3.3 PI3K, AKT1, p-AKT1, NF-κB p65, p-NF-κB p65 蛋白表达 采用Western blot 法。 称取大鼠肝组织50 mg, 加入裂解液, 15 000 r/min 匀浆, 冰上孵育20 min, 4 ℃、 13 000 r/min 离心20 min, 离心后取上清, BCA 法蛋白定量, 调整蛋白浓度, 煮沸变性5 min。 冰浴冷却, 上样量为每泳道20 μg/孔, 浓缩胶恒压90 V, 约20 min, 分离胶恒压160 V, 电泳后根据目标蛋白分子量切胶,转膜, 3%BSA-TBST 封闭30 min, TBST 清洗加入PI3K 一抗(1 ∶1 000)、 AKT1 一抗(1 ∶1 000)、p-AKT1 一抗(1 ∶1 000)、 NF-κB p65 一抗(1 ∶1 000)、 p-NF-κB p65 一抗(1 ∶1 000) 孵育, 过夜, 二抗孵育40 min, ECL 化学发光显影, 放入凝胶成像系统进行化学发光, 以β-actin 为内标, 通过Image J 软件分析条带灰度值计算相对蛋白表达量。
2.3.4 PI3K、 AKT1、 AKT2、 NF-κB mRNA 表达 采用荧光定量PCR 法。 取50 mg 大鼠肝组织,液氮研磨至粉状, 25 ℃下放置3 min 后加1 mL Buffer RLT, 再放置5 min, 使粉状组织充分与Trizol 溶解, 12 000 r/min 离心5 min, 吸取上清,舍弃沉淀, 余下按照试剂盒说明书操作步骤进行, 扩增条件为95 ℃15 s, 60 ℃1 min, 95 ℃15 s, 40 个循环后进行分析, 2-△△ct法计算结果,引物序列见表1。
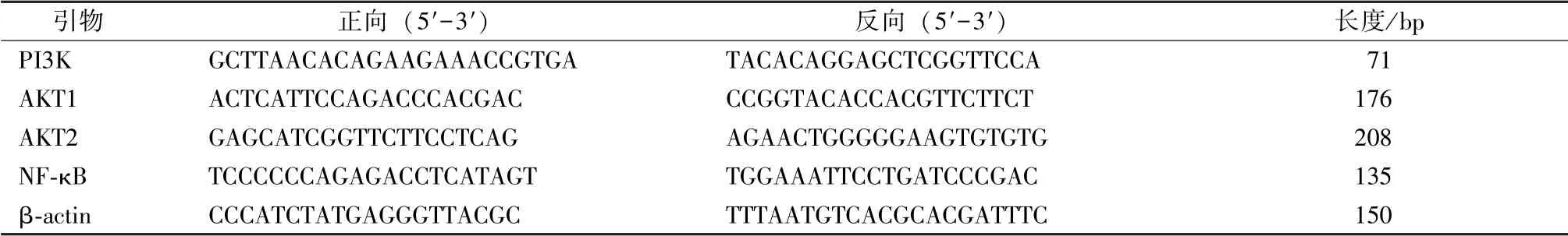
表1 引物序列Tab.1 Primer sequences
2.3.5 统计学分析 通过SPSS 19.0 软件进行处理, 数据以s) 表示, 多组间均数比较采用单因素方差分析。 P <0.05 表示差异有统计学意义。
3 结果
3.1 大鼠肝脏组织HE 染色 图1 显示, 空白组大鼠肝小叶结构清晰, 肝板排列规则, 肝细胞围绕中央静脉呈放射状排列, 肝细胞大小形态正常, 未见脂肪变性; 模型组大鼠肝小叶结构紊乱, 肝板排列不规则, 小叶内肝细胞肿大, 胞浆内可见大小不等脂滴(肝细胞呈大小泡混合性脂肪变性), 细胞核被挤向一边, 脂变肝细胞周围可见点灶状坏死,少量肝细胞气球样变; 槲皮素低剂量组大鼠肝小叶结构可辨, 肝板排列稍紊乱, 肝细胞内脂滴较模型组减少, 以大小泡性混合性脂变为主, 小叶内偶见点状坏死, 汇管区少量炎症细胞浸润; 槲皮素高剂量组大鼠肝小叶结构较清晰, 肝细胞呈放射状排列, 少数肝细胞胞浆内可见大泡性脂滴, 少数汇管区偶见个别炎症细胞。

图1 各组大鼠肝脏组织HE 染色(×200)Fig.1 HE staining of rat liver tissues in various groups (×200)
3.2 大鼠肝脏组织油红O 染色 图2 显示, 空白组大鼠肝细胞胞浆、 胞核呈蓝色, 未见明显橘红色脂滴; 模型组大鼠肝细胞胞浆中可见多个大小不等的橘红色脂滴, 呈弥漫性分布; 槲皮素组大鼠肝细胞脂滴缩小并减少, 染色变浅, 其中高剂量组仅有少量细小红色脂滴呈散在性分布, 与空白组最接近。
3.3 大鼠肝脏组织Masson 染色 图3 显示, 空白组大鼠肝小叶结构清晰, 未见明显胶原纤维沉积;模型组大鼠肝腺泡3 区窦周纤维化、 汇管区周围纤维组织增生, 部分可见桥接纤维化; 与模型组比较, 槲皮素组胶原纤维沉积不同程度减轻。
3.4 NAS 评分 表2 显示, 与空白组比较, 模型组NAS 评分显著升高(P<0.05), 而且>4 分, 符合非酒精性脂肪性肝炎组织学诊断; 与模型组比较, 槲皮素组NAS 评分显著降低(P<0.05)。
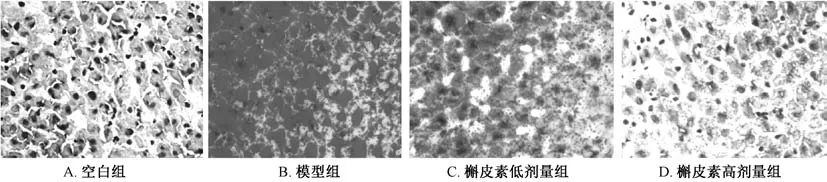
图2 各组大鼠肝脏组织油红O 染色(×400)Fig.2 Oil red O staining of rat liver tissues in various groups (×400)

图3 各组大鼠肝脏组织Masson 染色(×200)Fig.3 Masson staining of rat liver tissues in various groups (×200)
表2 各组NAS 评分比较n=9)Tab.2 Comparison of NAS scores among various groups s, n=9)

表2 各组NAS 评分比较n=9)Tab.2 Comparison of NAS scores among various groups s, n=9)
注:与空白组比较,*P<0.05; 与模型组比较,# P<0.05
images/BZ_72_236_1528_2244_1578.png空白组 — 0.00±0.00 0.17±0.39 0.00±0.00 0.17±0.39模型组 — 2.64±0.50* 2.09±0.30* 1.27±0.47* 6.00±0.78*槲皮素低剂量组 40 1.42±0.35# 1.03±0.28# 0.77±0.32 3.22±0.56#槲皮素高剂量组 80 0.78±0.38# 0.48±0.42# 0.55±0.24# 2.97±0.51#
3.5 大鼠肝脏组织F4/80 染色 表3、 图4 显示,空白组大鼠肝组织中央静脉周围肝血窦内个别细胞阳性, 呈淡褐色染色, 表明Kupffer 细胞无明显活化; 模型组大鼠肝血窦及炎症坏死灶内见大量阳性细胞, 呈棕褐色染色, Kupffer 细胞活化程度显著高于空白组(P<0.05); 槲皮素组大鼠Kupffer 细胞活化程度显著低于模型组(P<0.05)。
表3 各组Kupffer 细胞活化程度比较(n=9)Tab.3 Comparison of Kupffer cell activation degrees among various groups , n=9)

表3 各组Kupffer 细胞活化程度比较(n=9)Tab.3 Comparison of Kupffer cell activation degrees among various groups , n=9)
注:与空白组比较,*P<0.05; 与模型组比较,# P<0.05
images/BZ_72_1284_2035_2242_2085.png空白组 — 0.06±0.03模型组 — 0.34±0.02*槲皮素低剂量组 40 0.25±0.02#槲皮素高剂量组 80 0.12±0.03#

图4 各组大鼠肝脏组织F4/80 染色(×400)Fig.4 F4/80 staining of rat liver tissues in various groups (×400)
3.6 槲皮素对PI3K、 AKT1、 p-AKT1、 NF-κB p65、 p-NF-κB 蛋白表达的影响 表4、 图5 显示,与空白组比较, 模型组PI3K, AKT1, p-AKT1 蛋白表达显著降低(P<0.05), NF-κB、 p-NF-κB 蛋白表达显著升高(P<0.05); 与模型组比较, 槲皮素组PI3K、 p-AKT 蛋白表达显著升高(P<0.05),NF-κB p65、 p-NF-κB p65 蛋白表达显著降低(P<0.05)。
表4 槲皮素对PI3K、 AKT1、 p-AKT1、 NF-κB p65、 p-NF-κB p65 蛋白表达的影响, n=9)Tab.4 Effects of quercetin on PI3K, AKT1, p-AKT1, NF-κB p65 and p-NF-κB p65 protein expressions n=9)
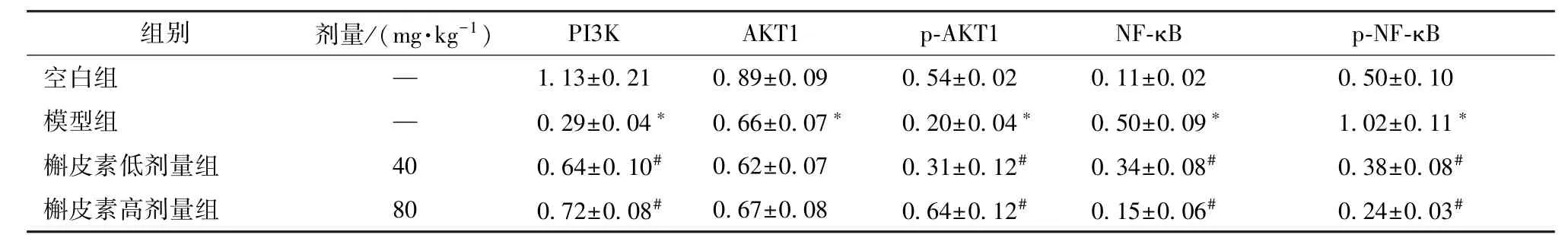
表4 槲皮素对PI3K、 AKT1、 p-AKT1、 NF-κB p65、 p-NF-κB p65 蛋白表达的影响, n=9)Tab.4 Effects of quercetin on PI3K, AKT1, p-AKT1, NF-κB p65 and p-NF-κB p65 protein expressions n=9)
注:与空白组比较,*P<0.05; 与模型组比较,# P<0.05
images/BZ_73_236_452_2244_510.png空白组 — 1.13±0.21 0.89±0.09 0.54±0.02 0.11±0.02 0.50±0.10模型组 — 0.29±0.04* 0.66±0.07* 0.20±0.04* 0.50±0.09* 1.02±0.11*槲皮素低剂量组 40 0.64±0.10# 0.62±0.07 0.31±0.12# 0.34±0.08# 0.38±0.08#槲皮素高剂量组 80 0.72±0.08# 0.67±0.08 0.64±0.12# 0.15±0.06# 0.24±0.03#

图5 各组大鼠肝脏组织ADPN、 AdipoR2 蛋白表达Fig.5 ADPN and AdipoR2 protein expressions of rat liver tissues in various groups
3.7 槲皮素对PI3K、 AKT1、 AKT2、 NF-κB mRNA表达的影响 表5 显示, 与空白组比较, 模型组PI3K、 AKT1、 AKT2 mRNA 表 达 显 著 降 低 (P<0.05), NF-κB mRNA 表达显著升高(P <0.05);与模型组比较, 槲皮素高剂量组PI3K、 AKT1、AKT2 mRNA 表达显著升高 (P <0.05), NF-κB mRNA 表达显著降低(P <0.05), 而低剂量组仅AKT2 mRNA 表达显著升高(P<0.05)。
4 讨论
随着对非酒精性脂肪性肝炎的研究不断深入,发现其形成、 发展与胰岛素抵抗、 氧化应激、 脂质过氧化外, 细胞自噬与调亡、 各类脂肪因子、 遗传、 个人因素等相关, 但“二次打击” 依然是目前公认的经典学说[8], “第一次打击” 为肥胖、 2型糖尿病、 高脂血症等伴随的瘦素及胰岛素抵抗,引起肝内脂肪蓄积, “第二次打击” 为脂肪堆积的肝脏发生慢性炎症反应, 脂质过氧化损伤, 微粒体、 线粒体功能受抑, 肝细胞凋亡, 星状细胞激活, 从而诱发该疾病和肝纤维化[9]。
表5 槲皮素对PI3K、 AKT1、 AKT2、 NF-κB mRNA 表达的影响s, n=9)Tab.5 Effects of quercetin on PI3K, AKT1, AKT2 and NF-κB mRNA expressions n=9)

表5 槲皮素对PI3K、 AKT1、 AKT2、 NF-κB mRNA 表达的影响s, n=9)Tab.5 Effects of quercetin on PI3K, AKT1, AKT2 and NF-κB mRNA expressions n=9)
注:与空白组比较,*P<0.05; 与模型组比较,# P<0.05
images/BZ_73_236_1696_2244_1754.png空白组 — 1.00±0.23 1.00±0.31 1.00±0.20 1.00±0.20模型组 — 0.47±0.24* 0.46±0.15* 0.29±0.17* 1.89±0.46*槲皮素低剂量组 40 0.68±0.21 0.58±0.14 0.78±0.24# 1.42±0.24槲皮素高剂量组 80 0.98±0.22# 0.82±0.23# 1.13±0.31# 1.02±0.26#
磷脂酰肌醇3-激酶(PI3K) 具有脂类激酶活性与蛋白激酶活性, 可被各种理化因素和细胞因子激活, 产生PIP2、 PIP3, 发挥细胞内第二信使的功能; 作用于PI3K/AKT 通路, 从而使多种细胞功能(如凋亡、 增殖、 代谢、 分泌、 趋化等) 得到发挥, 并在炎症、 代谢和肿瘤疾病的发病过程中扮演重要角色[10-11]。 丝氨酸/苏氨酸激酶AKT 是PI3K/AKT 信号通路的主要的下游分子, 包括AKT1、 AKT2、 AKT3 3 种亚型, 其中AKT1 可在多种组织中普遍表达; AKT2 主要在胰岛素敏感型组织表达, 在其余组织中呈低表达; AKT3 只表达于大脑和睾丸中。 核因子κB (NF-κB) 是一种快反应转录因子, 由p50/p65 构成的异二聚体, 可被包括PI3K/AKT 信号通路在内的多种刺激因素激活[12], 与IκB 解离后变为活性状态, 转位进入细胞核, 进而结合核内的κB 位点, 再进一步调控下游的靶基因表达, 从而参与肝脏炎症、 肝脏纤维化以及细胞凋亡等病理过程的发生[13]。 动物实验研究发现, 非酒精性脂肪性肝炎大鼠肝组织NF-κB mRNA 表达明显增加[14]; 大量临床研究表明, 患者NF-κB 活性也明显上升, 提示它在疾病发生过程中扮演了重要角色, 其机理可能是出现了脂质过氧化, 激活了NF-κB[15], 刺激了炎症因子出现,从而加重炎症作用, 然后这些因子在原有基础上再次激活NF-κB, 造成正反馈调节, 使炎症信号不断扩大[16]。
本实验通过HE、 油红O、 Masson 染色发现,槲皮素能改善非酒精性脂肪性肝炎大鼠肝脏脂质沉积, 减轻炎症细胞浸润, 改善肝脏纤维化病变; 有效改善肝细胞脂肪变性、 小叶内炎症、 肝细胞气球样变, 减少Kupffer 细胞活化水平; 高剂量下还能提高肝组织PI3K、 AKT1 表达, 降低NF-κB p65 表达, 其机制可能是通过调控PI3K/AKT/NF-κB 信号传导通路、 抑制炎症反应所致。
