黄芪总黄酮对脑缺血再灌注损伤大鼠氧化应激、 炎症、 凋亡的影响
2019-08-26马历历孙立明衣柏慧
马历历, 李 浩, 孙立明, 董 阳, 衣柏慧
(吉化集团公司总医院神经内科, 吉林 吉林132000)
脑血管病是中老年人群常见慢性病, 危害严重, 以缺血性脑血管病发病率最高, 约占80%[1],故及时恢复脑组织缺血(即血液再灌注) 可减少脑损伤, 但在某些情况下缺血后血流恢复时反而进一步引起功能障碍和组织损伤, 称为脑缺血再灌注损伤[2]。 目前, 治疗脑缺血再灌注损伤的药物往往毒副作用较大, 作用机制单一, 效果不佳, 而中药可从多环节、 多层次、 多靶点上发挥作用[3],故阐明相关作用机制具有重大意义。
中医认为, 黄芪具有利尿托毒、 益气补中等作用, 临床上用于治疗气虚、 脾虚、 肺虚、 阳虚、 体虚等多种虚证, 其主要活性成为氨基酸、 皂苷、 多糖、 黄酮[4], 其中黄酮具有多种生理作用, 如抑制黑色素生成、 降血糖、 抗过敏、 抗病毒、 抗癌等[5], 而且黄芪总黄酮也具有抑制氧化应激、 减少炎症反应及抗凋亡等活性[6-8]。 氧化应激、 炎症反应、 凋亡与脑缺血再灌注损伤发生发展密切相关[9], 但关于黄芪总黄酮对脑缺血再灌注损伤影响的报道较少, 故本实验旨在探讨该成分对脑缺血再灌注损伤大鼠氧化应激、 炎症反应及凋亡的影响, 为其临床应用提供实验基础。
1 材料
1.1 动物 雄性健康SD 大鼠, SPF 级, 体质量180~220 g, 购于吉林大学实验动物中心, 动物生产许可证号SYXK (吉) 2016-0001, 定时喂食,饮水不限, 在清洁级动物室饲养。
1.2 试药 黄芪总黄酮购自上海源叶生物科技有限公司, 批号20170125, 含有量≥90.0%; 尼莫地平购自亚宝药业集团股份有限公司, 批号20161218。 丙二醛(MDA)、 谷胱甘肽过氧化物酶(GSH-Px)、 超氧化物岐化酶(SOD) 检测试剂盒购自南京建成生物工程研究所; 白细胞介素-1β(IL-1β)、 肿瘤坏死因子-α (TNF-α) 检测试剂盒购自美国R&D 公司; M-MLV 逆转录试剂盒购自美国Invitrogen 公司; 磷酸化-磷脂酰肌醇3 激酶(p-PI3K)、 磷酸化-蛋白激酶B (p-AKT) 多克隆抗体购自美国Santa Cruz 公司。
1.3 仪器 752 N 紫外-可见分光光度计(上海精科仪器公司); BG-XM496 酶标仪(常州三丰仪器公司); LightCycler©480 实时荧光定量PCR (瑞士罗氏公司); DYCZ-40 A 转移电泳仪(北京六一生物科技公司)。
2 方法
2.1 分组、 给药、 造模 将适应环境1 周后的大鼠随机分为假手术组、 模型组, 尼莫地平 (15 mg/kg) 组及黄芪总黄酮高(60 mg/kg)、 低剂量(30 mg/kg) 组, 造模前15 d 灌胃给药, 1 次/d。末次给药后, 按照Longa 等[10]报道的线栓法制备脑缺血模型, 于缺血2 h 后拔出线栓, 恢复血流供应, 进行24 h 再灌注。
2.2 神经行为学评分、 脑含水量检测 再灌注24 h 后, 各组随机选取8 只大鼠, 神经行为学评分采用Berderson 评分法[11]。 然后, 各组大鼠经戊巴比妥钠(60 mg/kg) 麻醉后断头取脑, 干湿重法测定脑组织含水量。
2.3 脑组织抗氧化活性、 炎症因子水平检测 再灌注24 h 后, 各组随机选取8 只大鼠, 经戊巴比妥钠(60 mg/kg) 麻醉后断头取脑, 取部分脑组织, 精密称定质量后, 加入10 倍量预冷生理盐水,匀浆后制备10%脑组织匀浆液, 4 ℃、 3 000 r/min离心5 min, 吸取上清液, 于-20 ℃冰箱中保存。按照试剂盒操作步骤, 分光光度法检测脑组织MDA 水平及GSH-Px、 SOD 活性, 放射免疫法检测IL-1β、 TNF-α 水平。
2.4 脑组织Bcl-2、 Bax、 caspase-3 mRNA 表达检测 取大鼠剩余脑组织, 液氮下反复研磨, Trizol法提取总RNA, 经M-MLV 逆转录试剂盒逆转录为cDNA。 在LightCycler©480 实时荧光定量仪中,SYBR 法检测脑组织凋亡相关基因caspase-3、 Bcl-2、 Bax mRNA 表达。 然后, 通过2-△△Ct法计算目的基因相对表达量, 以GAPDH 为内标, 所需引物由生工生物工程(上海) 股份有限公司合成, 引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.5 脑组织p-PI3K、 p-AKT 蛋白表达检测 取“2.3” 项下10%脑组织匀浆液, 考马斯亮蓝法测定总蛋白量, 12% SDS-PAGE 垂直板电泳后转至PVDF 膜, 脱脂奶粉封闭2 h, PBST 洗膜2 次(10 min/次), 4 ℃下将膜放入p-PI3K、 p-AKT 稀释液中(1 ∶1 000) 孵育12 h, PBST 洗膜后, 常温下将膜放入辣根过氧化物酶标记的二抗稀释液中(1 ∶500) 孵育2 h, PBST 洗膜后进行DAB 染色。拍照后, 通过图像处理软件进行分析, 以目的蛋白条带、 内标蛋白条带灰度值之比表示相对表达水平。
2.6 统计学分析 通过SPSS 17.0 软件进行处理,数据以表示, 2 组间比较采用LSD 法, 多组间比较采用单因素方差分析。 P<0.05 表示差异具有统计学意义。
3 结果
3.1 黄芪总黄酮对神经行为学评分、 脑组织含水量的影响 表2 显示, 与假手术组比较, 模型组神经行为学评分、 脑组织含水量显著升高 (P <0.05); 与模型组比较, 黄芪总黄酮组两者显著降低(P<0.05)。
表2 黄芪总黄酮对神经行为学评分及脑组织含水量的影响s, n=8)Tab.2 Effects of Astragali Radix total flavonoids on neurobehavioral score and water content in brain tissue ±s, n=8)
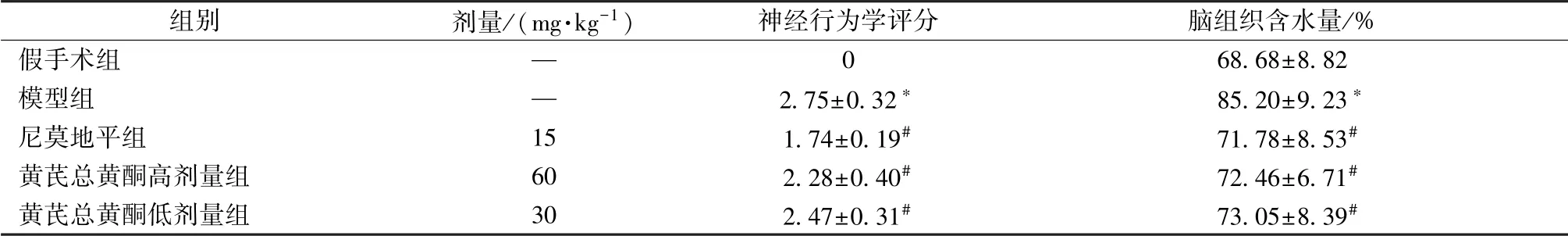
表2 黄芪总黄酮对神经行为学评分及脑组织含水量的影响s, n=8)Tab.2 Effects of Astragali Radix total flavonoids on neurobehavioral score and water content in brain tissue ±s, n=8)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
images/BZ_62_236_976_2244_1025.png假手术组 — 0 68.68±8.82模型组 — 2.75±0.32* 85.20±9.23*尼莫地平组 15 1.74±0.19# 71.78±8.53#黄芪总黄酮高剂量组 60 2.28±0.40# 72.46±6.71#黄芪总黄酮低剂量组 30 2.47±0.31# 73.05±8.39#
3.2 黄芪总黄酮对MDA 水平及GSH-Px、 SOD 活性的影响 表3 显示, 与假手术组比较, 模型组MDA 水平显著升高(P<0.05), GSH-Px、 SOD 活性显著降低(P<0.05); 与模型组比较, 黄芪总黄酮组MDA 水平显著降低 (P <0.05), GSH-Px、SOD 活性显著升高(P<0.05)。
表3 黄芪总黄酮MDA 水平及GSH-Px、 SOD 活性的影响±s, n=8)Tab.3 Effects of Astragali Radix total flavonoids on MDA level and GSH-Px, SOD activities (±s, n=8)

表3 黄芪总黄酮MDA 水平及GSH-Px、 SOD 活性的影响±s, n=8)Tab.3 Effects of Astragali Radix total flavonoids on MDA level and GSH-Px, SOD activities (±s, n=8)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
images/BZ_62_236_1670_2244_1720.png假手术组 — 11.15±1.28 95.61±10.30 224.95±26.26模型组 — 18.58±2.18* 41.33±5.47* 105.42±12.71*尼莫地平组 15 13.66±1.25# 76.79±8.66# 196.72±20.63#黄芪总黄酮高剂量组 60 14.36±1.37# 70.18±9.34# 190.85±22.38#黄芪总黄酮低剂量组 30 15.45±1.68# 58.67±7.85# 178.06±19.42#
3.3 黄芪总黄酮对IL-1β、 TNF-α 水平的影响 表4 显示, 与假手术组比较, 模型组IL-1β、 TNF-α水平显著升高(P<0.05); 与模型组比较, 黄芪总黄酮组两者水平显著降低(P<0.05)。
表4 黄芪总黄酮对IL-1β、 TNF-α 水平的影响(s, n=8)Tab.4 Effects of Astragali Radix total flavonoids on IL-1β and TNF-α levels , n=8)

表4 黄芪总黄酮对IL-1β、 TNF-α 水平的影响(s, n=8)Tab.4 Effects of Astragali Radix total flavonoids on IL-1β and TNF-α levels , n=8)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 剂量/(mg·kg-1)IL-1β/(pg·mg prot-1)TNF-α/(mg·mg prot-1)假手术组 — 27.04±3.49 126.55±14.15模型组 — 52.69±6.64* 218.70±25.52*尼莫地平组 15 34.28±3.62# 144.13±14.16#黄芪总黄酮高剂量组 60 36.76±4.95# 153.08±17.64#黄芪总黄酮低剂量组 30 39.44±4.87# 169.84±16.39#
3.4 黄芪总黄酮对caspase-3、 Bcl-2、 Bax mRNA表达的影响 表5 显示, 与假手术组比较, 模型组caspase-3、 Bax mRNA 表达显著升高(P <0.05),Bcl-2 mRNA 表达显著降低(P<0.05); 与模型组比较, 黄芪总黄酮组caspase-3、 Bax mRNA 表达显著降低 (P <0.05), Bcl-2 mRNA 表达显著升高(P<0.05)。
表5 黄芪总黄酮对caspase-3、 Bcl-2、 Bax mRNA 表达的影响(s, n=8)Tab.5 Effects of Astragali Radix total flavonoids on caspase-3, Bcl-2 and Bax mRNA expressions s, n=8)
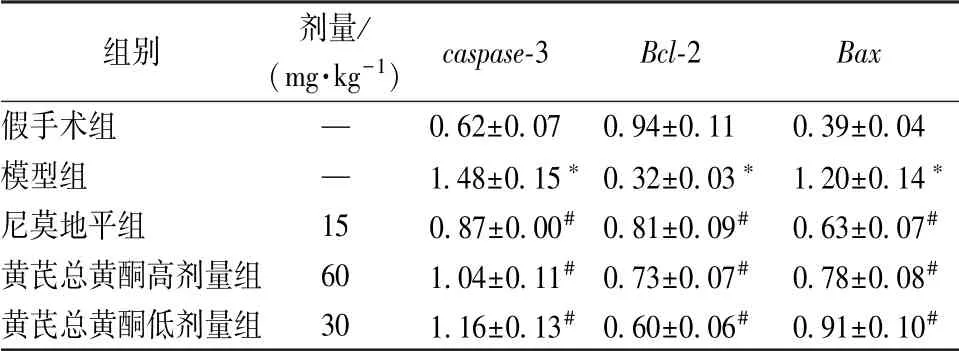
表5 黄芪总黄酮对caspase-3、 Bcl-2、 Bax mRNA 表达的影响(s, n=8)Tab.5 Effects of Astragali Radix total flavonoids on caspase-3, Bcl-2 and Bax mRNA expressions s, n=8)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 剂量/(mg·kg-1) caspase-3 Bcl-2 Bax假手术组 — 0.62±0.07 0.94±0.11 0.39±0.04模型组 — 1.48±0.15* 0.32±0.03* 1.20±0.14*尼莫地平组 15 0.87±0.00# 0.81±0.09# 0.63±0.07#黄芪总黄酮高剂量组 60 1.04±0.11# 0.73±0.07# 0.78±0.08#黄芪总黄酮低剂量组 30 1.16±0.13# 0.60±0.06# 0.91±0.10#
3.5 黄芪总黄酮对p-PI3K、 p-AKT 蛋白表达的影响 表6、 图1 显示, 与假手术组比较, 模型组p-PI3K、 p-AKT 蛋白表达显著降低(P<0.05); 与模型组比较, 黄芪总黄酮组两者蛋白表达显著升高(P<0.05)。
表6 黄芪总黄酮对p-PI3K、 p-AKT 蛋白表达的影响±s, n=8)Tab.6 Effects of Astragali Radix total flavonoids on p-PI3K and p-AKT protein expressions (,n=8)
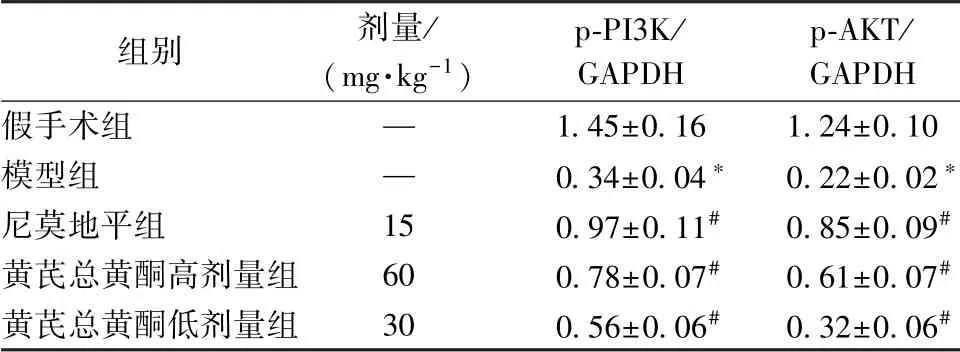
表6 黄芪总黄酮对p-PI3K、 p-AKT 蛋白表达的影响±s, n=8)Tab.6 Effects of Astragali Radix total flavonoids on p-PI3K and p-AKT protein expressions (,n=8)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
组别 剂量/(mg·kg-1)p-PI3K/GAPDH p-AKT/GAPDH假手术组 — 1.45±0.16 1.24±0.10模型组 — 0.34±0.04* 0.22±0.02*尼莫地平组 15 0.97±0.11# 0.85±0.09#黄芪总黄酮高剂量组 60 0.78±0.07# 0.61±0.07#黄芪总黄酮低剂量组 30 0.56±0.06# 0.32±0.06#

图1 各组p-PI3K、 p-AKT 蛋白表达Fig.1 p-PI3K and p-AKT protein expressions in various groups
4 讨论
由于局灶性脑缺血动物模型不需要开颅, 可极大减少颅内感染几率, 同时重复性较好, 故使用频率最高[12]。 本实验采用线栓法建立大鼠局灶性脑缺血再灌注损伤模型, 发现大鼠神经功能严重损伤, 脑组织含水量增加, 提示建模成功; 与模型组比较, 黄芪总黄酮组大鼠神经行为学评分、 脑组织含水量明显下降, 表明该成分对大鼠脑缺血再灌注损伤具有明显的保护作用。
氧化应激是脑缺血再灌注损伤的主要病理机制, 由于脑组织代谢旺盛、 需氧量高, 导致生成较多的ROS, 但脑组织自身缺少抗氧化物质, 更容易受到后者侵害[13], 而且它也会在中枢神经系统和代谢反应应激状态下产生, 直接损伤蛋白质、 脂质、 核酸等细胞内大分子, 导致细胞死亡[14];MDA 是脂质过氧化反应的终产物, 其水平高低可反映氧化应激程度; GSH-Px、 SOD 是体内最重要的抗氧化物酶, 可清除细胞中ROS, 具有保护细胞免受氧化损伤的作用[15]。 本实验发现, 模型组大鼠脑组织MDA 水平明显升高, 而GSH-Px、 SOD活性明显下降; 与模型组比较, 黄芪总黄酮组大鼠脑组织MDA 水平明显下降, 而GSH-Px、 SOD 活性明显升高, 表明该成分对大鼠脑缺血再灌注损伤的保护作用与抑制氧化应激水平有关。
炎症反应是存在于脑缺血再灌注损伤中的另一重要机制, 会导致毒性酶激活、 自由基超载等, 从而引起一系列组织病变。 在脑缺血状态下, 星形胶质细胞等炎性细胞会分泌大量IL-1β, 它是参与炎症级联扩大反应和脑缺血早期炎症反应的重要炎症因子[16]; TNF-α 是由巨噬细胞、 单核细胞分泌的一种促炎因子, 在脑缺血发生时炎性相关细胞被过度激活, 从而使其分泌增加, 进而刺激脑组织局部炎症反应, 加重脑损伤[17], 而且当IL-1β 被激活时会促进TNF-α 分泌, 同时两者又会增加其他炎症因子表达, 使脑损伤程度加重[18]。 本实验发现,模型组大鼠脑组织IL-1β、 TNF-α 水平明显升高;与模型组比较, 黄芪总黄酮组两者水平明显下降,表明该成分对大鼠脑缺血再灌注损伤的保护作用与减少炎症反应有关。
凋亡也是脑缺血再灌注损伤伴随的重要机制,在发生脑缺血时缺血中枢区周围的神经元死亡以凋亡为主[19]。 caspase 家族成员蛋白在线粒体依赖途径和非线粒体依赖途径的凋亡进程中均起着主导作用, 其中caspase-3 是用来检测细胞凋亡的重要指标之一[20]。 Bcl-2 家族分为抑凋亡蛋白和促凋亡蛋白, 在细胞凋亡进程中同样发挥着重要的调节作用, 当细胞处于脑缺血等应激状态时, 抑凋亡蛋白Bcl-2 表达降低, 而促凋亡蛋白Bax 表达增加[21]。本实验发现, 模型组大鼠脑组织caspase-3、 Bax mRNA 表达明显升高, 而Bcl-2 mRNA 表达明显下降; 与模型组比较, 黄芪总黄酮组前两者mRNA表达明显下降, 而后者mRNA 表达明显升高, 表明该成分对大鼠脑缺血再灌注损伤的保护作用与抗凋亡作用有关。
研究表明, PI3K/AKT 信号转导通路参与了脑缺血时神经细胞的凋亡进程, 其中AKT 既可促进caspase-3 等凋亡蛋白磷酸化, 使其失活, 也能促进抗凋亡基因(如Bcl-2) 转录和表达, 使细胞存活[22]。 本实验发现, 模型组大鼠脑组织p-PI3K、p-AKT 蛋白表达明显下降; 与模型组比较, 黄芪总黄酮组两者蛋白表达明显升高, 表明该成分对大鼠脑缺血再灌注损伤的保护作用与激活PI3K/AKT 信号通路引起的抗凋亡作用有关。
综上所述, 黄芪总黄酮对大鼠脑缺血再灌注损伤具有明显的保护作用, 其机制可能与抑制氧化应激水平、 减少炎症反应、 抗凋亡作用有关。
