单细胞RNA测序技术及其在皮肤病学研究中的应用
2019-08-25朱容慧李巍
朱容慧 李巍
复旦大学附属华山医院皮肤科,上海 200040
生命科学和临床医学的进展在一定程度上得益于新技术、新方法的进步。单细胞RNA测序技术能够在单细胞层面对基因表达水平进行分析,是研究皮肤生理功能和疾病状态的新手段。这一技术的应用有望从转录组水平重新定义多种皮肤疾病亚型,揭示新的发病机制,发现新的治疗靶点和开发新的治疗策略,具有非常重要的意义。目前单细胞RNA测序在皮肤病领域的应用刚刚开始,本文主要介绍单细胞RNA测序的原理、技术流程及其在皮肤病研究中的初步应用,为广大皮肤科临床和科研工作者了解并应用这一技术提供参考。
一、单细胞RNA测序技术简介
RNA 测序技术是检测细胞转录组的可靠方法,高通量RNA测序技术已经被广泛应用于生命科学领域的诸多研究当中,但普通RNA测序是在组织样本或细胞群水平上进行的,单个细胞之间的生物学差异可能被平均,或被误认为技术噪音而掩盖[1],为了克服这一缺陷,人们研发了单细胞RNA测序技术。该技术是在单细胞水平上对转录组进行测序,可揭示细胞间的变异和群体的异质性,特别适合发现罕见的细胞群体,为那些数量少的细胞群体如调节性T细胞、朗格汉斯细胞提供了有效的研究方法[2]。单细胞RNA测序技术在精准医学方面也有良好的应用前景,可以区分出对药物敏感的细胞和非敏感细胞,指导治疗的选择和药物的开发[3]。2013年这项技术被Nature Method杂志评选为年度技术,并在过去几年间在胚胎发育、癌症生物学和免疫学方面取得了一系列创新性成果[4]。
二、单细胞RNA测序的技术流程
单细胞RNA 测序技术与其他RNA 测序的基本原理相似,流程包括细胞制备、文库构建、测序和数据分析,见图1。其中单细胞制备和单细胞文库构建是最重要的环节,决定了数据质量、测序通量、精确度、灵敏度和可重复性[5]。
单细胞的分离制备技术目前主要有流式细胞分选术、免疫磁珠细胞分选技术、显微操作法、微流控技术、梯度稀释法、激光捕获显微切割技术等,比较常用的是前4种。
流式细胞分选技术[6]是对单细胞悬液预先用荧光标记细胞表面特异性分子,利用细胞结合的荧光标记或细胞本身的光散特性,高效、快捷地从大量细胞中分选出特定的细胞,适用于大样本中特定细胞类型的分选。但是,该技术对样本制备、仪器操作要求较高,而且这种方法对细胞机械损伤较大,需要尽快进行下一步操作。
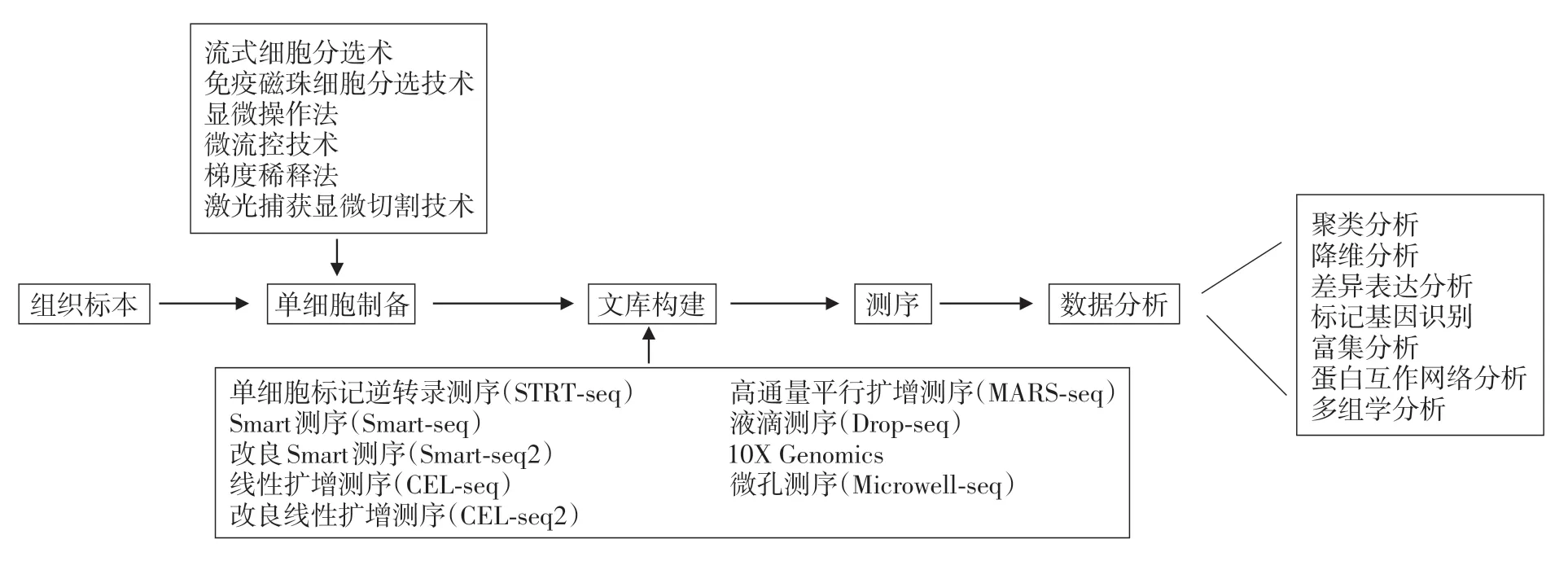
图1 单细胞转录组测序流程
磁珠分选[7]是预先对单细胞悬液中的细胞进行特异性磁性标记,经稳定磁场中的分选柱洗脱后筛选出标记细胞,对细胞刺激小,细胞活性高,技术操作简单。但是,分选纯度只在80%~90%之间,而且每次操作只能分为标记和未标记两群细胞,不能进行多参数的分群。
显微操作法[8]是在显微镜视野下直接对固体的组织进行单细胞分离,优点是可以进行可视化操作,耗材较低,适用于较小的细胞群体中目标细胞的分离。但是该技术操作难度因操作者和组织细胞而异,分离通量也较小。
微流控技术[9]是利用流控通道具备的功能,如通道可调节的直径(10~100 μm)和功能性修饰(如捕获分子、抗体、电极等),人为地控制液体流动来进行细胞分选,如C1™单细胞全自动制备系统,只需要将细胞样品加在C1™微流体芯片上,输入指令,该系统就会快速自动分离出96 或384个单细胞并分配到单个制备仓中,之后系统还会自动地裂解、逆转录、扩增、检测和分析细胞,在实现大通量的同时免除了繁重的加样和混合步骤,大大节约了实验时间,降低了操作带来的实验误差。但是该系统要求大量具有高度均一性的样本细胞,限制了对数量稀少或者异质性高的细胞的研究,而且设备昂贵,成本较高。
死细胞释放的游离RNA 会影响单细胞RNA 数据的质量,因此在制备单细胞时最重要的是保持细胞的活力。在选择方法时,主要是针对组织和细胞的性质选择对细胞损伤尽可能小的方式进行操作。除了方法本身对细胞可能带来的损伤外,移液、振荡、离心、细胞所处的温度和基质都会对细胞活力产生影响,所以应该综合考虑各种因素,选择对保持细胞活力最优的方案,尽可能提高数据的质量。
单细胞文库的构建方法早期主要分为两种:一种是将单细胞分离后置于96 孔板中进行反转录合成cDNA,然后加上PCR 扩增的接头和细胞识别条形码,转移到单个管中进行PCR扩增。基于这种方法的技术有单细胞标记逆转录测序(single-cell tagged reverse transcription sequencing,STRT-seq)[10]、Smart 测序技术(switching mechanism at 5′end of RNA template,Smart-seq)[11]、改良 Smart 测序技术(Smart-seq2)[12]等,这种方法覆盖度较好,但一次能测序的细胞数少,步骤繁琐。另一种方法是在反转录的引物上加上细胞条形码对单个细胞进行反转录,第二链合成后,将所有反应管的cDNA混合,利用体外转录进行线性扩增[13]。这种方法包括线性扩增测序(cell expression by linear amplification and sequencing,CEL-seq)[13]、改良线性扩增测序(CEL-seq2)[14]、高通量平行扩增测序(massively parallel single-cell RNA sequencing,MARS-seq)[15]等。但这两种方法都是利用96 孔板或384 孔板为操作平台,由于孔数的局限,限制了单细胞RNA测序规模的扩大。2015年哈佛医学院Steven McCarroll研究团队利用微流控技术开发液滴测序(Droplet sequencing ,Drop-seq),将带有条形码引物的微珠和细胞在油乳剂中压缩为一个液滴,在液滴中进行建库,由此检测数以千计的细胞[15-17]。这种技术可以大量无偏倚地挑选细胞进行测序,极大提高了实验的通量,同时也不需要细胞具有较高的均一性,但这种方法覆盖率比较低,在单个细胞中检测到的转录组只有其他方法的一半[18]。基于Dropseq,10X Genomics 公司和 Fred Hutch 的团队开发了一套新的技术并且商业化推广,可在6 min 内完成扩增测序,能够同时分析来自29 个不同样品的250 000 个单细胞,大大加速了单细胞转录组学研究[19]。2018年浙江大学Han等[20]研发微孔测序技术(Microwell-Seq),利用磁珠将细胞吸附在用琼脂构建的微孔阵列中,再加入条形码微珠进行测序,一次可以测序>400 000个单细胞,这种方法显著提升了测序通量,又保证了灵敏度,降低了测序成本。
三、单细胞RNA测序在皮肤病学研究领域的应用
目前在皮肤相关领域使用单细胞RNA 测序技术的研究较少。Joost等[21]首先利用这种技术研究了小鼠正常皮肤表皮的结构和组成,对小鼠毛囊间和毛囊的表皮细胞进行测序,得到1 422 个单细胞数据,根据细胞群标志性基因区分出25群不同种类的细胞,例如,将高表达Scd1/Mgst1的细胞划分为皮脂腺细胞,以Krt6a/Krt75、CD34/Postn 标记内、外根鞘角质形成细胞,分别用CD207 和CD3 标记朗格汉斯细胞和T细胞这两个免疫细胞群。研究者使用免疫组化和单分子荧光原位杂交技术分别从蛋白水平和组织水平验证细胞分群的存在,同时对细胞分群进行空间定位,将角质形成细胞从基因表达和空间位置上分为更详细的亚类。他们还进一步发现在不同空间位置的表皮干细胞有共同的基底-表皮基因表达模式。该研究显示了单细胞RNA 测序技术在识别皮肤角质形成细胞亚群上的强大能力。
Cheng等[22]利用单细胞RNA测序技术分析正常人体不同部位表皮角质形成细胞的基因特征以及银屑病皮损角质形成细胞基因表达的变化。该实验获取9 例正常人和3 例银屑病患者的头皮、躯干和包皮3个不同部位的皮肤组织,获得92 889 个单细胞数据。将这些数据混合分析后发现,将这些数据混合分析后发现,在转录组水平,不同解剖部位的角质形成细胞不仅在组织学上分为不同的亚群,也在细胞执行的功能上分为不同的亚群,比如执行细胞间信号传导功能的亚群、与炎症反应相关的亚群和与WNT信号通路调控有关的亚群。此外这项研究还进一步发现表皮在转录组水平上的一些炎性特征:①正常头皮部位角质形成细胞转录组中存在固有的炎症表达模式,即毛囊间角质形成细胞S100分子活化;②正常包皮的表皮免疫细胞中存在一群其他部位表皮中没有的IL1βhiCCL3hiCD14+巨噬细胞,提示在泌尿道表皮中有与这群细胞相关的特殊炎症反应;③银屑病患者皮损中有大量CD1C+CD301+的髓样树突细胞的富集。该研究在mRNA 水平展示了正常人包皮、头皮和躯干部位的表皮以及银屑病患者的表皮细胞基因表达状态,为进一步研究更深层次的相关问题,尤其是关于基底层角质形成细胞执行不同分化程序的能力以及免疫细胞向银屑病皮损部位的募集过程奠定了重要基础。
Kobayashi 等[23]对表皮、真皮和皮下组织的固有淋巴样细胞(innate lymphoid cells,ILC)进行单细胞RNA测序,分别得到3 431、3 356、1 061 个单细胞数据,发现ILC 在皮肤的这3 个部位有特异性的转录表达谱。其中,皮下组织处的ILC表现出ILC2的转录特征,在真皮和表皮的ILC又各分为两群,真皮部位的两群细胞可能分别执行不同的功能,而表皮的两群可能表现了两种不同的细胞激活状态。ILC 在不同部位的分群与上皮细胞分泌的细胞因子与趋化因子有关。这部分研究说明,不同组织部位的特有信号促进皮肤ILC 的增殖,诱导不同的基因表达。在此基础上,他们研究毛囊皮脂腺附近的RORgt+ILC,发现这群细胞可能参与毛囊-皮脂单位的调节。进一步研究发现,表皮ILC 可以通过抑制Notch信号通路限制皮脂腺细胞的生长,可能影响皮肤表面具有抗菌活性的游离脂肪酸的分泌,从而限制革兰阳性菌的共生。该研究通过单细胞RNA 测序为研究皮肤稀有的免疫细胞提供了技术可能,进一步探究了皮肤免疫细胞与皮脂腺、共生菌群的关系,为皮肤免疫细胞如何调节皮肤稳态提供了新的思路。
单细胞RNA 测序技术是研究肿瘤细胞异质性和肿瘤微环境组成的强有力工具,已在乳腺癌[24]、头颈部鳞状细胞癌[25]、神经胶质瘤[26]等疾病中得到了应用。Tirosh等[27]获取了19 例黑素瘤患者肿瘤组织中4 645 个单细胞测序数据,发现恶性肿瘤细胞的聚类显示了肿瘤细胞间与细胞周期、空间环境和耐药性相关的异质性;小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)基因簇高表达或AXL受体酪氨酸激酶(AXL)基因簇高表达的细胞群体受到特别关注,因为这两个基因簇的表达可能对黑素瘤细胞的存活和耐药性至关重要。该研究显示,所有的肿瘤细胞都可以分为MITF 高表达和MITF 低表达/AXL 高表达的两个群,同时在MITF高表达群中发现了AXL高表达的黑素瘤细胞亚群。研究者同时对肿瘤内的非恶性细胞进行聚类分析,解析了肿瘤微环境,发现在肿瘤微环境中存在多种T细胞抑制性受体基因的表达,如程序性死亡分子1、T细胞免疫球蛋白与免疫受体酪氨酸抑制分子、T细胞免疫球蛋白黏蛋白分子3、淋巴细胞活化分子3和细胞毒性T细胞相关蛋白4等,抑制性受体基因的表达和T细胞活化状态高度相关,提示黑素瘤中存在共刺激分子激活的T 细胞衰竭机制,可以作为免疫治疗的靶点。该研究结果对黑素瘤的分型和肿瘤的精准治疗具有重要的指导意义,而这些结果无法通过普通高通量RNA测序得到,证明单细胞RNA测序在研究肿瘤亚群和肿瘤微环境中具有无可比拟的作用。
四、研究前景展望
对于正常皮肤,利用单细胞RNA测序技术可能会发现生理状态下以前未定义的皮肤细胞亚群,包括角质形成细胞、成纤维细胞、树突细胞和T 细胞等,这些新亚群可能在维护皮肤稳态、发挥其屏障功能中起到不同的作用,通过这些发现从而获得对皮肤生物学功能更全面的理解。对于炎症性和自身免疫性皮肤病,如银屑病、特应性皮炎、白癜风、红斑狼疮和大疱性皮肤病等,通过单细胞RNA测序可能会找到在发病过程中起关键作用的靶细胞,发现与疾病发展相关的新的免疫细胞亚群,包括自身反应性T细胞或B细胞等,从而能更准确地定义疾病的特征,对疾病状态有更精准的分型;对于关键的免疫细胞,还可以捕捉不同分化阶段的细胞进行单细胞RNA测序分析,重建细胞“decision making”的关键点和生长分化的过程,从而了解从健康向疾病转换过程中免疫细胞如何分化,如T细胞向辅助性T细胞、细胞毒性T细胞或调节性T细胞分化。对于皮肤肿瘤,如鳞状细胞癌、基底细胞癌、皮肤T 细胞淋巴瘤和黑素瘤,单细胞RNA测序将帮助我们识别新的皮肤肿瘤亚型和肿瘤浸润细胞,为新的肿瘤免疫治疗靶点提供线索。此外,在全长单细胞RNA测序数据中,还可以读到成对或全长的T细胞受体/B细胞受体序列[28],将计算机重建的T细胞受体或B细胞受体信息与转录组数据结合,可以确定与皮肤肿瘤和自身免疫性疾病相关的肿瘤特异性抗原和自身抗原。利用单细胞RNA 测序揭示疾病的发病机制,最重要的是可以为皮肤疾病的治疗提供新方案,如根据肿瘤特异性抗原或自身抗原开发嵌合抗体;通过识别对药物敏感的细胞亚群的特征设计更敏感的靶向药物;针对疾病的不同亚型采取对应的治疗方案等。
然而目前单细胞转录组测序技术还存在一些问题,除了通量和成本的限制,数据处理也是一个挑战,例如如何用复杂的转录组数据判断单个细胞的类型、定义不同的细胞亚群,怎样挖掘出细胞群体与功能相关的转录组特征,从而在分子水平给细胞群体的生物学功能做出更完整的描述。随着单细胞研究浪潮的来临,未来单细胞测序领域会得到极速的发展,相信更多的局限也将被突破。
利益冲突所有作者均声明不存在利益冲突
