俯卧位通气联合小肠造瘘喂养在食管癌术后合并重度急性呼吸窘迫综合征患者中的应用▲
2019-08-24赖军华漆奋强陈德伦袁天柱黄世峰
赖军华 漆奋强 陈德伦 刘 欢 袁天柱 黄世峰
(广西医科大学第四附属医院暨柳州市工人医院西院重症医学科,柳州市 545007,电子邮箱:376703653@qq.com)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发生多见于创伤、出血、手术、感染、休克或烧伤等。食管癌手术是胸科高风险手术,术后易并发出血、感染、呼吸系统等并发症,随着手术技术和术后管理水平的提高相关并发症的发生率呈下降趋势,但呼吸系统并发症仍是导致食管癌术后患者死亡及影响患者预后的最主要因素[1]。以往食管癌术后常采用鼻肠管管饲提供营养支持,但其应用具有一定的局限性。2017年2月至2018年5月我院对食管癌术后并发重度ARDS患者给予俯卧位通气联合小肠造瘘喂养,取得较好效果,现报告如下。
1 资料与方法
1.1 临床资料 选取2017年2月至2018年5月在我院行食管癌手术,术后并发重度ARDS患者64例为研究对象。纳入标准:(1)均经病理检查确诊为食管癌;行食管癌切除术加食管胃胸腔内吻合术。(2)术后并发重度ARDS,符合重度ARDS诊断标准[2]。(3)耐受空肠造瘘置管。(4)无其他并发症。排除标准:(1)年龄小于18岁。(2)有俯卧位通气禁忌证者。按随机数字表法将患者分为两组,每组32例,观察组男17例,女15例,年龄41.2~79.6(58.46±3.52)岁;对照组男12例,女20例,年龄41.8~79.4(58.26±3.41)岁。两组患者性别、年龄、术式、病情等资料比较,差异无统计学意义(P>0.05),具有可比性。本研究获伦理委员会批准,患者家属均签署知情同意书。
1.2 方法
1.2.1 观察组:(1)俯卧位机械通气方法。术前充分清理患者呼吸道分泌物,有肠内营养患者需停止鼻饲1 h。由7名专业医护人员共同为患者取俯卧位, 1名医生站在患者头侧,统一指挥,注意观察患者,避免气管插管及中心静脉管路脱出;患者身体左右两侧各站3名医护人员,动作缓慢地将患者肩、腰、臀及腿部轻轻翻转至俯卧位,头部下垫凹形枕或马蹄形枕,使颜面部悬空或头偏向一侧;双肩、胸部、骨盆、膝部下垫软枕,使腹部悬空,防止腹主动脉受压,影响静脉回流,两侧手臂向上伸直放于头两侧。俯卧位时必须保证气管导管、呼吸机管道、静脉导管及其他引流管等通畅。采用深圳迈瑞生物医疗公司生产的E3型号迈瑞呼吸机。机械通气模式采用同步间歇指令通气模式。(2)小肠造瘘喂养。在腹部开一小切口,在距屈氏韧带30 cm处空肠放置营养管,经腹壁引出。术后给予富含ω-3多不饱和脂肪酸的免疫增强型肠内营养制剂:肠内营养乳剂( 瑞能, 华瑞制药有限公司, 200 mL/瓶,每100 mL提供能量546 kCal),按15 kCal/(kg·d)能量,或200 mL/d,用生理盐水以1 ∶2稀释营养制剂后以20~100 mL/h的速度滴注。
1.2.2 对照组:(1)机械通气方法。患者平卧位或者半坐卧位,呼吸机采用深圳迈瑞生物医疗公司生产的E3型号迈瑞呼吸机。机械通气模式采用同步间歇指令通气模式。(2)营养支持方法。使用肠外营养方法,营养配方为复方氨基酸500 mL,10%葡萄糖1 000 mL,中长链脂肪乳200 mL,脂溶性维生素,多种微量元素,按15 kCal/(kg·d)能量,维持24 h缓慢静脉滴入。
1.3 观察指标 (1)观察两组患者机械通气开始时、机械通气24 h、机械通气72 h时血清肿瘤坏死因子α(tumor necrosis factor α,TNF-α)水平、白细胞介素6(interleukin 6,IL-6)水平及Murray急性肺损伤评分[4]。采用酶联免疫法检测TNF-α及IL-6水平(试剂盒均购自Invitrogen公司,批号分别为:BMS213HS、BMS223HS)。(2)观察两组患者脱离呼吸机时间、血气分析指标、住ICU时间及急性生理学和慢性健康状态评估Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHEⅡ)评分[4]。(3)治疗1个月后存活率。
1.4 统计学分析 采用SPSS 21.0统计学软件进行统计学分析。计量资料以(x±s)表示,组内治疗前后比较采用配对t检验,重复测量资料比较采用重复测量资料的方差分析;计数资料以例数(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者机械通气不同时点血清TNF-α、IL-6水平比较 两组患者血清TNF-α、IL-6水平均有随观察时间的延长而下降趋势(F时间=1016.103、F时间=1 086.168,均P时间<0.001),治疗后各时间点观察组血清TNF-α、IL-6水平低于对照组(F组间=48.643、F组间=104.894,均P组间<0.001),时间与分组均有交互效应(F交互=19.005、F交互=18.128,均P交互<0.001),见表1。

表1 两组患者机械通气不同时点TNF-α、IL-6水平比较(x±s,pg/mL)
2.2 两组患者机械通气不同时点急性肺损伤Murray评分比较 两组Murray评分均有随观察时间延长而下降趋势(F时间=408.774,P时间<0.001),观察组治疗后各时点Murray评分低于对照组(F组间=106.989,P组间<0.001),时间与分组有交互效应(F交互=41.315,P交互<0.001),见表2。
2.3 两组患者脱机时间、ICU停留时间、APACHEⅡ评分比较 观察组患者脱机时间长于对照组,ICU停留时间短于对照组(P<0.05);治疗后,两组患者APACHEⅡ评分均低于治疗前,并且观察组评分低于对照组(P<0.05),见表3。

表2 两组患者机械通气不同时点Murray评分比较(x±s,分)
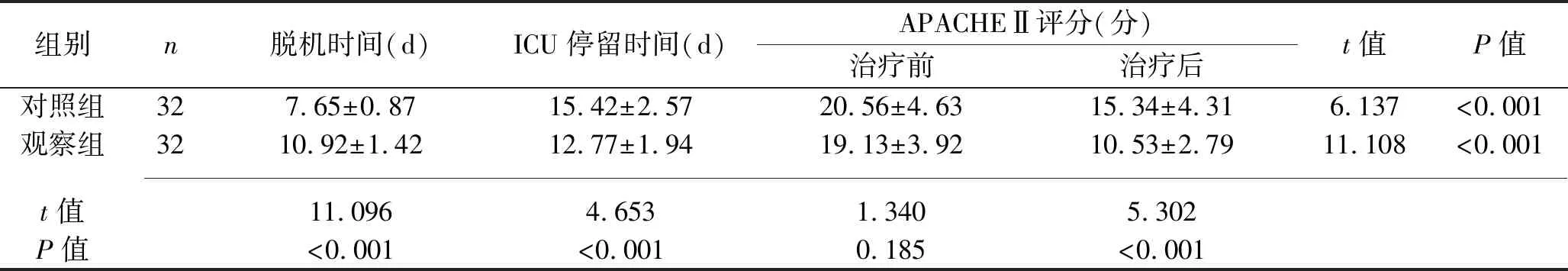
表3 两组患者脱机时间、ICU停留时间、APACHEⅡ评分比较(x±s)
2.4 两组机械通气前后不同时点血气分析指标比较 两组患者PaO2/吸入氧气分数( fraction of inspired oxygen,FiO2)、pH、FiO2值均有时间变化而升高的趋势(F时间=697.536、F时间=242.271、F时间=674.778,均P时间<0.001),机械通气1 h、24 h、72 h时,两组PaO2/FiO2、pH、FiO2均明显高于机械通气前,且观察组均高于对照组(F组间=571.174、F组间=36.615、F组间=357.975,均P组间<0.001);PaO2/FiO2、FiO2时间与分组有交互效应(F交互=55.020、F交互=111.198,均P交互<0.001),pH值时间与分组无交互效应(F交互=1.568,P交互=0.217)。两组吸入二氧化碳分数(fraction of inspired carbon dioxide,FiCO2)均有随时间变化而下降的趋势(F时间=167.965,P时间<0.001),机械通气1 h、24 h、72 h时两组FiCO2均低于机械通气前,且观察组低于对照组(F组间=78.771,P组间<0.001),时间与分组有交互效应(F交互=16.798,P交互<0.001),见表4。
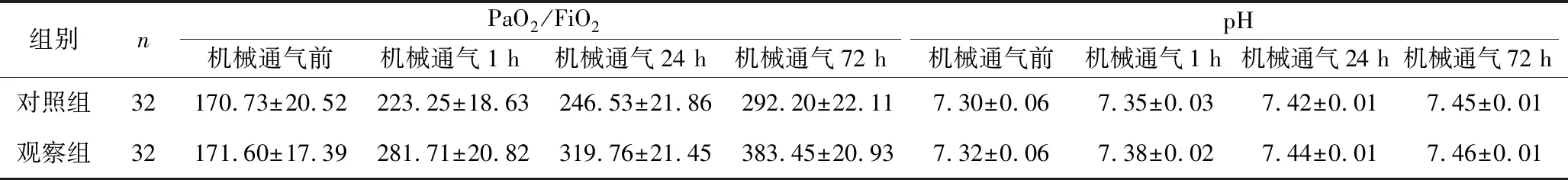
表4 两组患者机械通气前后不同时点血气分析指标比较(x±s)

组别nFiO2机械通气前机械通气1 h机械通气24 h机械通气72 hFiCO2机械通气前机械通气1 h机械通气24 h机械通气72 h对照组3251.37±2.3355.79±2.5962.84±3.9465.91±3.5558.29±4.3952.79±5.8649.39±3.4546.98±3.95观察组3251.69±2.5662.73±4.4873.87±4.3487.36±4.1559.16±4.9445.06±3.8643.47±3.3638.11±4.97
2.5 两组患者存活率对比 治疗1个月后,观察组患者存活率为78.13%(25/32),高于对照组的53.13%(17/32)(χ2=4.433,P=0.035)。
3 讨 论
急性肺损伤/ARDS是食管癌术后最严重的并发症之一,也是患者死亡的原因之一[5]。食管癌术后发生ARDS的原因可能是:(1)手术创伤。手术致胸壁肌肉和膈肌受损伤,导致胸顺应性下降,呼吸功增加,肺活量下降,肺泡通气灌注比(V/Q)下降,动脉血氧分压下降。(2)术中肺挫伤。食管癌手术,尤其是施行弓上及颈部吻合者,手术时间较长,术中多须压陷左肺,导致肺泡壁及毛细血管壁通透性增加、肺水肿,从而引起肺有效弥散面积减少,导致低氧血症。(3)术后胸腔积液、肺不张。造成肺限制性通气不足,肺内右向左分流增加,使肺泡通气灌注比下降,导致低氧血症。(4)术后呼吸道感染。术后由于各种原因导致肺部分泌物大量增加,而患者又不能及时咯出,容易导致感染,同时,肺部有效弥散面积减少,通气血流比下降,引起低氧血症[6]。(5)术后补液不当。术后若输液量过多,并且输入速度过快,极易引起肺水肿、肺功能受损、心功能衰竭,致低氧血症。(6)麻醉控制不当。手术麻醉时若插管不当可引起喉头水肿,或麻醉过深影响拔管后呼吸肌的功能恢复,导致功能残气量减少,气道闭塞,肺泡通气灌注比失调及肺不张等,导致低氧血症。(7)术后营养不良。因术后禁食,如营养素补充不足,则影响全身器官功能,影响正常气体交换,导致肺泡通气灌注比失调。
食管癌术后并发ARDS是患者死亡的原因之一。ARDS是肺毛细血管弥漫性损伤和通透性增加造成弥漫性肺间质及肺泡水肿,进而导致顽固性低氧血症,并且患者有呼吸窘迫的临床综合征。改善患者肺氧合功能、纠正顽固性低氧血症是治疗ARDS的主要目标[5]。因此治疗的重点是提高氧的输送和摄取,确保组织细胞氧供[7]。本研究结果显示,两组患者机械通气1 h、24 h、72 h时,PaO2/FiO2、pH、FiO2值均高于机械通气前,FiCO2均低于机械通气前,并且观察组各时点PaO2/FiO2、pH、FiO2值均高于对照组,FiCO2均低于对照组(均P<0.05),提示俯卧位通气联合小肠造瘘喂养治疗能更好地改善患者的呼吸功能,改善氧合。其机制可能是:(1)肺内通气分布更加均匀。生理情况下,因肺本身的重量,造成肺底部或较低部位肺组织的负压变小,该部分肺组织的顺应性较大,按常规体位进行机械通气时,更多的气体会分布到这个部分,而俯卧位通气时,已经实变的肺组织被压至上方,因为重力等的作用,机械通气时可以使实变的肺组织慢慢重新张开,改善该部分肺组织的通气,气体分布更加均匀,从而更好地纠正低氧血症,使肺内气体重新分布[8]。(2)改善膈肌运动。患者取俯卧位时,背侧膈肌对肺底压力减小,使实变的肺底组织复张,更好改善该部位肺组织的氧合。(3)减轻心脏对肺的压力。取俯卧位后,心脏对肺的压力转移到胸骨上,减轻该部分肺的压力,从而改善肺组织的顺应性以及通气功能。(4)功能残气量增加。俯卧位使患者的胸廓和腹部的呼吸运动更加协调,幅度增加,同时重力依赖区塌陷的肺泡重新开放,使功能残气量升高,低氧血症得到纠正[9]。(5)V/Q的改善和分流减少。俯卧位通气能够改善肺内通气,改善V/Q,进而纠正低氧血症。
食管癌术后患者容易出现营养不良,必须加强营养支持治疗。本研究结果显示,两组患者血清TNF-α、IL-6水平、Murray急性肺损伤评分均有随观察时间的延长而下降趋势,并且观察组上述指标水平均低于对照组(均P<0.05),APACHEⅡ评分低于对照组,存活率高于对照组(P<0.05),表明俯卧位通气联合小肠造瘘肠内营养治疗可减轻炎症反应,降低肺损伤程度,改善患者预后。小肠造瘘肠内营养的优势:肠内营养可维持肠黏膜细胞的正常结构和功能,比肠外营养更符合人体生理特点。肠内营养物质可经门静脉系统吸收,有利于消化道合成蛋白质,调节代谢,对肝肾功能具有保护作用。此外,肠内营养可以维持患者的肠道屏障功能,减少细菌易位对减轻患者炎症反应具有重要作用[10]。有研究发现,常规的肠内营养制剂对消化道肿瘤术后患者免疫功能的改善效果并不理想[11]。本研究肠内营养制剂是采用华瑞制药有限公司生产的瑞能肠内营养乳剂,该制剂高蛋白、高能量、富含ω-3多不饱和脂肪酸,而ω-3多不饱和脂肪酸是细胞膜的主要成分之一,可抑制过度炎症反应,降低免疫系统的损伤[12],不仅能为患者提供充足营养,改善患者营养状态,还能减少肿瘤组织的能量供应,抑制肿瘤细胞生长,从而促进机体蛋白合成,增强细胞免疫功能,更符合恶性肿瘤患者的代谢特点。同时,ω-3多不饱和脂肪酸可通过置换细胞膜磷脂中的花生四烯酸,减少花生四烯酸代谢产物的生成;通过与花生四烯酸竞争脂过氧化酶,抑制磷脂酶活性,减少白三烯B4、前列腺素E2等炎症介质的生成,发挥抗炎和免疫调节作用,还可通过改变信号传导过程,抑制黏附分子的表达来调节免疫功能[13]。
综上所述,俯卧位通气联合小肠造瘘肠内营养治疗食管癌术后并发重度急性ARDS患者能更好地改善患者氧合功能,降低肺损伤程度,减轻炎症反应,改善患者预后,值得临床推广应用。
