miR-1调控靶基因HCN4在风湿性心脏病心房颤动中的作用
2019-08-24付勇毛亮李妙龄于风旭李新廖斌邓明彬
付勇 毛亮 李妙龄 于风旭 李新 廖斌 邓明彬
1西南医科大学附属医院心脏大血管外科(四川泸洲646000);2西南医科大学心血管医学研究所(四川泸洲646000)
心房颤动(atrial fibrillation,AF)是临床十分常见的一种室上性快速性心律失常,其表现为不协调的电活动导致心房收缩功能降低[1]。与窦性心律的人群相比较,心房颤动人群发生中风危险增加,随着年龄增长中风发病率明显增高,50岁卒中风险为7.2%~10.2%,70岁以上卒中风险为15.4%~19.1%[2]。大约30%的AF患者中风后在1年内死亡,高达30%的幸存者永久性残疾[3]。风湿性心脏病(rheumatic heart disease,RHD)患者进行药物、手术等治疗,其房颤仍不能得到彻底治愈。对于其预防和治疗,至今未有确切有效的方法和措施;AF发生的确切机制至今仍未明了。近年来,miRNA在房颤的发生中研究较多,学者认为miRNA不仅在于心脏损伤的标志,同时也可能参与AF的电-机械反应。miRNA是否通过其靶基因改变心肌细胞的电生理特性导致AF的发生。为了证明这一假说,笔者通过研究miR-1及其靶基因HCN4在风心病房颤中表达改变特点,探讨AF可能的发生机制。
已有研究[4-5]表明miRNA可能参与心房颤动的发生。本文拟通过检测心肌组织miR-1表达及其参与调控靶基因HCN4(hyperpolarization activated and cyclic nucleotide gate cation channel-4,HCN-4)可能的关系,探讨其与心房颤动发生的可能关系。
1 资料与方法
1.1 一般资料收集我院临床诊断为RHD(简称风心病)行体外循环下瓣膜置换术患者36例。根据患者心脏节律不同分为心房颤动组(AF组,n=18)和窦性心律组(SR组,n=18),年龄分别为(47.20±8.81)岁和(44.40±14.41)岁。收集入选患者的术前临床资料:一般资料、心电图、超声心动图等。入选病例均除外合并慢性肺源性心脏病、甲状腺功能亢进征、高血压病、冠心病、病窦综合征、心肌病、肾脏疾病、胺碘酮治疗和二次接受心脏手术的患者。该实验得到西南医科大学附属医院伦理委员会同意。右心耳实验取材参照文献报道[6]。
1.2 方法
1.2.1 实验材料仪器:膜片钳放大器(美国),离心机(湖南),分光光度仪(上海欣茂),垂直板电泳转移装置(上海天能),电泳仪(北京君意),多用脱色摇床(苏州捷美),切片机(德国Leica),展片机(德国Leica),荧光定量PCR仪(加拿大),液氮罐(四川),灭菌锅(上海),烘箱(上海一恒),高速离心机(上海安亭),移液器(芬兰)。
试剂:蛋白裂解液(北京普利莱)、5×SDS上样缓冲液(上海生工)、PVDF膜(Millipore公司,美国)、预染蛋白marker(Fermentas公司,加拿大)、anti-HCN4(Millipore公司,美国)、HRP二抗(Western Biotechnology)、内参一抗(Western Biotechnology)、二抗(Dako公司,丹麦)、DAB(Sigma公司,美国)、引物(Western Biotechnology),DEPC(Sigma公司,美国)。
1.2.2 miR-1/HCN4基因表达检测方法TRIzol法抽提总RNA,紫外分光光度计测量OD260/OD280均在1.8~2.0之间,记录总RNA浓度;反转录反应体系的配制(总体积20 μL),逆转录;引物设计、荧光定量PCR反应体系的配制(总体积50 μL),每一样品重复操作3次,检测结果取均值,荧光定量PCR的操作步骤详见文献报道[7]。引物序列见表1。

表1 基因引物序列Tab.1 Primer sequences gene
1.2.3 免疫组化免疫组织化学SP法染色。常规脱蜡至水,抗原修复,室温下封闭,HCN4单克隆抗体(1∶200),4℃孵育过夜。PBS液充分洗涤后,加生物素化山羊抗兔IgG抗体(1∶200)孵育30 min,加辣根过氧化物酶标记的链霉素卵白素工作液(1∶200)孵育30 min,PBS液充分洗涤后,DAB 显色,阳性表达呈棕褐色。具体方法参见文献[8]。
1.2.4 HCN4蛋白表达每100 mg组织加入1 mL RIPA裂解液裂解组织块,提取蛋白。SDS-PAGE电泳灌胶与上样,加足够的电泳液后按等量蛋白上样,电泳、转膜,用封闭液将对应的一抗稀释,将膜与一抗温育1.5 h或4℃孵育过夜,用封闭液将二抗稀释成一定的浓度(1∶5 000),然后与膜孵育1.5 h。显色、曝光,对胶片进行扫描,然后用UVP凝胶图象处理系统Labworks 4.6软件分析目的条带的灰度值。
1.2.5 膜片钳检测起搏电流(If)全细胞膜片钳技术及记录:取心房肌组织,急性酶分离后放入保护液中保存,实验前将心肌细胞悬液加入浴槽中并加浴液至1 mL,在显微镜下选择形态好,折光性好的细胞进行实验。将灌有电极液的微管电极置于电极夹持器上,给予电极内一定正压,用微电极操纵器控制微管电极浸入浴液,发放振幅5 mV,波宽150 ms的矩形脉冲作为参考脉冲。操纵微推进器使电极尖端贴附在细胞表面,加负压(10~20 cm H2O柱)即可见应答电流下降为零,表明高阻封接形成(阻抗高达1 GΩ以上)。封接形成后,进行快电容补偿。夹闭水柱,用1 mL注射器对细胞施加一短促的负压抽吸破膜,即可形成全细胞膜片(whole-cell patch)。使保持电位-30 mV,钳制电压从-150~-40 mV,阶跃-10 mV,持续2 s进行HCN4通道If电流的记录。然后加入终浓度为4 mmol/L的CsCl阻断HCN4通道,用以上方案记录阻断后电流。
1.3 统计学方法用SPSS 17.0统计软件对数据进行统计,数据均采用表示;两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-1表达miR-1相对表达量,结果显示AF组miR-1基因表达小于SR组[(0.005 0±0.000 7)vs.(0.009 4 ± 0.002 5),P< 0.05]。见图1。
2.2 HCN4表达HCN4基因表达水平AF组高于SR组[(0.255 2 ± 0.019 4)vs.(0.159 2 ± 0.013 1),P<0.05]。见图2。

图1 右心耳miR-1 SR组和AF组表达水平比较Fig.1 Mean values of miR-1 and in right atrial appendage from sinus rhythm patients and atrial fibrillation patients
2.3 免疫组化AF组和SR组均存在HCN4蛋白表达,从组织棕褐色颗粒着色情况,AF组明显多于SR组。见图3。
2.4 HCN4蛋白表达HCN4蛋白表达水平AF组高于SR组[(1.1702±0.05598)vs.(0.3606±0.017 78),P<0.05]。见图4。

图3 HCN4蛋白表达(SP×400)Fig.3 HCN4 protein expression in sinus rhythm group and atrial fibrillation group

图4 SR组、AF组HCN4蛋白表达,HCN4(150 kDa),GAPDH(36 kDa)Fig.4 HCN4 protein expressionin right atrial appendag from sinus rhythm patients and atrial fibrillation patients HCN4(150 kDa),GAPDH(36 kDa)
2.4 If电流改变经全细胞膜片钳技术进行If电流的记录,右心耳心肌细胞起搏电流改变,从I-V曲线可见,If电流的幅值随着刺激电位的增加,其电流密度逐渐增大,并且AF组If增加更为明显,见图5。稳态激活曲线显示,AF组半稳态激活电压(V1/2)为(-88±5.9)mV,稳态激活曲线斜率(K)为(8.2±1.8);SR组V1/2为(-97±4.5)mV,K为(11.4±2.6)。见图5。
3 讨论
miRNAs是指长度为21~25个核苷酸的内源性非编码小分子RNA,其在转录后调节在植物和动物的基因表达,调控约30%的蛋白编码基因。目前研究发现miRNA与多种心血管疾病相关,其中研究较多的如 miRNA-1、miRNA-133、miRNA-208、miRNA-146a、miRNA-150、miRNA-19a 和 miRNA-375等参与心房颤动的发生和异常电活动的维持,这些miRNAs在不同环节参与心房的结构重构和电重构,从而在房颤的发生与维持中发挥重要作用[4,9-10]。
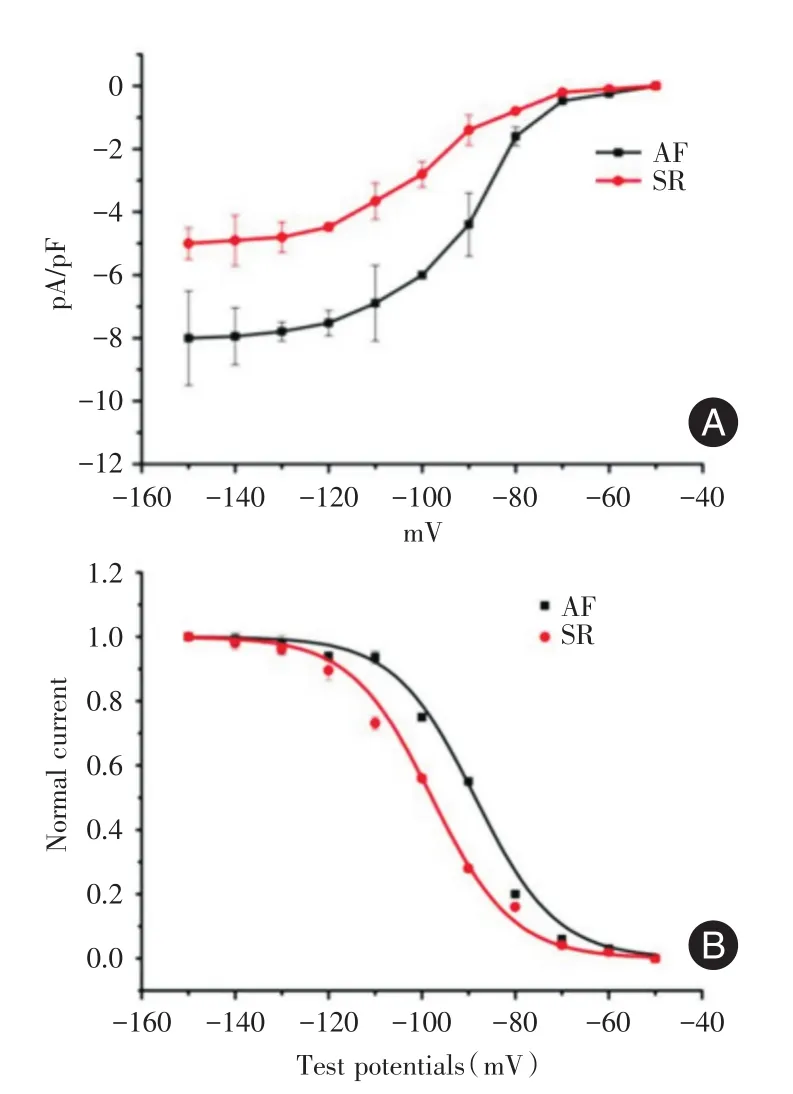
图5 右心耳心肌细胞电流-电压曲线和心肌细胞稳态激活曲线Fig.5 The myocardial cell current-voltage curve and steadystate activation curve in right atrial appendage
LI等[11]对冠状动脉旁路移植术的患者进行基因和蛋白检测,在高龄AF组中,检测到microRNA-133和microRNA-1表达较对照组下调,发现HCN2和HCN4基因、蛋白表达水平较对照组升高,认为HCN通道被microRNA调控,microRNA-133、microRNA-1抑制HCN2、HCN4基因表达。
miR-1与靶基因HCN4mRNA的3′UTR区不完全互补结合,通过抑制HCN4 mRNA编码蛋白质的翻译过程来调控基因表达,可能miR-1抑制了HCN4的表达。通过检测右心耳组织miR-1基因在风心病房颤患者中表达下调,可能通过miR-1与HCN4RNA诱导形成沉默复合体减少,对HCN4 mRNA表达的抑制减弱,在房颤患者中右心耳组织HCN4基因过表达。HCN4基因表达与其蛋白表达相关,在风心病房颤患者中右心耳组织HCN4蛋白检测表达水平高于窦性心律患者。
窦房结正常起搏电活动依赖窦房结细胞Ⅳ期自动去极化,正常情况下窦房结起搏频率高于心房搏动频率,心房异位节律被压制,表现为窦性心律。DIFRANCESCO[12]认为窦房结组织中 HCN4是具有起搏功能的标志基因,在对兔的研究中发现HCN4的表达水平与If电流密度密切相关,心肌肥厚或心功能衰竭中HCN4表达上调[13],心房颤动患者中也存在HCN4表达上调[14],可能导致If电流改变,心房异位自发起搏的发生,其频率高于窦房结频率,可能窦房结超速压抑失控,表现为心房颤动[15];通过检测风湿性心脏病患者右心耳组织HCN4基因表达,结果表明AF组HCN4基因表达较SR组高,HCN4基因在房颤患者心房肌的异常增高表达,可能改变其主导的K+、Na+混合通道If电流的改变[16],参与心房肌细胞舒张期兴奋性的提高,导致心房肌易激惹。通过检测If电流半稳态激活电压,房颤时激活曲线右移,表明房颤在较低的电压水平就可以达到半激活电流,更易于激活自发电流发生,影响起搏节律的稳定性[7];在风心病房颤患者中miR-1表达下调,可能通过调控HCN4表达增高,心房肌细胞兴奋性的提高,导致心房肌易激惹,参与风心病房颤的发生。
