长链非编码RNA AL451105.2对前列腺癌细胞增殖和侵袭的影响
2019-08-24程树林蔡涛周文浩陈双全朱平宇
程树林 蔡涛 周文浩 陈双全 朱平宇
川北医学院附属医院泌尿外科(四川南充 637000)
前列腺癌是男性泌尿生殖系统最常见的肿瘤之一,对男性健康和生命产生严重威胁[1]。前列腺癌的发病机制尚不明确,研究前列腺癌的发生发展机制具有重要临床意义。长链非编码RNA(lncRNA)是一类长度大于200个核苷酸的转录本,最初被认为不具有生物学功能,是基因组转录产生的“噪音”[2]。伴随lncRNA研究领域的拓展,lncRNA被发现参与调控转录激活、基因组印迹、X染色体沉默等众多生物调控[3]。近年的研究表明,大量lncRNA在肿瘤中表达异常,与肿瘤的诊断、治疗效应、预后等密切相关[4]。AL451105.2是一种新发现的lncRNA,其在疾病尤其是前列腺癌中的功能仍不清楚。本研究旨在检测AL451105.2在前列腺癌组织和细胞中的表达,通过构建转染AL451105.2质粒至前列腺癌细胞,观察AL451105.2对前列腺癌细胞增殖和侵袭的影响,进一步探讨AL451105.2可能的分子作用机制。
1 材料与方法
1.1 材料16例前列腺癌组织标本来源于2017年3月至2018年7月川北医学院附属医院泌尿外科手术切除标本,均经病理学确诊为前列腺癌。前列腺癌患者术前均未接受过放化疗。患者均签署本院伦理委员会批准的知情同意书。KSFM培养基、RPMI-1640培养基和胎牛血清(FBS)购自美国Gibco公司。前列腺癌细胞株(22RV1、C4-2B、PC-3、DU-145、LNCap)和正常前列腺上皮细胞(RWPE-1)购自武汉典型培养物保藏中心,RWPE-1使用含10%FBS的KSFM培养基培养,22RV1、C4-2B、PC-3、DU-145、LNCap细胞使用含10%FBS的RPMI-1640培养基培养,培养条件为37℃、5%CO2。含有AL451105.2全长的质粒和对照质粒购自上海捷瑞生物科技有限公司。逆转录试剂盒和荧光实时定量聚合酶链反应(qPCR)试剂盒购自美国Fermentas公司。Cell Counting Kit-8(CCK-8)试剂盒购自福州迈新生物技术开发有限公司。转染试剂LipofectamineTM2000 Reagent购自美国Invitrogen公司。辣根过氧化物酶偶联的羊抗兔二抗购自武汉博士德生物工程有限公司一抗β-微管蛋白(β-Tubulin)、锌指268(ZNF268)、细胞周期蛋白E2(CyclinA2)、细胞周期蛋白 A2(CyclinA2)、神经型钙黏蛋白(N-cadherin)和β-连环蛋白(βcatenin)购自美国BD公司。
1.2 检测方法
1.2.1 细胞转染将适量DU-145细胞接种于新的6孔板,将DU-145细胞分为对照组(转染对照质粒)和实验组(转染含有AL451105.2全长的质粒)。培养至60%融合时,根据LipofectamineTM2000 Reagent说明书将脂质体和相应质粒进行稀释,稀释液混匀静置20 min后滴加至6孔板。转染12 h后更换为新鲜培养基。
1.2.2 生物信息学预测采用LncBase Predicted v.2在线预测软件预测AL451105.2的下游miRNA,采用MicroT-CDS在线预测软件预测相应miRNA的下游靶基因。
1.2.3 qPCR检测 AL451105.2、miR-181a-5p和ZNF268 mRNA的表达 采用Trizol法提取前列腺癌组织或细胞总RNA,进一步逆转录为cDNA。按照qPCR试剂盒说明进行操作,以GAPDH或U6为内参,分别检测AL451105.2、miR-181a-5p和ZNF268 mRNA的表达。采用特异性引物序列如下:miR-181a-5p:上游:GGAACATTCAACGCTGTCG,下游:CAGTGCGTGTCGTGGAGT;GAPDH:上游:CTGGGCTACACTGAGCACC,下游:AAGTGGTCGTTGAGGGCAATG;AL451105.2:上游:AAGGGTTGGGGTTTGTTAGAA,下游:TAGCATGGCTGCCTGACTTA;ZNF 268:上游:CAGCTTCTATTTGGGTCCCAC,下游:ATTCTGCGACTCTTCTGCTTC。
1.2.4 Westernblot检测蛋白表达 DU-145细胞转染48 h后,胰酶消化两组细胞。采用细胞裂解液裂解并提取细胞总蛋白,每组取40 μg总蛋白上样,行SDS-PAGE电泳并转印至硝酸纤维素膜。采用5%脱脂牛奶室温下封闭2 h,采用相应一抗4℃孵育过夜。洗膜后相应二抗室温下孵育1 h,洗膜后采用化学发光法曝光显影。
1.2.5 CCK-8法检测细胞增殖DU-145细胞转染48 h后,胰酶消化两组细胞,分别以每孔2×103个接种于96孔板,在每个检测时间点,吸出培养基后加入20 μL CCK-8溶液,培养箱内孵育4 h,取出后采用酶标仪检测在490 nm处96孔板每孔的吸光度。分别检测1、2、3、4、5 d细胞吸光度。以时间为横坐标,以吸光度为纵坐标,绘制细胞生长曲线。
1.2.6 Transwell实验DU-145细胞转染48 h后,胰酶消化两组细胞,使用无血清培养基重悬并调整细胞密度为2× 105个/mL,每组取200 μL细胞悬液加入预先用Matrigel基质胶铺垫的Transwell小室中,在下室加入600 μL含10%胎牛血清的培养基。连续培养24 h后,取出小室并采用PBS溶液洗3次,甲醇固定10 min,结晶紫溶液染色10 min。每组分别取4个视野,在倒置显微镜下计数每组穿膜细胞数,取平均值比较各组细胞侵袭能力。
1.3 统计学方法实验设置至少3个平行组,以上所有数据均采用SPSS 17.0进行统计分析。各组计量资料以均数±标准差表示,组间采用t检验比较差异。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌组织和癌旁组织中AL451105.2的表达AL451105.2在前列腺癌组织和癌旁组织中的相对表达分别为(0.60±0.06)和(2.39±0.14),AL451105.2在前列腺癌组织中的相对表达明显低于癌旁组织,差异有统计学意义(P<0.01),见图1。
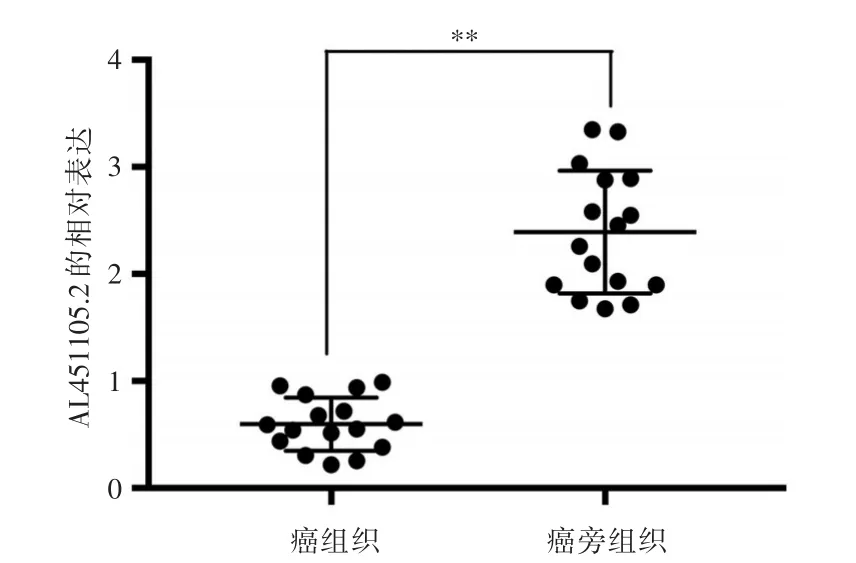
图1 qPCR检测AL451105.2在前列腺癌组织和癌旁组织中的表达Fig.1 qPCR detection of AL451105.2 expression in prostate cancer tissues and adjacent tissues,compared with adjacent tissues
2.2 前列腺癌细胞株中AL451105.2的表达AL451105.2在前列腺癌细胞株(22RV1、C4-2B、PC-3、DU-145、LNCap)和正常前列腺上皮细胞(RWPE-1)中的相对表达分别为(0.72±0.03)、(0.47 ± 0.02)、(0.33 ± 0.05)、(0.17 ± 0.01)、(0.62±0.02)和(1.00±0.07),AL451105.2在前列腺癌细胞株中的相对表达低于正常前列腺上皮细胞,差异有统计学意义(P<0.01),在DU-145细胞中的相对表达最低(P<0.01),见图2。
2.3 生物信息学预测AL451105.2的下游基因采用LncBase Predicted v.2在线预测软件预测AL451105.2的下游miRNA是miR-181a-5p,采用MicroT-CDS在线预测软件预测miR-181a-5p的下游靶基因是ZNF268,见图3。
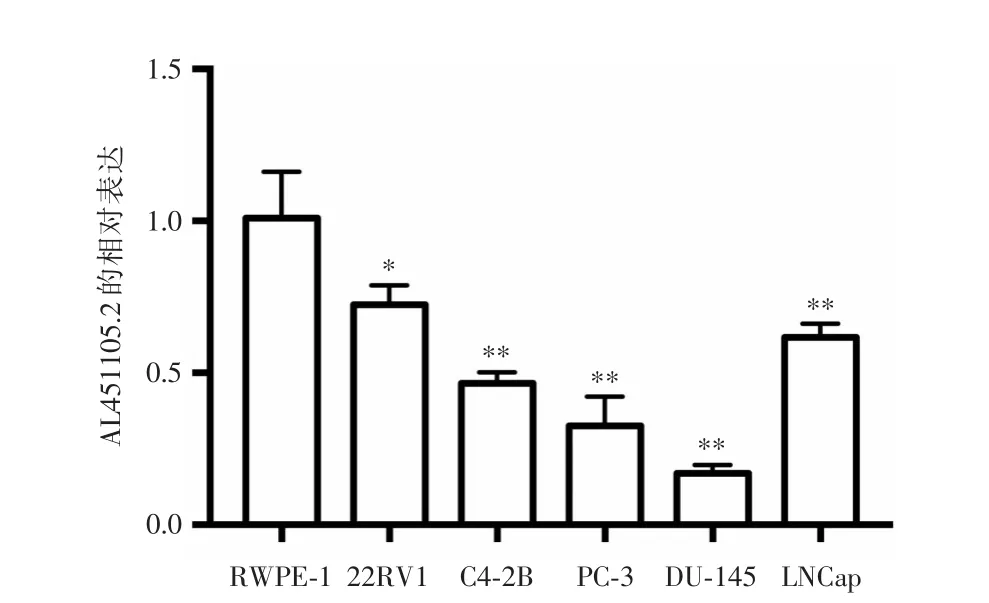
图2 qPCR检测AL451105.2在前列腺癌细胞株中的表达Fig.2 qPCR detection of AL451105.2 expression in prostatecancer cell lines

图3 生物信息学预测AL451105.2的下游基因Fig.3 Bioinformatics predicts downstream genes for AL451105.2
2.4 两组DU-145细胞中AL451105.2、miR-181a-5p和ZNF268mRNA的表达 对照组和实验组DU-145细胞中AL451105.2的相对表达分别为(1.07±0.24)和(7.60±0.37),两组比较差异有统计学意义(P<0.01),实验组中AL451105.2的相对表达明显增加。对照组和实验组DU-145细胞中miR-181a-5p的相对表达分别为(1.03±0.14)和(0.28±0.06),两组比较差异有统计学意义(P<0.01),实验组中miR-181a-5p的相对表达明显减少。对照组和实验组DU-145细胞中ZNF268 mRNA的相对表达分别为(1.00±0.05)和(5.51±0.43),两组比较差异有统计学意义(P<0.01),实验组中ZNF268 mRNA的相对表达明显增加。
2.5 ZNF268和细胞增殖侵袭相关蛋白表达变化前列腺癌细胞转染AL451105.2后,ZNF268蛋白表达升高,与细胞增殖相关的蛋白CyclinE2和CyclinA2表达降低,间质表型N-cadherin表达降低,上皮表型β-catenin表达升高。见图4。
2.6 AL451105.2对前列腺癌DU-145细胞增殖的影响CCK-8法检测两组DU-145细胞的增殖能力,酶标仪检测并绘制生长曲线。结果显示与对照组相比,实验组DU-145细胞由第3天开始,细胞生长速度明显减慢,提示AL451105.2可以抑制DU-145细胞的增殖能力,差异有统计学意义(P<0.05),见图5。
2.7 AL451105.2对前列腺癌DU-145细胞侵袭能力的影响Transwell实验检测两组DU-145细胞的侵袭能力,对照组和实验组DU-145细胞在24 h的穿膜细胞数分别为(165.40±17.02)和(41.07±6.36),实验组DU-145细胞侵袭能力明显低于对照组(P<0.01),提示AL451105.2可抑制DU-145细胞的侵袭能力。见图6。
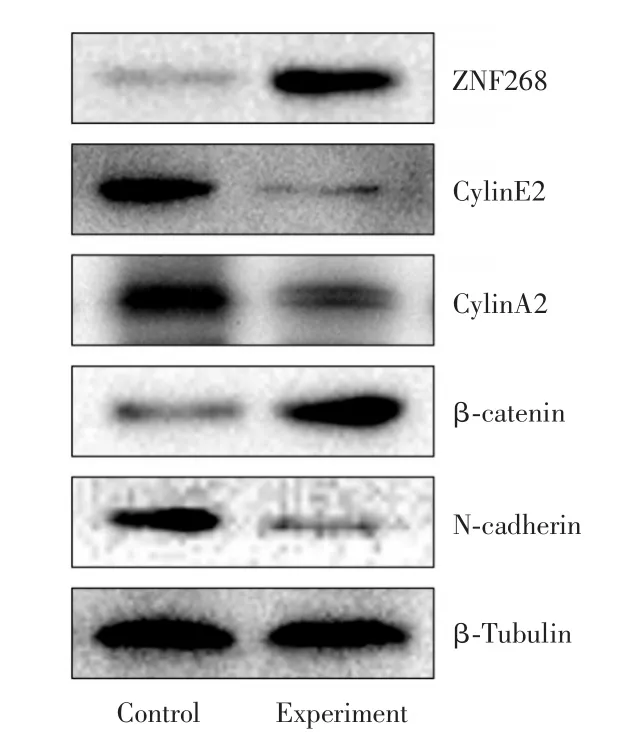
图4 Western blot检测两组细胞中ZNF268蛋白及下游蛋白的表达Fig.4 Western blot was used to detect the expression of ZNF268 protein and downstream protein in the two groups

图5 CCK-8法检测两组DU-145细胞的增殖能力Fig.5 CCK-8 was used to detect the proliferation of DU-145 cells

图6 Transwell实验检测两组DU-145细胞的侵袭能力Fig.6 Transwell assay was used to detect the invasive ability of two groups of DU-145 cells
3 讨论
lncRNA是一类RNA聚合酶Ⅱ的副产物,包含多个终止密码子或无有效的开放阅读框,并不能编码蛋白质[5]。lncRNA以RNA的形式参与转录调控、表观遗传调控、转录后调控[6]。大量的研究表明,lncRNA与肿瘤特别是前列腺癌的发生发展存在密切联系[7]。在前列腺癌中,多条lncRNAs被发现与前列腺癌的发生发展相关,包括XIST[8]、PVT1[9]、GAS5[10]、FALEC[5]等,为前列腺癌的发生机制、诊断、治疗效应、预后提供了重要的分子标志物和治疗靶标。AL451105.2作为一种新发现的lncRNA,长度为1 234核苷酸,其在前列腺癌中的表达和作用机制仍不清楚。
本研究通过qPCR检测前列腺癌组织和细胞中AL451105.2的表达水平,发现AL451105.2在前列腺癌组织和细胞中表达明显减少,表明AL451105.2可能成为一种新型的前列腺癌诊断标志物。在前列腺癌细胞系DU-145中采用瞬时转染技术,转入含有AL451105.2全长的质粒,通过检测AL451105.2在转染后的表达水平,表明转染可明显提高AL451105.2的表达水平。lncRNA的作用机制众多,可以“海绵样”方式吸附并调控miRNA的活性,从而影响miRNA下游靶基因的表达水平,进而参与前列腺癌的发生、发展[7,11-12]。采用lnc-Base Predicted v.2在线预测软件预测AL451105.2的下游miRNA是miR-181a-5p。有研究表明,miR-181a-5p在胃癌中的表达明显升高,miR-181a-5p可促进胃癌的进展,发挥癌基因的作用[13]。本研究发现,AL451105.2表达增加可明显降低miR-181a-5p的表达,AL451105.2可能具有吸附并降低miR-181a-5p表达的作用。采用MicroT-CDS在线预测软件预测miR-181a-5p的下游靶基因是ZNF268。ZNF268可发挥抑癌基因作用,ZNF268的低表达与白血病的发生密切相关[14]。ZNF268在前列腺癌发生、发展中的作用机制研究很少。本研究发现,miR-181a-5p表达降低可明显升高ZNF268的表达,miR-181a-5p可能对ZNF268的表达发挥干扰作用。DU-145细胞中AL451105.2表达升高后,与细胞增殖相关的蛋白如Cyclin E2和Cyclin A2表达明显降低,提示DU-145细胞的增殖能力降低。上皮间质转化(EMT)是前列腺癌侵袭最重要的调控机制之一,上皮细胞转化为间质细胞,主要表现为上皮表型如β-catenin的丢失和间质表型如N-cadherin的获得[15-16]。AL451105.2表达升高后,间质表型N-cadherin表达明显降低,上皮表型β-catenin表达明显增加,提示AL451105.2可以抑制DU-145细胞EMT的发生,DU-145细胞的侵袭能力降低。本研究发现,AL451105.2表达升高后,DU-145细胞的增殖能力和侵袭能力明显下降,表明AL451105.2可抑制DU-145细胞的体外增殖能力和侵袭能力。
总之,AL451105.2在前列腺癌组织和细胞中低表达,AL451105.2可通过抑制miR-181a-5p的表达、促进ZNF268基因的表达以抑制前列腺癌细胞的增殖和侵袭能力。AL451105.2可能是治疗前列腺癌潜在的分子作用靶点,本研究为前列腺癌发生发展的分子机制研究提供了理论基础。
