HPV16型感染者 宫颈组织p16、Ki-67表达及早期干预的对比研究
2019-08-24王春兰仲玉英季月霞金丽芳
王春兰,陆 燕,仲玉英,季月霞,金丽芳
(江苏省常熟市中医院/海峡两岸精准医学协会HPV感染疾病专业委员会, 1.妇产科;2.病理科,江苏 常熟 215500)
宫颈癌是女性生殖系统中最常见的恶性肿瘤。随着我国宫颈癌早诊早治工作大面积的开展,许多宫颈癌在癌前病变阶段被发现,如何正确精准诊断和管理宫颈癌前病变正日益受到妇产科医师的广泛关注。宫颈癌及宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)的形成都与高危型HPV感染密切相关,尤其是高危HPV16型感染,其致宫颈癌的风险排名第一,值得我们重视[1-4]。宫颈上皮内瘤变作为宫颈癌的癌前病变,如能得到及时的治疗可阻断宫颈癌的发生。目前,由于我国各地区经济和医疗发展水平不平衡,导致CIN的诊断和治疗仍存在着许多问题,其中较为突出的是CIN的治疗比较混乱,存在着CIN过度治疗等问题。因此,正确判断CIN病变进展风险,寻找CIN进展的影响因子和标志物,构建CIN的干预治疗的预警模式,并根据CIN不同阶段的特点,结合患者的年龄以及生育要求,选择更加合理的个体化观察方式和治疗方案,越来越受到国内外临床医师的广泛重视[5-7]。本文对122例高危HPV16型感染者,依据p16、Ki-67蛋白检测不同的表达情况给予观察和早期干预治疗。现报道如下。
1 资料与方法
1.1 一般资料
选取2015年12月~2017年5月江苏省常熟市中医院妇科门诊及住院患者中宫颈细胞学检查正常及人乳头状瘤病毒(human papillomavirus,HPV)分型检测为高危HPV16型感染者122例作为研究对象。年龄20~68岁,平均年龄(42.2±10.8)岁,按宫颈组织p16、Ki-67蛋白的表达有无将其分为无表达组(A组)48例及表达组(B组37例和C组37例)74例,各组患者一般资料比较,差异无统计学意义(P>0.05)。
1.2 诊断标准
(1)人乳头状瘤病毒(HPV)基因分型检测试剂盒(中国专利号:02102795.1,广东凯普生物科技有限公司)以快速杂交仪,检测结果:高危HPV 16型阳性。免疫组化试剂:采用P16/MTS1(产品编号:MAB-0223,克隆号:6H12,规格6ml),Ki-67(产品编号:RMA-0542,克隆号:SP6,规格6ml)均购置福州迈新生物技术开发有限公司。
(2)宫颈组织病理活检取样:采用窥阴器充分暴露宫颈,用棉拭子擦去宫颈口过多的分泌物,用醋酸棉球顺时针涂宫颈口两圈,稍等数分钟,观察宫颈,如为醋酸白试验阴性,按3、6、9、12点四点组织取样,如为醋酸白试验阳性,除3、6、9、12点四点组织取样外,再加上醋酸白试验阳性点组织取样。
(3)宫颈组织活检病理诊断:①正常或炎症;② CIN,按宫颈病变的轻中重分为CINI级、CINII级、CINIII级;③早期浸润癌(包括微小浸润癌);④浸润癌。
(4)结果判定:①高危HPV 16型:每例标本检测结束后,对每张膜片进行阅膜,判断膜片上蓝色信号所处基因型编号的位置,点和号对应,记录HPV的基因型16号位置为一蓝色信号确定单一型HPV16型阳性,所有被选病例均为HPV16型单一型感染者。②免疫组化:p16阳性位于细胞核或细胞质,染色模式显示为弥漫型(呈棕黄色或棕褐色颗粒或粗颗粒),即宫颈鳞状上皮基底层和副基底层的细胞呈现出连续染色,伴或不伴有表层细胞着色,判断p16为(+);宫颈鳞状上皮无染色、孤立细胞或小细胞群的染色(斑驳状染色)均判断为(-)。Ki-67阳性位于细胞核(呈棕黄色),宫颈鳞状上皮层除基底层和基底旁层外的细胞核染色,判断Ki-67为(+),无染色判断为(-)。
1.3 纳入标准
(1)阴道分泌物异常增多、异味、瘙痒或夹血丝;(2)HPV16型感染者,年龄>20岁,有性行为二年以上,均无子宫切除术、宫颈手术史、当前未怀孕;(3)能配合完成阴道镜检查及活检,有关病史的采集;(4)知情同意、能自愿纳入采集病例。以上4项均满足者,才能纳入研究,如果以上任何一项回答“否”,则不纳入研究。
1.4 排除标准
(1)无性生活史、妊娠期或哺乳期女性;(2)阴道镜活检常规病理提示:无宫颈上皮内瘤变(≥CIN I);(3)排除非生殖系统恶性肿瘤患者;(4)合并有肝肾、脑血管、心血管和造血障碍等原发性疾病者;(5)精神病患者;(6)非单一HPV16型感染者或HPV16型伴一种以上型别感染者;如果以上任何一项回答“是”,则该患者将不被纳入研究范畴。
1.5 研究方法
入组病例为高危HPV 16型感染者均采用阴道镜和宫颈组织活检,阴道镜活检常规病理提示:无宫颈上皮内瘤变(≥CIN I),同时对宫颈组织行免疫组化p16、Ki-67蛋白检测,依据p16、Ki-67蛋白的表达情况分为无表达组(A组)及有表达组(B组和C组),宫颈活检组织p16、Ki-67蛋白无表达组观察一年,再行宫颈HPV分型检测+活检。宫颈活检组织p16、Ki-67蛋白表达者分二组,一组为药物(使用重组人干扰素α-2b栓:阴道塞药,每例感染者每月连续用10天,用三个月)治疗组(B组),一组为LEEP术治疗组(C组),p16、Ki-67蛋白表达治疗组一年后再复查HPV型别+活检。
1.6 统计学方法
采用SPSS 17.0统计学软件对数据进行处理,计量资料以表示,采用t检验;计数资料以例数(n)、百分数(%)表示,采用x2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组高危HPV16型转阴率比较
A 组转阴率最低,C 组转阴率最高,三组之间高危H P V 1 6 型转阴率两两比较,差异有统计学意义(P<0.05),见表1。

表1 各组高危HPV16型转阴率比较
2.2 一年后各组CIN病变发生率比较
p16、Ki-67蛋白无表达的观察组(A组)一年后发展为CIN病变者共18例,其中CIN I级病变13例,占72.22%,CIN II级病变4例,占22.22%,CIN III级病变1例,占5.56%,总的CIN病变发生率为37.50%;p16、Ki-67蛋白表达组(B组)发展为CIN病变者共9例,其中CIN I级病变7例,占77.78%,CIN II级病变1例,占11.11%,CIN III级病变1例,占11.11%,总的CIN发生率为24.32%;p16、Ki-67蛋白表达组(C组)无发展为CIN病变者,总的CIN病变发生率为0。见表2。
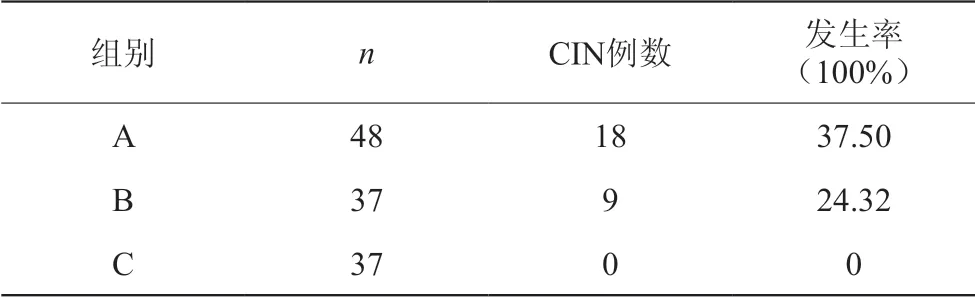
表2 各组CIN病变发生率比较
3 讨 论
近十多年来,我国女性宫颈癌的发病呈现出两大特点:一是发病人数仍在上升,二是发病年龄年轻化,其发病率每年仍以2%~3%的速度增加。宫颈癌是目前人类所有恶性肿瘤中病因学最明确的肿瘤,高危型HPV持续感染与宫颈癌的发生、发展有着密切的关系。高危型HPV有数十种之多,各个型别之间致癌力存在着明显的差异性,其中高危HPV16型致癌性最强,同时宫颈癌也存在着一个较长的宫颈上皮内瘤变(CIN)期,这就给临床妇产科医师留下了充足的干预治疗时间[4,8]。因此,临床上高危型HPV分型检测和预测CIN病变的进展已受到了前所未有的重视。单独将高危型HPV作为一线检测手段存在着一些缺陷,从而对高危型HPV预测CIN进展的价值产生一定的影响。p16的表达主要与宫颈癌前病变(即CIN病变)程度有关,可作为高危型HPV感染阴性的宫颈鳞状细胞癌及癌前病变的诊断指标[9]。如能将高危型HPV分型检测和p16和Ki-67蛋白检测组合应用,对临床医师判断宫颈病变的进展和风险,适时采取干预治疗有着重要的指导意义。
p16为一种抑癌基因,其p16基因编码的蛋白是一种细胞周期蛋白D依赖性激酶的抑制剂,当宫颈细胞被高危型HPV感染后,高危型HPV的E7蛋白竞争性抑制细胞周期蛋白依赖性激酶4(CDK4)与视网膜细胞瘤蛋白(Rb)的结合,使得Rb失去活性,同时激活了转录因子E2F,使其基因转录水平上调,从而导致p16蛋白过度表达,可检测到p16蛋白。Ki-67为一种细胞增殖核抗原,Ki-67蛋白表达的水平提示细胞的增殖状态。p16已成为一种宫颈早期恶性病变的指标,能够在早期有效地判断宫颈病变走向,并采取积极治疗措施,对遏制宫颈癌前病变的进展,促进肿瘤治疗均有显著优势。Ki-67是一个判断肿瘤的恶性程度及转移情况的标志物,对肿瘤增殖、浸润的评估价值较高[7,9]。高危型HPV感染与p16和 Ki-67表达之间存在着相关性和互补性,三者共同检测的价值更高。
本研究高危HPV16型感染者一年后转阴率比较:A组(p16、Ki-67蛋白无表达,观察组)一年后高危HPV16型转阴率为37.50%,B组(p16、Ki-67蛋白有表达,药物治疗组)一年后高危HPV16型转阴率为45.95%,C组(p16、Ki-67蛋白有表达,LEEP术治疗组)一年后高危HPV16型转阴率为89.90%,观察组HPV16型感染者转阴率最低,低于药物治疗组和LEEP术治疗组,三组高危HPV16型转阴率之间对比均有显著差异性,具有统计学意义(P<0.05)。提示高危HPV16型感染可增加发生高级别鳞状上皮内瘤样病变及宫颈癌风险,所以高危型HPV16感染的妇女应结合p16、Ki-67检测结果进行干预治疗,干预治疗比不干预治疗,高危HPV16型一年后转阴率要高,以LEEP术干预治疗,高危HPV16型转阴率效果最好。
高危HPV16型感染者一年后三组CIN病变发生率的比较:A组(p16、Ki-67蛋白无表达,观察组)观察一年后发展为CIN病变者共18例,其中CIN I级病变者13例,占72.22%(13/18),CIN II级病变者4例,占22.22%(4/18),CIN III级病变者1例,占5.56%(1/18),总的CIN病变发生率为37.50%(18/48);B组(p16、Ki-67蛋白有表达,药物治疗组)一年后发展为CIN病变者共9例,其中CIN I级病变者7例,占77.78%(7/9),CIN II级病变者1例,占11.11%(1/9),CIN III级病变者1例,占11.11%(1/9),总的CIN病变发生率为24.32%(9/37);C组(p16、Ki-67蛋白有表达,LEEP术治疗组)一年后无发展为CIN级病变者,总的CIN发生率为0.00%(0/37)。观察组中高危HPV16型感染者总的CIN病变发生率最高,高于药物治疗组和LEEP术治疗组,三组高危HPV16型感染者之间总的CIN病变发生率对比,差异均有统计学意义(P<0.05)。提示高危HPV16型感染者通过干预治疗,宫颈CIN II级以上病变的发生率明显下降。女性宫颈CIN病变与高危型HPV感染有关,宫颈CIN病变级别越高,高危型HPV感染率也随之增高。由于高危型HPV型别很多,其致癌性强弱与高危型HPV型别密切相关,高危HPV16型致癌性最强。高危HPV16型感染宫颈后会增加发生CIN II级以上病变及宫颈癌的风险,以至高危HPV16型感染的观察组出现了CIN II级和CIN III级病变患者,应引起临床医师的高度关注。对高危HPV16型感染的CIN II级以上病变经过治疗后的患者更应予以密切的随访,HPV的基因型检测应被视为治疗后随访的重要指标。间隔时间至少6个月行HPV分型检测。同时配合细胞学检查及p16、Ki-67蛋白检测,以便发现宫颈高级别病变。
综上所述,CIN病变的发生和进展与高危型HPV感染密切相关,高危HPV 16型感染在全球范围内均为最主要的致癌型别,致癌力最强,其检测率一般超过60%以上[4,10,11]。选择致癌力最强的高危HPV16型感染者作为研究对象,对其他高危型HPV感染者有着借鉴和参考作用,用p16、Ki-67蛋白检测对高危HPV16型感染者进行分流是选择早期干预治疗者的一个重要指标,它们可弥补高危HPV检测敏感性过高和高危HPV检测阴性造成的缺陷[7-9]。p16、Ki-67蛋白检测阴性而高危HPV16型感染者,一年内可发生CIN病变患者,其CIN II级以上病变的发生率明显比两组经干预治疗的高危HPV16型感染者要高的多。因此,对这类高危HPV16型感染者,半年后可行高危HPV16型和p16、Ki-67蛋白复检,必要时行宫颈活检。p16和Ki-67的表达与宫颈癌前病变的级别密切相关已得到公认,在高危HPV阴性的高级别CIN病变中,p16阳性可作为高危HPV感染所致的宫颈鳞状上皮内瘤变的替代的标志物[9,12]。由于HPV疫苗不能解决宫颈癌预防所有问题,宫颈癌的早期干预治疗仍然是未来研究的方向,宫颈癌前病变干预治疗的手段和方法仍需要我们在临床上不断地探索和总结,期待着多中心大样本的深入研究。
