猪流感病毒NP蛋白单克隆抗体的制备与鉴定
2019-08-23李青梅杨艳艳王彦红张改平
李 鸽,刘 肖,李青梅,杨艳艳,王彦红,张改平,,3
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009)
流感病毒(Influenza virus,IV)属于正黏病毒科(Orthomyxoviridae)的流感病毒属(Influenzavirus),分为A(甲)、B(乙)、C(丙)3个型[1-3],其中A型流感病毒由8个单股负链RNA(viralRNA,vRNA)片段组成,长度为2 341~2 890个核苷酸[4-6]。猪流感(Swine influenza,SI)是由A型流感病毒引起的猪的一种急性、高度接触传染性呼吸道疾病,临床以突发、高热、咳嗽、呼吸困难、衰竭等为特征,发病率高,但死亡率低,此外还能引起怀孕母猪的流产[7]。目前,全球猪群中流行的流感病毒血清型以H1N1、H3N2和H1N2亚型为主,但各地流行的猪流感病毒(Swine influenza virus,SIV)谱系或基因节段的来源均有差异[8]。
流感病毒的抗原变异频繁,通过不断改变其抗原性,流感病毒可以逃避宿主免疫系统的攻击[9]。根据抗原性变异的程度可以分为抗原漂移和抗原转变。其中,由点突变造成的抗原漂移可导致流感每年的季节性流行,而由基因重组造成的抗原转变则可能产生新的流感大流行[10]。因此,有人提出了广谱流感抗体的概念。由于单克隆抗体具有特异性强、灵敏度高、生产成本低等优点[11],已被广泛应用于病毒学诊断中。为此,本研究利用H1N1和H3N2病毒感染犬肾MDCK细胞,建立免疫过氧化物酶单层细胞试验(IPMA)单克隆抗体检测方法,筛选具有保守性的SIV单克隆抗体,为猪流感的检测奠定基础。
1 材料和方法
1.1 供试动物、细胞系和毒株
SPF级鸡胚购自北京勃林格殷格翰维通生物技术有限公司,SPF级6~8周龄雌性BALB/c小鼠购自济南朋悦实验动物繁殖有限公司,H1N1亚型(A/swine/Zhucheng/90/2014)和H3N2亚型(A/swine/Henan/1/2010)SIV分别由山东省农业科学院和河南农业大学惠赠,犬肾MDCK细胞、小鼠骨髓瘤细胞(SP2/0)和猪肾上皮细胞(PK-15)由河南省农业科学院免疫学重点实验室保存。
1.2 主要试剂
弗氏完全佐剂、弗氏不完全佐剂、HAT、HT和PEG 1500均购自Sigma公司,羊抗鼠酶标二抗购自Jackson公司,鼠单克隆抗体亚型鉴定试剂盒购自Proteintech Group公司,DMEM培养基和1640培养基购自北京索莱宝生物科技有限公司,胎牛血清购自Gibco公司,PBST溶液由含0.05% Tween-20的PBS配制而成。
1.3 H1N1和H3N2亚型SIV的增殖和纯化
分别将H1N1和H3N2亚型SIV用无菌的PBS进行1∶1 000倍稀释,取0.1 mL接种于9~11日龄SPF鸡胚尿囊腔,于37 ℃培养72 h后测定H1N1和H3N2亚型SIV的血凝效价,之后无菌收取尿囊液,同时应用Reed-Muench方法测定病毒尿囊液对MDCK细胞的半数细胞感染量(TCID50)。
将收集到的病毒尿囊液用0.1%甲醛灭活,采取差速离心法纯化,对纯化后的病毒测定蛋白质浓度,分装后保存于-80 ℃备用。
1.4 动物免疫
随机选取5只6周龄雌性BALB/c小鼠进行免疫,免疫剂量为50 μg/只。首次免疫将H1N1纯化病毒与等量的弗氏完全佐剂乳化混匀后,进行颈背部皮下多点注射。间隔14~21 d后,进行二免时将H3N2纯化病毒和等量的弗氏不完全佐剂乳化混匀后进行注射。间隔14~21 d后,进行三免时将H1N1纯化病毒与等量的弗氏不完全佐剂乳化混匀后进行注射,四免同二免。在融合前的3~5 d,对小鼠进行尾部采血,并用IPMA单克隆抗体检测方法检测血清效价,选取效价最高的小鼠,直接腹腔注射100 μg的H3N2纯化病毒进行加强免疫。
1.5 IPMA单克隆抗体检测方法的建立
为筛选阳性杂交瘤细胞株,利用H1N1和H3N2亚型SIV感染MDCK细胞,建立IPMA单克隆抗体检测方法。在96孔细胞培养板中培养MDCK细胞至融合度达到80%时,分别接种倍比稀释的H1N1和H3N2亚型SIV,并进行12、24、36、48、60、72 h的感染,弃去培养上清,每孔加入无水乙醇室温固定15 min;使用5%脱脂奶粉于37 ℃封闭1 h;将待检杂交瘤细胞上清分别加入H1N1和H3N2亚型SIV感染孔中,于37 ℃反应30 min;每孔加入50 μL倍比稀释的羊抗鼠酶标二抗,于37 ℃反应30 min;上述每步均用PBST充分洗涤;每孔加入50 μL AEC显色液室温显色10~15 min,在显微镜下观察显色情况。
1.6 细胞融合和阳性杂交瘤细胞株的筛选
无菌取免疫小鼠的脾细胞,然后与SP2/0细胞按常规方法进行融合,用1.5中建立的IPMA单克隆抗体检测方法筛选阳性杂交瘤细胞株,采用有限稀释法对筛选出的阳性杂交瘤细胞株进行3次亚克隆,最后获得能够稳定分泌抗体的单克隆细胞株,收集单克隆抗体细胞培养上清用于鉴定,将细胞冻于-80 ℃保存备用。
1.7 腹水的采集
随机选取11~13周龄的雌性BALB/c小鼠,以0.5 mL/只的剂量对小鼠腹腔注射无菌液体石蜡,并在7 d后再次每只小鼠腹腔注射0.5 mL/只处于对数生长期的杂交瘤细胞(1×106个/mL)。注射后注意观察小鼠的状态,并于7 d后待小鼠腹部明显胀大时,无菌进行腹水采集,于3 000 r/min离心15 min以去除细胞与杂质,收集上清并于-80 ℃冻存备用。
1.8 单克隆抗体的鉴定
1.8.1 抗体效价的测定 采用1.5中建立的IPMA单克隆抗体检测方法测定杂交瘤细胞培养上清和抗体诱导小鼠产生的腹水效价,并将它们均从1∶10起进行倍比稀释至1∶1012。
1.8.2 抗体亚型的鉴定 用小鼠单克隆抗体亚型鉴定试剂盒对收集的杂交瘤细胞培养上清进行单克隆抗体的亚型鉴定,具体步骤参照试剂盒说明书。
1.8.3 抗体病毒反应谱的测定 分别用H1N1和H3N2亚型SIV感染MDCK细胞,利用1.5中建立的IPMA单克隆抗体检测方法检测单克隆抗体与病毒的反应性,并同时检测单克隆抗体与H5N1、H7N9和H9N2亚型流感病毒灭活细胞板(由华南农业大学提供)的反应性。
1.8.4 抗体特异性的鉴定 分别用猪圆环病毒2型、猪伪狂犬病毒和猪细小病毒感染PK-15细胞,单克隆抗体培养上清作一抗,用IPMA单克隆抗体检测方法测定是否反应。
1.8.5 抗体中和活性的鉴定 分别以不同稀释度的3株单克隆抗体诱导产生的小鼠腹水处理适当稀释的H1N1和H3N2亚型SIV毒株,接种至MDCK细胞,利用已知的H1N1或H3N2亚型SIV阳性血清以IPMA单克隆抗体检测方法测定病毒对细胞的感染情况,评估3株单克隆抗体分别对H1N1和H3N2亚型SIV的中和活性。
1.8.6 抗体血凝抑制(HI)效价的鉴定 在96孔微量板的第1列加入单克隆抗体诱导产生的小鼠腹水,倍比稀释至第10列,第11列为已知的H1N1或H3N2亚型SIV阳性血清,第12列为阴性对照;加入4个血凝单位病毒稀释液,50 μL/孔,混匀、室温静置15~30 min;每孔加入50 μL的0.5%鸡红细胞,室温静置30 min后观察试验结果。
1.8.7 Western blot检测 将灭活的H1N1和H3N2亚型SIV的全病毒和SDS-PAGE上样缓冲液混合,煮沸10 min,每孔上样20 μL,利用10% SDS-PAGE进行电泳后转印至硝酸纤维素膜,5%脱脂奶粉封闭,以单抗上清为一抗,山羊抗鼠酶标二抗 1∶10 000稀释进行检测。
2 结果与分析
2.1 H1N1和H3N2亚型SIV的纯化
用SPF级鸡胚培养H1N1和H3N2亚型SIV,收集的尿囊液经差速离心后,获得初步纯化的病毒,其蛋白质含量分别为8.6 mg/mL和9.8 mg/mL,血凝效价分别为2-8和2-9,TCID50分别为1×10-6.5/0.1 mL和1×10-6.8/0.1 mL。
2.2 IPMA单克隆抗体检测方法的建立
待MDCK细胞融合度达到80%时,分别接种H1N1和H3N2亚型SIV,确定IPMA单克隆抗体检测方法的最佳接毒量为1 000个TCID50,接毒后的最佳培养时间为24 h,二抗的最佳稀释度为1∶500,由图1可知,MDCK细胞的胞浆被染成红色,感染细胞比例合适,空白对照干净无显色,显微镜下的观察结果更直观。

A:小鼠阳性血清;B:小鼠阴性血清
2.3 免疫小鼠血清效价的测定
由表1可知,用建立的IPMA单克隆抗体检测方法检测5只小鼠的血清效价,血清效价在1.28×10-4~2.56×10-5,取效价最高的3号小鼠的脾细胞与骨髓瘤细胞进行融合。
2.4 杂交瘤细胞的筛选
采用有限稀释法对融合后筛选获得的阳性杂交瘤细胞进行3次连续亚克隆,最后获得能稳定分泌抗体的细胞株16D5、18G8和20C4,经IPMA单克隆抗体检测方法检测结果如图2所示,3株杂交瘤细胞上清均能在H1N1和H3N2亚型SIV感染的MDCK细胞中检测到SIV并发生特异性结合,在显微镜下观察到清晰的红色斑点,而1640培养基则不能与H1N1和H3N2亚型SIV感染的MDCK细胞反应,显微镜下未出现红色斑点。

表1 免疫小鼠血清的IPMA效价Tab.1 IPMA titers of immunized mice serum

A: 杂交瘤细胞16D5的IPMA;B: 杂交瘤细胞18G8的IPMA;C: 杂交瘤细胞20C4的IPMA;D: 1640培养基的IPMA
2.5 单克隆抗体效价的测定和亚型的鉴定
如表2所示,3株单克隆抗体细胞培养上清的效价在1×10-4~1×10-3,抗体诱导小鼠产生的腹水的效价在1×10-6~1×10-5;亚型鉴定结果显示,3株单克隆抗体的重链均为IgG1亚型,轻链为κ链。
2.6 单克隆抗体病毒反应谱的测定
如图3所示,用IPMA单克隆抗体检测方法测定3株单克隆抗体与H1N1、H3N2、H5N1、H7N9和H9N2亚型流感病毒的反应性,结果表明,3株单克隆抗体均能在H1N1、H3N2、H5N1、H7N9和H9N2亚型流感病毒感染的MDCK细胞中检测到流感病毒并发生特异性结合,在显微镜下可观察到红色斑点。

表2 单克隆抗体细胞培养上清、抗体诱导小鼠产生的腹水效价和亚型鉴定Tab.2 Titers of monoclonal antibody cell culture supernatant, antibody-induced ascites produced by mice and subtype identification

A:H1N1亚型流感病毒感染的MDCK细胞;B:H3N2亚型流感病毒感染的MDCK细胞;C:H5N1亚型流感病毒感染的MDCK细胞;
2.7 单克隆抗体特异性、中和活性和HI活性的测定
单克隆抗体特异性试验结果显示,3株单克隆抗体只与流感病毒发生特异性反应,而不与猪圆环病毒2型、猪伪狂犬病毒和猪细小病毒反应,说明3株抗体均具有较好的特异性;中和试验结果显示,3株单克隆抗体均不能抑制H1N1和H3N2亚型SIV对MDCK细胞的感染,不具有病毒中和活性;HI试验结果显示,3株单克隆抗体对H1N1和H3N2亚型SIV均无HI活性(表3)。
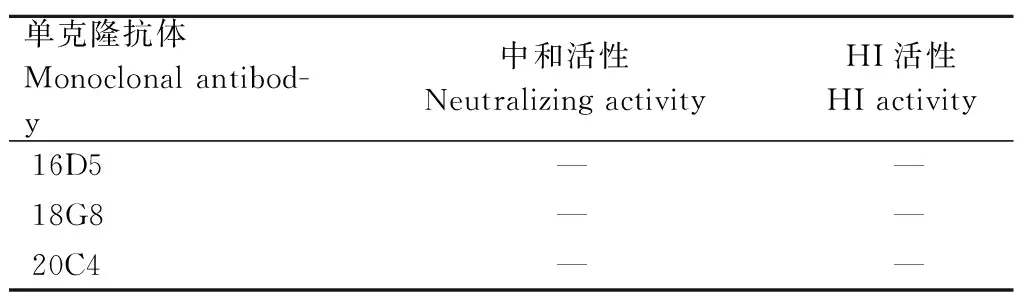
表3 单克隆抗体中和活性和HI活性鉴定Tab.3 Identification of neutralizing activity and HI activity of monoclonal antibodies
2.8 单克隆抗体Western blot检测
如图4所示,制备的3株单克隆抗体均在约56 ku处出现一条特异性的条带,且条带单一,而空载泳道未出现条带,说明16D5、18G8和20C4这3株单克隆抗体针对的是NP蛋白。
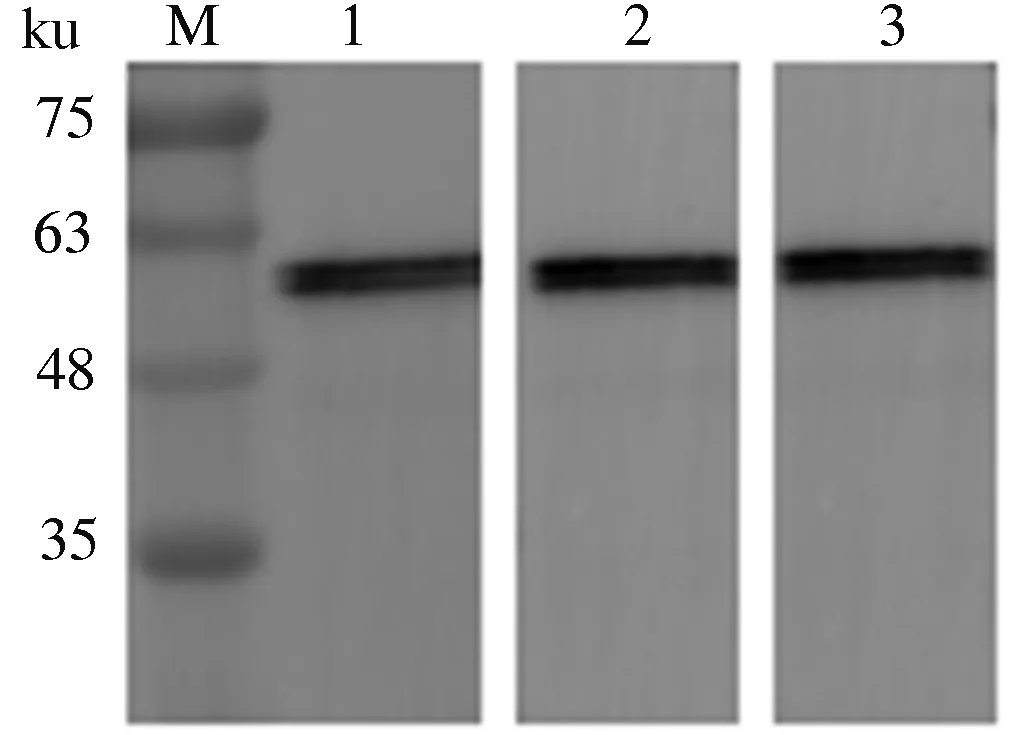
M:蛋白质预染Marker;1:单克隆抗体16D5与H1N1亚型SIV全
3 结论与讨论
流感病毒NP蛋白非常保守,具有型的特异性,NP蛋白在同型病毒间的氨基酸同源性高于90%[12],因此,NP蛋白是流感病毒分型的主要依据之一,也是动物模型中研究最早的具有交叉保护效果的抗原。NP蛋白通过诱导机体生成杀伤性T淋巴细胞产生免疫应答[13],且在A型流感病毒的不同亚型之间具有很高的交叉反应活性[14]。ALTSTEIN等[15]用表达NP蛋白(H1N1亚型流感病毒)的痘病毒免疫小鼠,不仅能够抵御人流感病毒H3N2的攻击,还能有效抵御禽流感病毒H5N2的攻击。研究人员用大肠杆菌表达的H3N2亚型流感病毒的NP蛋白免疫也可以达到交叉保护的效果,用H1N1亚型流感病毒攻毒后有78%的存活率[16]。由于流感病毒的多宿主和高度变异性,制备NP蛋白高度保守和交叉保护的广谱流感抗体已成为一种新趋势。
不同来源的免疫抗原对NP蛋白结构有不同程度的影响,原核系统表达的蛋白质不能进行翻译后加工,如糖基化修饰及二硫键形成等,可能导致重组表达蛋白结构与天然结构不符[17]。在真核系统表达中,瞬时转染受很多因素影响,有可能出现转染效率低的问题;同时瞬时转染表达无法保证不同批次试验的均一性及稳定性。因此,本研究采用纯化的H1N1和H3N2亚型SIV交叉免疫小鼠,通过建立的IPMA单克隆抗体检测方法筛选获得3株单克隆抗体,通过Western blot分析均在56 ku附近出现一条特异性的条带,且不具有中和活性和HI活性,说明3株抗体均针对NP蛋白,3株抗体不仅效价高、特异性好,且具有良好的保守性和稳定性,为流感病毒的监测提供了技术手段。
