火龙果溃疡病原菌拮抗菌株的筛选与生物防治效果初探
2019-08-23张振华王文雅杨开样何世伟
张振华,林 江,王文雅,许 畅,杨开样,何世伟
(1.海口市琼山区农林服务中心,海南 海口 571100; 2.海南大学 热带农林学院,海南 儋州 571737; 3.中国热带农业科学院 试验场,海南 儋州 571737)
火龙果(HylocereusundatusBritt.et Rose)属于仙人掌科(Cactaceae)量天尺属(Hylocereus),是一种集水果、花卉为一体的热带、亚热带果树,其果实具有较高的经济价值和营养价值,被誉为保健食品和果品珍品[1]。该植物原产于中美洲,自20世纪90年代引入我国,目前在南方地区大面积种植。随着种植规模扩大,火龙果已逐步成为我国南方地区农民经济收入的重要来源。
火龙果溃疡病是目前火龙果生产管理中危害最严重的病害之一,病原菌为新暗色柱节孢(Neoscytalidiumdimidiatum)[2-3]。该病主要危害火龙果茎部,严重时导致茎秆腐烂、果实开裂,甚至引起果肉褐腐或黑腐[4-5]。目前,对该病以化学防治为主,吡唑醚菌酯、腐霉利、中生菌素、链霉素等药剂对火龙果溃疡病菌都有很好的抑制作用[6-9],但在生产上很难完全控制火龙果溃疡病的发生和蔓延。除化学防治外,选用抗性品种在一定程度上可以降低发病率[10]。这些方法各有不足之处,生物防治因其绿色、环境友好,已成为研究热点,但受各种因素的制约,尤其是外界环境对生防菌活性的影响,防效稳定性不高。因而,获得防效稳定的生防菌株,对火龙果溃疡病进行防治,显得尤为重要。为此,从火龙果不同生境分离拮抗细菌,对细菌进行赋值评估,筛选出有效生防菌株,随后进行温室防效试验,期望获得防治效果稳定的菌株。
1 材料和方法
1.1 试验材料
供试植物:品种名称为金都1号的红皮红肉型火龙果。
病原菌来源:采用病组织分离法[2],从发生溃疡病较严重的火龙果茎秆上分离菌株,经柯赫氏法则验证后,确定为病原菌,经形态学、分子生物学鉴定该病原为新暗色柱节孢(N.dimidiatum)[3],菌种保存于海南大学热带农林学院儋州校区植物病理实验室。
生防菌取样地:海南省儋州市中国热带农业科学院试验场火龙果基地。
培养基:蛋白质培养基(Ⅰ)、几丁质酶选择性培养基(Ⅱ)、纤维素酶活性测定培养基(Ⅲ)、产嗜铁素活性测定培养基(Ⅳ)、葡聚糖培养基(Ⅴ)等5种培养基均参考郑丽等[11]方法进行制备。
Ⅰ:配制A液(脱脂奶粉6.4 g,溶于240 mL水中,121 ℃灭菌1 min)、B液(琼脂6.4 g,定容至240 mL,121 ℃灭菌20 min),将A液与B液灭菌后混匀倒平板。
Ⅱ:NH4H2PO41.0 g、KCl 0.2 g、MgSO4·H2O 0.2 g、1%胶体状几丁质100 mL、琼脂20 g,pH值7.0。
Ⅲ:蛋白胨10 g、酵母粉10 g、羧甲基纤维素钠10 g、NaCl 5 g、KH2PO41 g、琼脂18 g,pH值7.0。
Ⅳ:配制A液(将60.5 mg CAS溶于50 mL去离子水;配制10 mL三价铁溶液;将72.9 mg CTAB溶于40 mL去离子水。将上述3种溶液混合后定容至100 mL,调pH值至中性,121 ℃灭菌20 min)、B液(将30.24 g Pipes加入到900 mL WA培养基,用NaOH溶液将pH值调至6.8,121 ℃灭菌20 min),将A液和B液混匀后倒平板。
Ⅴ:β-1,3-葡聚糖0.1 g、TSB 0.4 g、琼脂1.6 g、4 g/L的刚果红1 mL,定容至100 mL。
1.2 试验方法
1.2.1 样本采集和菌株分离 样本采集:将火龙果溃疡病发病和非发病地块划分为不同小区,每个小区面积不低于100 m2。采用五点采样法,每点间隔不少于10 m。每点选取3株,将健康植株或病株健康部分连同根际土壤一并收集。土壤取样时先剥离表层土,采样深度为2~5 cm,面积约0.5 m2。每个小区样本由5次取样混合获得。参照 MORRIS等[12]的方法取样:A.发病地块的根际土;B.发病地块染病植株的根围土;C.发病地块健康植株的根围土;D.发病地块的病株(病株上的健康部位);E.发病地块的健康植株;F.无病害地块的根际土;G.无病害地块健康植株的根围土;H.无病害地块的健康植株。
菌株分离:采用稀释分离法[13]分离土壤样本中的外生细菌。取5 g土样、45 mL无菌水和玻璃珠加入到三角瓶中,在28 ℃、150 r/min摇床中振荡30 min,随后放置在80 ℃水浴中10 min;取1 mL土壤悬浮液和9 mL无菌水加入试管中,以梯度稀释法制备10-1、10-2、10-3、10-4、10-5、10-6稀释液;分别取10-4、10-5、10-63个梯度的稀释液各100 μL,均匀涂布在牛肉浸膏蛋白胨分离培养基[14]上,于30 ℃培养,24 h 后观察菌落的形态;用划线法进行分离纯化,编号登记后,加入50%甘油,-80 ℃保存备用。
植株内生细菌分离时,先用1%NaClO浸泡5 min,再用70%CH3CH2OH浸泡1.5 min,经无菌水清洗确认表面消毒干净后,采用外生细菌分离方法进行分离。
1.2.2 拮抗菌株的筛选 初筛:采用平板对峙法进行筛选[13]。先用PDA平板活化火龙果溃疡病菌,然后用打孔器取直径5.0 mm的菌饼,接种到PDA培养皿中央。之后用接种环挑取细菌单菌落接种到距菌饼3 cm处,每个菌饼周围接种4个单菌落,28 ℃黑暗培养,第3天记录抑菌带的宽度和细菌菌落直径,将具有拮抗作用的细菌转接到LB培养基平板上,划线分离纯化,4 ℃保存备用。
复筛:将分离纯化后的细菌再次进行平板对峙试验,测定其抑菌作用。
1.2.3 拮抗菌株产酶与代谢物活性测定 蛋白酶活性测定:参照YANG等[14]的方法进行改进,用灭菌牙签挑取处于生长旺盛期的菌株,接种于蛋白质培养基平板上,30 ℃培养3 d,观察透明圈有无,分别记录透明圈的内径与外径,每个处理重复3次。
几丁质酶活性测定:参照ROBERTS等[15]的方法,将细菌在以胶体状几丁质为唯一碳源的培养基上培养,接菌后30 ℃培养3 d,观察透明圈有无,并记录大小。
纤维素酶活性测定:参照王芳等[16]的方法,将菌株接到纤维素酶活性测定平板上,30 ℃培养3 d后,用1 g/L刚果红染色1 h,再用1 mol/L NaCl浸渍1 h,观察透明圈有无,并记录大小(染色前先测菌落直径,菌落直径可用记号笔进行标记)。
产吲哚乙酸活性测定:参照SARWAR等[17]的方法,以1%胰蛋白胨水溶液(pH值7.2~7.6)为培养液,将细菌培养2 d,加入3~5 mL埃利希氏试剂(取C9H11NO 8 g,溶于760 mL 95% CH3CH2OH和160 mL浓盐酸中),观察液面是否变红。
产嗜铁素活性测定:参照SHIN等[18]的方法接种细菌,30 ℃培养3 d后观察并测量透明圈内径和外径。
β-1,3-葡聚糖酶活性的检测:参照王芳等[16]的方法,在葡聚糖平板上接菌后30 ℃培养4 h,观察并测量透明圈的内径和外径。
1.2.4 拮抗菌株的赋值评估 采用的赋值系统包括平板拮抗活性、拮抗菌株产酶与代谢物活性,赋值参考BERG等[19]的方法进行。根据初筛第5天的抑菌带宽度,赋值分为:1,抑菌带宽度<0.1 mm;2,抑菌带宽度在0.1~0.5 mm(含0.5 mm); 3,抑菌带宽度>0.5 mm。水解酶和产生嗜铁素赋值:0为无水解圈;1为水解圈在1~3 mm(含 3 mm);2为水解圈在3~6 mm(含 6 mm);3为水解圈>6 mm。产吲哚乙酸活性根据液面颜色变化,不变色时赋值0;浅红色时赋值1;红色时赋值2;深红色时赋值3。
1.2.5 拮抗菌株的温室防效测定 依据复筛和拮抗菌次生代谢物活性评价结果,选择综合评价较好的拮抗菌株在盆栽苗上开展试验。处理时,将拮抗菌发酵液用灭菌水稀释到1×108cfu/mL,用喷雾器均匀喷施于火龙果枝条上,以喷施灭菌水的处理作为空白对照。喷施处理5 d后,采用针刺法接种火龙果溃疡病菌孢子液(1×106cfu/mL)。每个处理3个重复,在接种病原菌 10、15、20 d后,分别调查病害严重度并计算生防效果。
病害调查与评估参照卢芳[20]的分级方法:0级为无病症;1级为茎面零星出现直径 0.5~2 mm的褪绿凹陷小斑点;2级为茎面病斑分散,5%
病情指数=∑(病级数×该病级植株数)/(最高病级×总植株数)×100;
防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
2 结果与分析
2.1 各生境细菌的分离
通过对火龙果基地中发病地块、无病地块、发病植株和健康植株的茎秆、根部11个不同生境进行取样分析,共分离到103株细菌,结果详见表1。对不同生境分离得到的细菌种群密度和数量进行分析,发现不同生境存在差异,其中发病地块病株健康根部细菌的种群密度最高,达到8×106cfu/g,其次为发病地块病株健康茎秆部位,种群密度为6.5×106cfu/g,最低的为发病地块健康植株茎秆部位,种群密度为5×105cfu/g。菌株数量方面,无病地块健康植株根部分离的数量较多,占总分离数的15.53%,发病地块根际土较少,占4.85%。
2.2 拮抗菌株的筛选
采用平板对峙法,初筛到15个菌株对火龙果溃疡病菌具有一定拮抗作用,所占比例为14.56%,其中抑菌带宽度最大的是10-4-6菌株,其抑菌带宽度为4.62 mm。抑菌带宽度≥3 mm的菌株有8株,占总菌株数的7.76%(表2)。
通过对复筛试验结果的测量和观察(图1、图2)发现,初筛具有拮抗活性的15株菌中,拮抗性强的有7-6-1、11-6-5、7-1-5、7-2-3、10-3-3等5株,连续培养5 d后抑菌带宽度仍>0.5 mm,占总拮抗菌株数的33.33%,占总分离数的4.85%;拮抗性中等的有7-5-2、8-4-6、10-4-4、12-4-3等4株,5 d后抑菌带宽度<0.5 mm,占总拮抗菌株数的26.67%,占总分离数的3.88%;拮抗性弱的有5-5-5、4-6-6、6-6-1、13-4-7、11-6-2、10-4-6等6株,培养5 d后抑菌带基本消失看不见,占总拮抗菌株数的40.00%,占总分离数的5.82%。
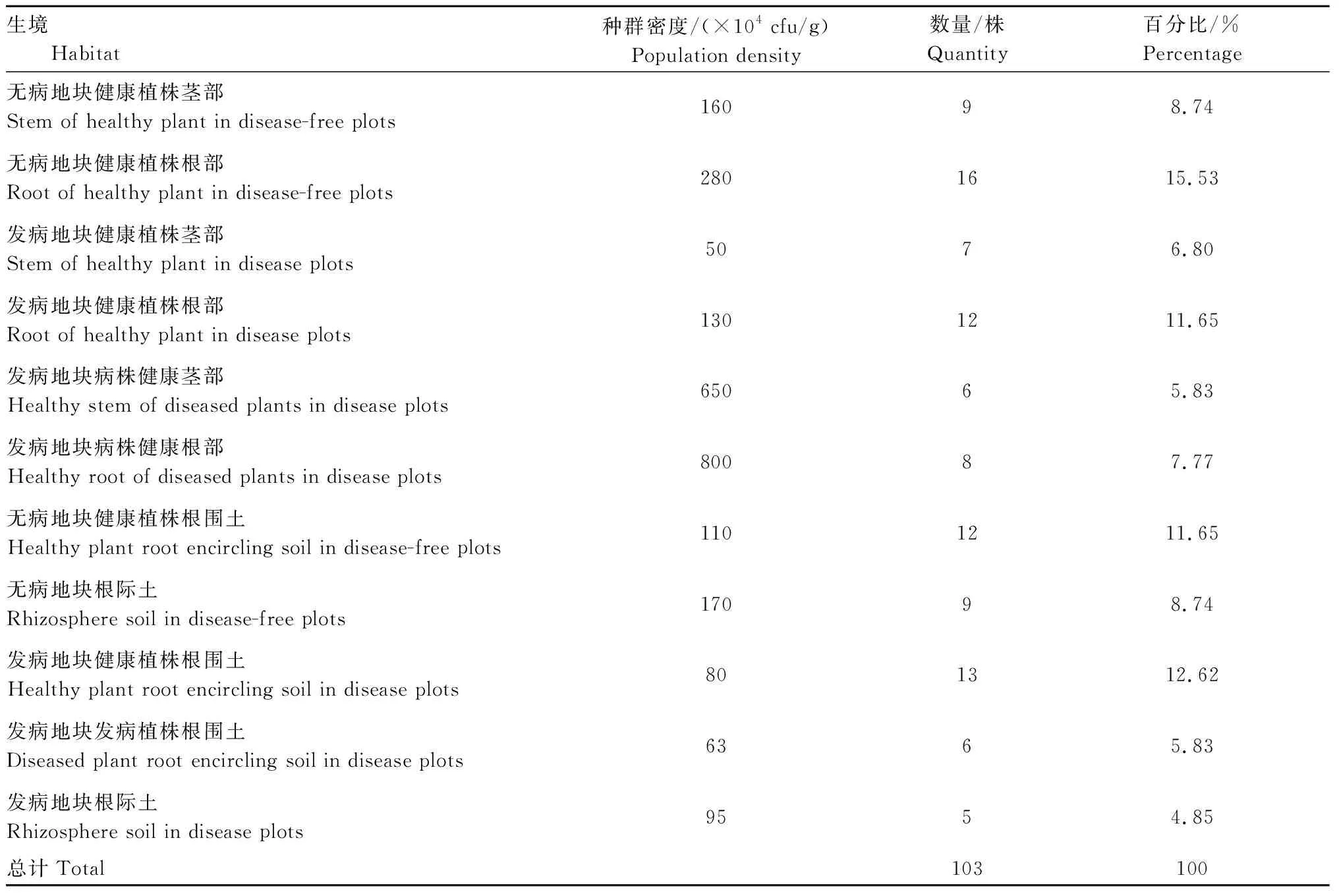
表1 不同生境细菌分离结果Tab.1 Bacteria separation results in different habitats

表2 火龙果溃疡病菌拮抗菌初筛结果Tab.2 Preliminary screening results of antagonistic bacteria against Neoscytalidium dimidiatum
2.3 拮抗菌株产酶与次生代谢物的分析
对所分离的103株细菌进行产酶和代谢物活性测定,结果如图3和表3所示,103株细菌中产纤维素酶的有59株,占总数57.3%;产蛋白酶的细菌有72株,占总数69.9%;产嗜铁素的细菌有69株,占总数66.9%;产吲哚乙酸的细菌有103株,占总数100%;所分离菌株均不产几丁质酶和β-1,3-葡聚糖酶。103株菌株都能产生检测的水解酶或者次生代谢物中的1种或多种,1/2以上能产纤维素酶、蛋白酶和嗜铁素,其中产纤维素酶和蛋白酶的能力基本都为强性,极少数为中性或弱性,而产嗜铁素和吲哚乙酸能力强的细菌较少。
对初筛具有拮抗活性的15个菌株采用赋值的方法进行评价和筛选,结果见表4。统计后,所得总分范围为7~15分,其中7分2株,8分3株,9分2株,10分2株,12分1株,14分3株,15分2株。≥10分的有8株,占拮抗菌的53.33%,占总菌株数的7.77%。其中≥13分、具有较强拮抗潜力的菌株有5个,赋分14分的菌株编号为7-6-1、10-3-3、11-6-5,赋分15分的菌株编号为7-1-5、7-2-3。

图1 火龙果溃疡病菌拮抗菌复筛结果

右边部分为对照 The right part is the control

A:蛋白酶;B:几丁质酶;C:β-1,3-葡聚糖酶;D:嗜铁素;E:纤维素酶;F:吲哚乙酸

产酶及代谢物能力Power to produce enzymes and metabolites产酶的菌株数(百分比)Strains producing enzymes(percentage)纤维素酶Cellulase蛋白酶Protease几丁质酶Chitinase葡聚糖酶Glucanase产代谢物的菌株数(百分比)Strains producing metabolites (percentage)嗜铁素Siderophore吲哚乙酸Indole acetic acid强Strong56(54.3%)62(60.1%)0(0)0(0)8(7.7%)23(22.3%)中Medium2(1.9%)2(1.9%)0(0)0(0)29(28.1%)48(46.6%)弱Weak1(0.9%)8(7.7%)0(0)0(0)32(31.1%)32(31.1%)总数Total59(57.3%)72(69.9%)0(0)0(0)69(66.9%)103(100%)

表4 火龙果溃疡病菌拮抗菌株的赋值评价与筛选Tab.4 Assignment evaluation and screening of antagonistic strains to Neoscytalidium dimidiatum
2.4 拮抗菌株的温室防效测定
结合初筛、复筛以及赋值评价结果,选择其中效果比较明显的10株菌进行温室盆栽防效测定,结果见表5。经过连续10~20 d观测,防效较好的拮抗菌株为7-6-1和10-4-6,平均防效分别为50.41%、48.85%,其次为8-4-6,平均防效为40.49%。防效较差的菌株为10-4-4、11-6-5,平均防效分别仅为29.88%、20.52%。
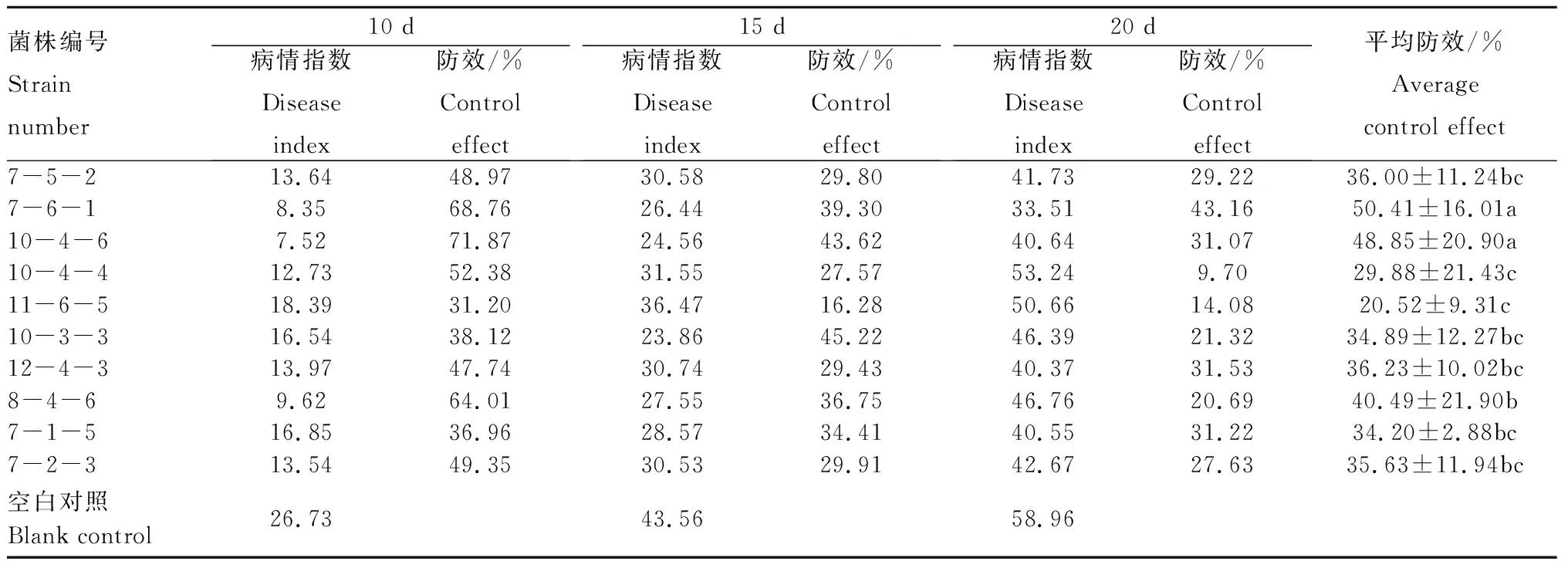
表5 拮抗菌对火龙果溃疡病菌的温室防效Tab.5 Greenhouse control effect of antagonistic bacteria on Neoscytalidium dimidiatum
注:不同小写字母表示差异显著(P<0.05)。
Note:Different lowercase letters indicate significant difference(P<0.05).
3 结论与讨论
火龙果溃疡病作为一种高发的世界性病害,严重影响火龙果的品质和产量,进而会给国内外的火龙果产业造成巨大的危害。病原学研究表明,火龙果溃疡病原菌在自然界中主要通过无性孢子蔓延与传播,高温高湿的环境有利于其发病[2-4]。目前,通过室内药剂筛选得到一些对其有很好抑制作用的化学药剂,但在大田防控时并没有表现出很好的防治效果,尤其是在老化果园,很难有效控制该病的发生和蔓延[7-9],为了能长期有效控制该病害,可以通过施用拮抗菌剂改善火龙果的微生态环境。
关于生防菌的分离筛选,从寄主植物生境中获取是主要的途径之一,而且从根围土中分离的菌株防效更为持久和稳定,已知从土壤中分离获得对火龙果溃疡病菌拮抗效果较好的菌株主要为皮氏类芽孢杆菌[21-24]。本试验中,发病地块病株健康根部细菌的种群密度最高。从火龙果种植地块的11个不同生境分离菌株后,通过对峙培养法测定和赋值评价,最终优选出10株菌株进行了温室防效测定。虽然平均防效最高达50.41%,但随观测时间延长,防效均出现逐渐降低现象,同样的现象在复筛过程中也出现,随着观察时间延长,相对应的抑菌带宽度逐渐减小,这些将影响拮抗菌对病原菌的持续拮抗性。新暗色柱节孢属半知菌类节格孢属真菌,相关研究表明,多数芽孢杆菌类生防菌对半知菌类真菌均有一定拮抗作用[21-23],然而在实际生产中可有效防控火龙果溃疡病的生防菌较少。本试验所分离得到的15株拮抗性菌株中,温室盆栽平均防效>40%的有3株,而在10 d防效>40%的有7株,经过进一步鉴定与发酵条件优化,可为该病害的防控提供有效的生防材料。拮抗菌对火龙果溃疡病菌的温室平均防效偏低,主要原因在于没有进行多次喷施,在以后的试验中可以改进。
