干扰素基因刺激蛋白相关婴儿期发病血管病变1例并文献复习
2019-08-23闫秀丽宋桂华王玲玲
张 岩 闫秀丽 孟 晨 宋桂华 王玲玲
1 病例资料
男,11岁4月,因“反复咳嗽伴活动耐力下降10年余,发现间质性肺部病变10 d”于2018年7月4日收入济南儿童医院(我院)呼吸介入科。
患儿于1岁后出现反复咳嗽,运动后呼吸费力,不喜动,其后每年有6~8次呼吸道感染病史,均表现为“发热、咳嗽、咳痰”,抗感染治疗后好转。平素活动后易疲劳、气促。10 d前患儿再次出现发热、咳嗽和气促,至当地医院查胸部X线片提示“间质性肺炎”,经头孢他定抗感染治疗后体温正常,但气促无明显好转,遂收入我院治疗。
家族史:父母体健,非近亲婚配,否认家族性遗传性疾病史。姐姐,22岁,身体健康。
入院查体:T 36.6℃,呼吸28·min-1,心率110·min-1,血压110/72 mmHg,体重30 kg。肤色略发黑,皮肤黏膜无溃烂及皮疹,无肢端溃疡,胸廓前后径增大,左侧胸壁较右侧隆起,呼吸节律规整,三凹征阴性。双肺听诊呼吸音粗,可闻及中小水泡音,心音有力,各瓣膜听诊区未闻及杂音,肝脾肋下未触及,双手、双足可见杵状指(趾)伴肢端发绀(图1)。
实验室检查:血常规WBC 13.7×109·L-1,RBC 4.5×1012·L-1,Hb 119 g·L-1,PLT 327×109·L-1,嗜酸性粒细胞(EOS)0.1×109·L-1,CRP 16.1 mg·L-1。ESR 100 mm·h-1。尿常规、粪常规和生化检查均未见异常。TSPOT、G试验、GM试验、肺炎支原体抗体、肺炎衣原体抗体和腺病毒抗体均阴性。体液免疫:IgA 3.75 g·L-1,IgG 22.7 g·L-1。T细胞亚群未见异常。类风湿相关因子均阴性。抗ds-DNA阴性,ANA阳性(1∶100),抗心磷脂抗体阳性(1∶100)。

图1 患儿长杵状指(趾)伴肢端发绀
影像学检查:超声心动图提示肺动脉瓣轻度反流,右室流出道内探及局限性肺动脉瓣红色返流束,流速1.7 mm·s-1,肺动脉压力12 mmHg,射血分数(EF) 71%。心脏CTA未见异常。肺部高分辨CT提示符合间质性肺炎,并局限性肺气肿、肺大泡形成(图2)。支气管镜肺泡灌洗液常规:巨噬细胞20%,淋巴细胞22%,中性粒细胞58%。经气管镜取右肺下叶及上叶肺组织行病理检查提示:可见较多厚壁畸形血管,血管壁明显增厚,管腔狭窄,考虑为肺血管异常所致的间质性病变(图3)。
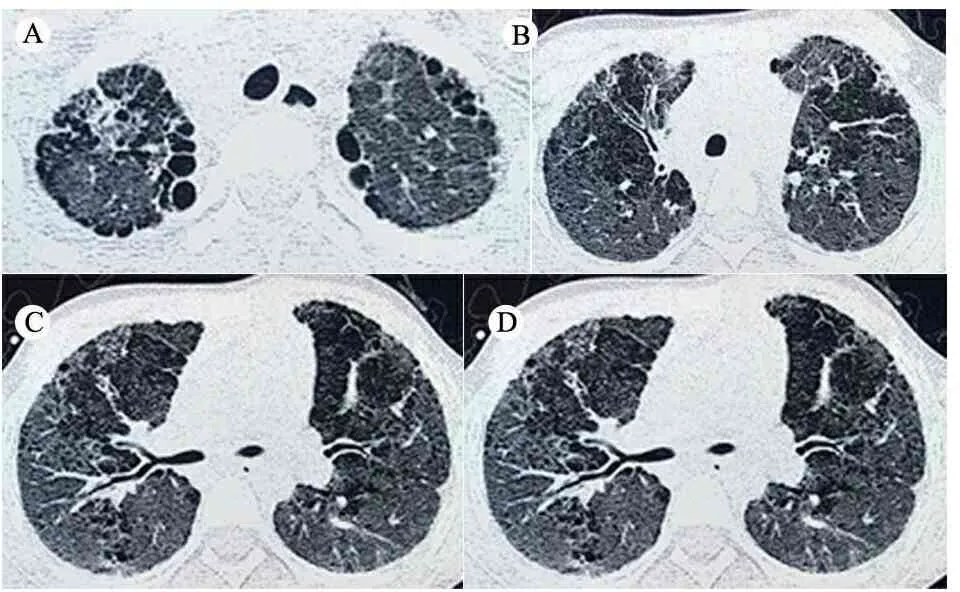
图2 胸部CT

图3 肺组织病理
注 A:(HE×100);B:(HE×200);C:CD34染色(+)
诊疗经过:患儿入院后继续给予头孢他定抗感染治疗,考虑患儿间质性肺炎,经患儿家属同意,给予经验性强的松片(60 mg·d-1)治疗2周,患儿临床症状较前无明显好转,仍有气促和乏力,运动后加重,遂激素逐渐减停。
入院2周,经患儿家属知情同意行患儿及其父母全外显子测序(WES),结果提示:患儿TMEM173基因有1个杂合突变:c.463G>A,导致氨基酸改变p.V155M为错义突变(图4)。蛋白功能预测软件SIFT、PolyPhen2和REVEL的预测结果均为有害。HGMD数据库已报道与干扰素基因刺激蛋白(STING)相关婴儿期发病血管病变(SAVI)相关。经家系验证分析,患儿父母亲均未检测到该位点变异。此变异为自发突变,该位点为致病性变异。
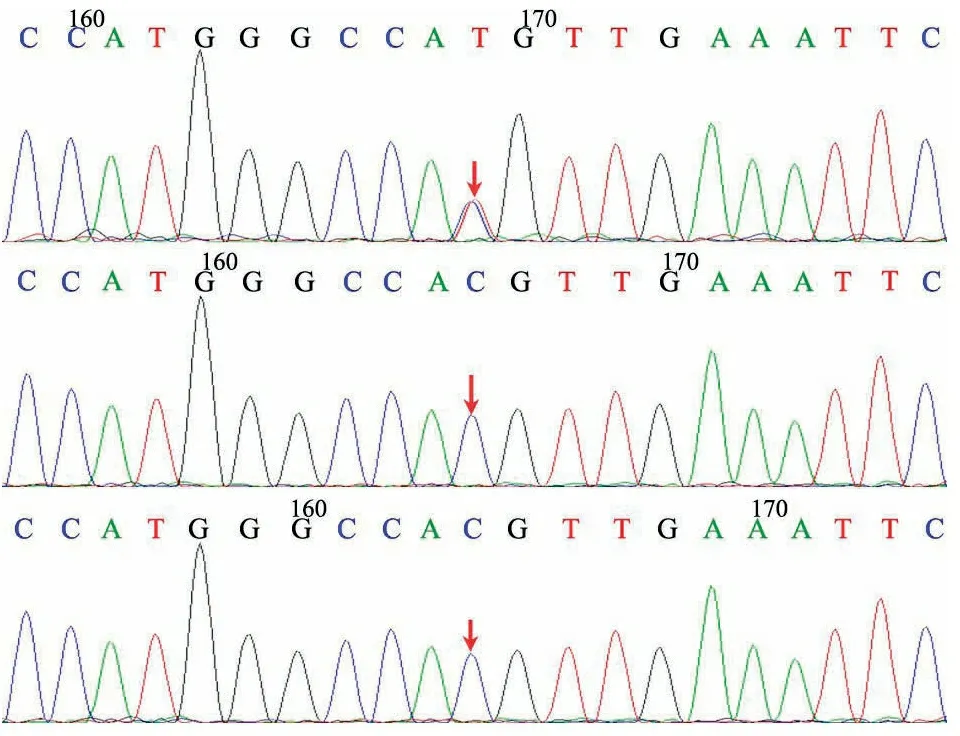
图4 从上往下依次为患儿、患儿父亲及患儿母亲TMEM173基因c.463G>A参照序列
根据基因检测结果,患儿家长自购Janus激酶(JAK)抑制剂托法替尼(每次5 mg,每天2次)试验性用药,服用1周后电话随访,家属自诉患儿气促较前明显好转,服用2周后可进行慢跑运动,嘱其定期复查肺部影像学,现随访中。
2 结果
以(干扰素基因刺激蛋白 OR 自身炎症性疾病 OR 干扰素通路疾病)为检索式,检索CNKI、万方和维普数据库,以(STING OR “STING-associated vasculopathy with onset in infancy OR SAVI”)为检索式检索PubMed和EMBASE,检索时间均为建库至2019年4月31日。经过剔除重复文献及病例,共14篇文献报道SAVI,中文1篇,英文13篇[1-14],共30例。合并本文1例,目前共有31例SAVI报道,临床资料总结见表1。
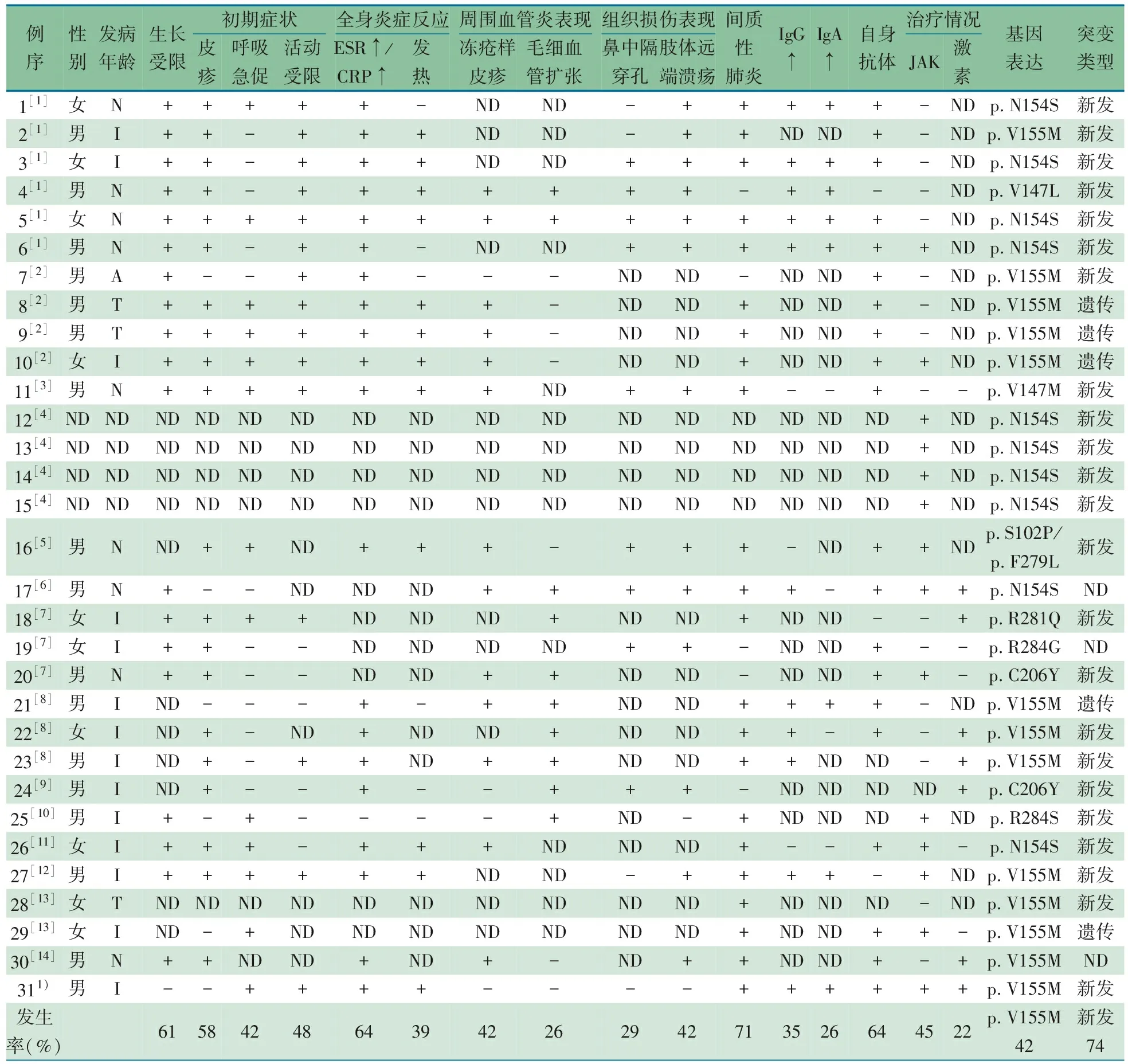
表1 31例干扰素基因刺激蛋白相关婴儿期发病血管病变患者病例总结
注 T:青少年;I:婴儿期;N:新生儿期;ND:未描述:+:发生;-:未发生;1):本例;发生率=发生人数/总病例数×100%
31例SAVI患儿,男∶女为1.7∶1,发病年龄以婴幼儿为主。61.2%患儿均有不同程度的生长发育受限,首发症状以皮疹(58.0%)、呼吸急促(41.9%)及活动受限(48.3%)为主,部分表现为周围血管炎,如出现冻疮样皮疹(41.9%)、皮肤扩张毛细血管炎(25.8%),组织损伤的表现,如鼻中隔穿孔(29.0%)、肢体远端溃疡(41.9%);38.7%的患儿出现反复发热,64.5%伴有ESR增快或CRP升高,64.5%出现自身抗体阳性。70.9%患儿肺部影像学检查提示为间质性肺炎改变。SAVI相关的基因突变位于第5号染色体上的TMEM173基因,目前发现的致病突变位点有p.S102P、p.F279L、p.V147L、p.V147M、p.N154S、p.V155M、p.C206Y、p.R284Q、p.R284G,p.R284S,其中以p.V155M(41.9%)居多,74.1%为新发突变。
3 讨论
SAVI是一种由单基因遗传的自身炎症性疾病,为Ⅰ型干扰素通路疾病[15]。2014年Liu等[1]首次报道了6例SAVI患儿,临床特点为全身炎症反应,ESR和CRP明显增高,重度皮肤血管病变导致广泛组织损害。
STING 蛋白又称为跨膜蛋白173(TMEM173)、ERIS、MPYS或 MITA,是新发现的一种具有调节天然免疫功能的关键蛋白分子[16-18]。STING在髓样细胞、自然杀伤细胞、外周淋巴组织的 T 细胞和单核细胞中高表达,在心脏、肺脏、卵巢、视网膜、骨髓、阴道及平滑肌等中亦高表达。STING在细胞内微生物核酸(尤其是双链DNA)诱导的固有免疫反应中起着重要作用,同时对细胞质内的自身核酸成分也能起识别反应。这些DNA成分可能是造成各种自身免疫性疾病的原因,如SLE、幼年类风湿关节炎、炎症性肠病、AicardiGoutières综合征及一些炎症相关的肿瘤性疾病等[19]。SAVI是由于TMEM173基因突变,导致STING处于组成型激活状态,即使细胞内缺乏游离DNA的刺激,STING/IFN信号通路也持续激活,致使该类患者的单核细胞、成纤维细胞过量产生Ⅰ型干扰素,内皮细胞凋亡,从而引起早发的系统性炎症、皮肤血管病变及肺部炎症[1]。
总结目前国内外已报道的31例SAVI病例(包括本文1例),皮肤损伤(58.0%)是SAVI早期常见的症状之一,多表现为面部皮疹,常可累及耳廓、鼻尖、颊部和肢端等部位,严重者可导致肢端坏死(41.9%)和鼻中隔穿孔(29.0%)等。另有文献报道指甲营养不良或缺失、皮肤扩张毛细血管也可能是SAVI的早期预兆[1,3,6]。气促也是早期常见的症状(41.9%),随着年龄的增长,患儿耗氧量增加,后期表现为活动受限(48.3%)比例增高,肺部HRCT主要表现为间质受累(70.9%),是部分患儿死亡的重要原因之一[2]。64.5%的病例表现为ESR增快或CRP升高,另有患儿表现为IgG(35.4%)、IgA(25.8%)升高及自身抗体阳性(64.5%),这些都是炎症反应的主要临床表现,虽不能作为诊断SAVI的直接证据,但亦可作为本病的主要诊断要点之一。本文患儿的临床特征主要表现为呼吸费力及活动受限,肺部呈间质性肺炎改变,以呼吸系统病变为主,并没有周围血管炎及组织损伤表现,且本次发病前未行肺部影像学相关检查,也给本病的早期诊断带来了困难,依靠WES检测发现TMEM173基因突变以确诊。激活的TMEM173基因突变可以导致SAVI的发生,目前发现的致病突变位点共有10个,以p.V155M(41.9%)最多见,突变类型以新发突变为主(74.1%)。
SAVI早期可被误诊为自身免疫系统疾病,如SLE,因为SLE也与Ⅰ型干扰素通路密切相关[20-22],早期两者均伴有发热、皮疹、炎症指标(如ESR、CRP)异常升高,部分患儿伴有间质性肺疾病改变,且因SAVI发病率极低,故临床对于这些病例首先想到的是SLE,而非SAVI。目前报道的30例病例中,6(20.0%)例给予了糖皮质激素经验性治疗,但疗效欠佳,故糖皮质激素治疗无效可能作为SAVI诊断的一个重要参考指标。
结合SAVI发病机制,Ⅰ型干扰素起了主要作用,通过激活JAK诱导干扰素刺激基因表达,导致疾病的发生,故JAK抑制剂如鲁索替尼、托法替尼和巴瑞克替尼可能有望控制该类疾病。有文献报道[4],患者使用JAK抑制剂后,可致环磷酸鸟苷-环磷酸腺苷(cGAMP)激活的纤维母细胞产生β干扰素减少,从而起到治疗作用。国内于仲勋[12]报道了1例14岁男性SAVI患儿,给予口服托法替尼(每次5 mg,每天2次)2 d后,心率及脉氧症状改善,2周后活动耐受力明显较前好转。本文患儿使用托法替尼后,症状亦得到明显改善。
本文通过报道1例SAVI患儿及文献复习,发现SAVI男性多发,以婴幼儿为主。首发症状以皮疹(60.0%)、呼吸急促(43.3%)及活动受限(50.0%)为主。实验室检查多伴有炎症指标升高及抗核抗体阳性。70.0%患儿肺部影像学检查提示为间质性肺炎改变。临床易易误诊为SLE,基因检查可明确诊断。JAK抑制剂治疗有效。
