植物bZIP转录因子家族的研究进展①
2019-08-23王金英潘介春张树伟杨亚涵范志毅李琳王
王金英 丁 峰 潘介春 张树伟 杨亚涵 黄 幸 范志毅李 琳王 颖
(1广西大学农学院 广西南宁530004;2广西壮族自治区农业科学院园艺研究所 广西南宁530007)
bZIP转录因子基因家族极大[1],在真核生物中广泛分布、相对保守,在人、动植物、微生物中均有发现[2-3],有关bZIP的研究相对较多。目前,在部分植物中发现大量bZIP转录因子,如模式植物拟南芥,进一步研究发现,它们在植物生长发育、应对胁迫中起重要作用[4-5]。本文对植物bZIP转录因子的分类、结构及其参与的植物发育过程、次生代谢调控以及逆境胁迫应答等方面进行综述,希望能够为今后更加深入地研究和利用bZIP家族提供理论基础。
1 bZIP转录因子结构特征
bZIP转录因子由一个碱性区域和一个亮氨酸拉链结构组成,其中碱性区域相对保守,约由20个氨基酸残基组成,它能够通过固定的核定位信号结构N-(X)7-R/K与DNA顺式原件特异性结合(图1)。亮氨酸拉链结构域不保守,同时含有大量疏水残基,疏水残基一般位于第3和第4位;亮氨酸拉链结构域的N末端与酸性区域密切相连。
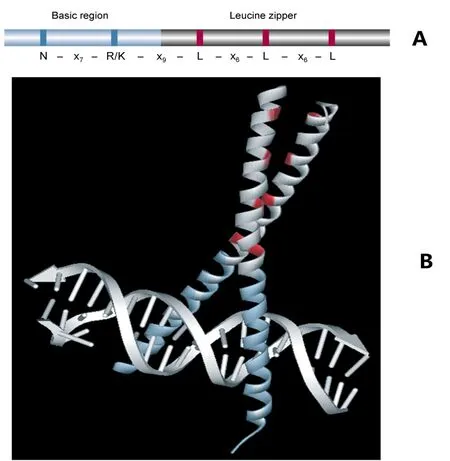
图1 bZIP转录因子基本结构域组成(A)以及GCN4 bZIP结构域与DNA结合的三维结构图(B)[6]
2 bZIP转录因子的功能多样性
根据基因进化对bZIP转录因子进行分类,在被子植物中将不同类型的bZIP亚家族分为2大分支 (图2) 。Luiz等[7]认为,在功能上可将bZIP转录因子家族主要划分为4个原始bZIP亚族,不同亚族分别行使不同的功能,包括参与逆境胁迫、种子发育、病菌防御、光信号转导、调控维管发育等作用。近年来,研究发现bZIP还参与多种生物学进程,如器官和组织分化[8]、非折叠蛋白响应[9]、激素和糖信号传导过程[10]以及非生物胁迫响应[11]。其中,A亚族主要参与ABA和逆境胁迫的调控表达,C亚族主要参与种子发育和病菌防御,D亚族参与病害防御和生理生长,G亚族参与光信号调控,H亚族在光合作用过程中起关键作用。为了适应新环境,10个或13个bZIP转录因子亚家族在4大原始亚族的基础上形成[12],而且随着分子生物信息学研究的不断深入,基于转录组水平对转录因子的鉴定技术也越来越成熟。bZIP家族基因已在水稻和拟南芥等中被鉴定并分类[13]。

图2 被子植物中bZIP转录因子的进化[7]
3 真核生物中bZIP转录因子的分布及数量
目前人类对拟南芥、水稻等物种的全基因组测序已经完成,bZIP基因在真核生物中分布较多,但在不同真核生物中bZIP转录因子的分布也存在差异。勒正伟等[13]报道称,在线虫中含有31个bZIP基因,果蝇有27个基因,人类有56个基因,酵母中有17个基因;而在植物中,目前鉴定的高粱含有92个基因、蓖麻含有49个基因、拟南芥含有75个基因、玉米含有125个基因、大豆含有131个基因等。Agni等[14]研究发现,水稻基因组中bZIP基因模型的数量预测分别为:粳稻含有140个基因,籼稻94个基因。
4 bZIP转录因子参与的植物发育过程
在植物中,bZIP转录因子组成了最大的ABA诱导DNA结合蛋白家族,对植物生命周期的所有阶段基本都有影响,它们已经被证明可以调节植物生长发育进程,如种子发育、光信号传递、花发育、生物和非生物胁迫、ABA信号和激素反应。
bZIP53蛋白是拟南芥种子成熟和胁迫反应的关键调节因子。Prateek等[15]采用等温循环二色性(CD)研究来量化bZIP53和5个A-ZIP53s之间异质二聚体形成时的结构变化,通过电泳迁移率转移法(EMSA)和荧光偏振法(FP)的研究发现,A-ZIP53和bZIP53混合物形成了异质二聚体,无法与DNA结合;时间位移动力学研究表明,A-ZIP53s取代DNA-bound bZIP53的等级次序为A-ZIP53<A-ZIP53(A→E) < A-ZIP53(N→A) < A-ZIP53(R→E)< A-ZIP53(A→E, N→A)。
Hardtke等[16]发现,在光条件下HY5突变苗能够促进光形态发生,而在黑暗条件下生长的野生型幼苗,则会有胚轴伸长、子叶发育不良且多个光诱导基因表达减少的现象。HY5能够与启动子中的G-box结合,直接调控部分基因的表达。在黑暗条件处理下的拟南芥中,HY5蛋白通过与COP1的WD40结构域相作用而被靶向降解;一小部分HY5由于在CKII位点被磷酸化而免于降解,但其激活电位较低。当幼苗接受光照时,COP1从细胞核中输出,HY5蛋白积累;此外,CKII活性降低,新合成的、未磷酸化的HY5具有很高的活化潜力,这导致光诱导的HY5靶基因能够快速活化。Jakoby等[6]研究表明,一些I组bZIPs可能调控植株发育。Fukazawa等[17]发现,烟草RSG基因在韧皮部特异表达,同时能够激活赤霉素生物合成途径中的GA3基因,但由于RSG显阴性而使GA3启动子无法被活化,因此,赤霉素的合成量减少并且转基因植株也相对矮小。Yin等[18]从水稻中分离出RF2a,与RSG显阴性的烟草植株一样,水稻RF2a的沉默株系也表现出矮化的现象,这也可能是在赤霉素生物合成过程中受到影响。Ringli等[19]研究发现,番茄VSF-1能够激活编码细胞壁结构蛋白的基因。Mitsutomo等[20]研究表明,bZIP转录因子FD的活性能够促进植物开花,FD与开花关键基因FT互作,进一步调控下游花分生组织基因的表达。Rosario等[21]研究发现,在双子叶植物中,TFs转录因子在种子成熟过程中起关键作用。Hartings等[22]研究发现,玉米(Zea mays) op2(O2)是第一个被克隆并证明是TF基因的基因。Onate等[23]研究发现,小麦和大麦的同源基因也发挥着与O2相同的作用。
5 bZIP转录因子参与植物次生代谢调控
王德军[5]研究表明,在渗透胁迫处理下,转MdbZIP48基因拟南芥株系的种子发芽率、子叶绿化率、根长均好于野生型,Agni等[14]研究发现,OsbZIP16在脱水和盐胁迫处理下的水稻幼苗中转录本水平升高,在形态上过表达的植株表现出与WT相似的表型,然而含有OsbZIP16OX的种子在添加甘露醇/盐/ABA培养基培养后,其萌发率高于含WT的种子。在种子发育过程中bZIP53比靶基因先表达,并与靶基因重叠。Rosario等[21]研究表明,bZIP53蛋白的数量与MAT基因表达之间存在相关性。bZIP53蛋白在体内外能够与启动子中的G-box元件特异性结合,同时与bZIP10或bZIP25相互作用,这就显著增强其与DNA的结合活性,同时增加了靶基因的转录。bZIP53与拟南芥种子中重要的转录调控因子ABI3无相互作用,而bZIP异源二聚体与ABI3之间的三元复合物的形成增加了植物MAT基因的表达,因此证明了C组bZIPs(如bZIP10和bZIP25)先与S1组bZIPs相互作用,特别是C/S1网络的成员参与了能量稳态氨基酸代谢压力反应和sinkspecific基因表达。这些异质二聚体能够传递其与靶基因之间的协同激活特性,表明异质二聚体是一种有效的信号集成机制。
6 bZIP转录因子参与生物与非生物胁迫应答
作为bZIP转录因子中的一个较大亚族S族,在非生物胁迫响应、病虫害的防御以及糖类信号转导中起着重要的作用。Rook等[24]研究发现,光照处理下,ATBZP11/ATB2基因在高碳水化合物的组织和维管组织中的表达显著增高。同时发现将黑暗中的幼苗转移到光照条件下时,可以诱导ATB2的表达。ATB2基因可以转录出一段前导序列,其中包含3个上游开放阅读框,在有蔗糖存在的条件下可以转录,起到保持碳水化合物平衡的作用。在植物研究中,Strathmann等[25]发现,S亚族中的基因在各种非生物胁迫下可以激活转录调控,如调控花分生组织基因进行特异性表达。Crawford等[26]发现,受到病虫害的侵袭后,胡椒中的CAbZIP1转录因子在防御和非生物胁迫响应中起着重要的调控作用。此外,Weltmeier等[27]研究发现,在高盐胁迫、ABA诱导或渗透胁迫下拟南芥中的AtbZIP2转录因子的转录水平均下调,这表明S亚族中的转录因子不仅在蔗糖诱导下行使其相关功能,还很有可能调控其他信号传导途径。
Xue等[28]研究发现,在陆地植物的主要类群中存在一些高度保守的氨基酸残基,表达图谱分析表明bZIP基因可能与创伤反应有关,并建立了一种表达模式,模式显示在创伤后不同时间间隔内位于89至715蛋白中分离的77个基因序列独立表达。刘莉等[3]利用RT-qPCR技术在胁迫和激素处理条件下对OsbZIP16进行表达分析,得到了微阵列图谱,结果表明在非生物胁迫条件下OsbZIP16被强烈诱导。在植物激素检测中发现,只有ABA对OsbZIP16的表达有诱导作用。Lu等[29]发现,OsbZIP家族中的成员OsbZIP12和OsbzIP72也受ABA诱导和调控。故OsbZIP16可能参与了非生物胁迫和ABA相关途径,尤其是在干旱和盐胁迫条件下。
GsbZIP67蛋白具有保守的bZIP结构域,属于S2 bZIP组,目前研究较少。Wu等[30]研究表明,GsbZIP67靶向于拟南芥原生质体,同时可在酵母细胞中显示出转录激活活性。实时荧光定量PCR分析揭示了野生大豆GsbZIP67的盐胁迫响应表达和组织特异性表达。在碱性胁迫下,GsbZIP67过表达促进了植株的生长;此外,GsbZIP67过表达也改变了转基因苜蓿在碳酸氢盐胁迫下的生理指标,证明了GsbZIP67是植物耐受碳酸氢盐碱性胁迫的积极调节因子,这将有助于进一步研究GsbZIP67在胁迫反应中获得顺式元件和下游基因的表达模式。Ji等[31]分析了CrebZIP基因的结构和染色体定位,莱卡菌在盐胁迫下细胞生长缓慢,光合作用减弱,脂质积累增多;同时,在盐胁迫下6个CrebZIP基因的表达谱发生了显著变化,说明部分CrebZIP基因可能在调节光合作用和脂质积累中发挥重要作用。
Preeti[32]等共鉴定了191个bZIP转录因子小麦,其中对TabZIP(Traes_7AL_25850F96F.1)进行详细分析,了解其在不同非生物胁迫条件下的反应,基因表达结果显示,TabZIP在不同的逆境胁迫下(高温、干旱、盐胁迫)表达存在差异,同时bZIP可能在其中各种应力缓解机制中起作用。过表达的TabZIP能增强转基因拟南芥耐盐碱、干旱、高温、氧化胁迫的能力。因此TabZIP可以作为一个候选基因,可以改善作物对温度和其他非生物胁迫的耐受能力,在胁迫条件下可以提高作物产量。
Yang等[33]研究表明,ABF类的亮氨酸拉链转录因子TabZIP60能够介导小麦利用氮素,当缺氮的小麦植株暴露于硝酸盐中时TabZIP60的表达会受到抑制;通过RNAi去除TabZIP60能够提高谷氨酸合酶活性、增加侧根分枝数量和穗数、加速N吸收、提高粮食产量;而过表达的TabZIP60-6D则会起到相反作用。TabZIP60与启动子TANADH-GOGAT-3B能诱导负调控的表达,因此,TabZIP60介导的小麦生长和氮素利用与其对TaNADH-GOGAT表达的负调控有关。这些研究结果表明,TabZIP60和TaNADH-GOGAT之间的相互作用在调节N的使用和小麦的生长发育中起着重要作用,为氮素利用和提高产量提供了有价值的依据。
7 bZIP转录因子参与非生物信号传导
目前,研究最多的bZIP转录因子为A亚族成员,它们可以在逆境胁迫条件下调节其下游基因的表达。Kang等[34]通过分子技术全面研究了ABF3/ABF4在干旱和盐胁迫中的作用,研究结果表明,拟南芥中ABF3或ABF4可提高植株耐旱能力。在胁迫条件下,bZIP转录因子可以与ABA诱导基因启动子区域的ABRE结合来调节下游靶基因的表达。干旱、高盐或外源脱落酸能诱导内源脱落酸的合成,ABRE中存在许多ABA诱导基因的启动子序列,具有与bZIP蛋白相结合的序列,它们相互作用诱导下游多种耐盐和耐旱的抗逆性基因表达。目前,从植物中已经分离出多种能够和ABRE相互作用的bZIP转录因子,如烟草TAF-1、水稻OsBZ8、TRAB 1、拟南芥ABF1-4、玉米ABP9、大麦HvAB15和HvVPI等。Choi等[35]用酵母 One-Hybrid的方法,克隆了拟南芥ABF/AREB bZIP类转录因子,其成员分 别 为 ABF1、 ABF2/AREB1、 ABF3、 ABF4/AREB2。Class等[36]筛选出的OSBZ8基因编码的蛋白能与ABA部分基因中的G-box特异结合。Xiang等[37]研究发现,OsbZIP23转基因水稻,在干旱胁迫下体内ABA依赖型OsbZIP23超量表达,明显提高植株的耐旱性。
Chang等[38]通过共表达分析鉴定了1种在不同发育时期对光有特殊表达模式的bZIP转录因子CaLMF,CaLMF是CPT生物合成的负调控因子,并且发现CaLMF对CPT生物合成基因(CaTDC1、CaG80、CaCYC1、Ca7DLS)的表达具有负调控作用,故CaLMF可能参与了光信号转导,通过下调CPT生物合成基因的表达而抑制CPT生物合成,Chang等[38]也进一步证明了CaLMF是抑制CPT生物合成基因表达的关键光信号元件。
Smith 等[39]研究发现,TaABF1 蛋白在 S36D、S37D、S113D、S115D这4个位点的磷酸化增加了TaABF1的转录调控活性。根据磷酸化的位点和模式,TaABF1磷酸化既可以刺激也可以抑制TaABF1调控下游基因的活性。突变的S318和S322(在bZIP域中)消除了TaABF1激活HVA1的能力,但是对TaABF1下调Amy32b的能力没有影响,说明Ta-ABF1通过一种间接的DNA结合机制抑制Amy32b的表达。同时也发现ABA或TaABF1诱导的HVA1不受GA的抑制。
8 总结与展望
bZIP转录因子在真核生物中广泛分布并且相对保守。近年来,相关学者对bZIP的表达、植物抗逆性等方面进行了研究。随着研究的不断深入,研究人员已经确定了bZIP转录因子在植物生长以及逆境胁迫中的重要作用,它能够参与植物组织的分化、延伸细胞、提高病害防御能力,进行能量代谢及信号转导、参与光反应及对蛋白进行调控等过程,并且在胁迫条件下,还能促使内源ABA的合成,从而激活bZIP家族基因。这些研究结果为人类通过相应的分子或生理技术提高作物产量、改善作物生长发育状况以及提高植物抗逆性提供了新的思路,对实际应用有重要意义。
目前关于bZIP转录因子家族的研究仍然存在一些不足。首先,研究仅停留在少数物种中,未来应该在更多的物种中进行bZIP转录因子的分析鉴定;其次,关于bZIP是如何介导下游标靶基因表达及其参与的信号转导通路研究较少,与此同时,bZIP参加了许多逆境胁迫,但关于bZIP转录因子在分子育种方面的作用研究亦较少,并且已经投入实际应用的转基因材料也鲜有报道,还需后续深入研究。随着基因工程技术的不断发展,应用也越来越普遍,这使使得研究不断深入细化,为研究转录因子的功能提供了极大的便利,使得转录因子在分子育种中的应用成为可能。
