鸡肾脏对微囊藻毒素-LR氧化胁迫的响应
2019-08-22张大文袁丽娟张莉向建军廖且根罗林广邱素艳
张大文,袁丽娟,张莉,向建军,廖且根,罗林广,邱素艳
江西省农业科学院农产品质量安全与标准研究所,江西 南昌 330200
湖泊富营养化引起的蓝藻水华暴发已经成为一个世界性的水环境问题,近年来呈现出大范围、高频次、高生物量的特征(Huisman et al.,2018)。由其中部分水华蓝藻产生的一系列生物毒素对水生态系统和人类健康的危害已成为水环境研究的焦点(Buratti et al.,2017)。自然水体最常见、毒性较大的生物毒素为微囊藻毒素(Microcystins,MCs),迄今为止已发现了100多种MCs的同分异构体(Puddick et al.,2015),其中最常见的是微囊藻毒素-LR(MC-LR)(Buratti et al.,2017)。MC-LR腹腔注射小白鼠的半致死剂量(LD50值)一般在50-60 μg·kg-1体质量(bm)之间,其毒性与化学类有机磷神经毒剂相当(Kuiper-Goodman et al.,1999)。
我国富营养湖泊中蓝藻生物量巨大,以大型淡水湖泊为例,据统计,巢湖水华暴发总蓝藻量(干重)可达 50-70万吨(蒋雪英,2000),滇池中每年可用于资源化的蓝藻量(干重)约为5000 t(周婧斐等,2011)。如此巨大资源的利用已经是一个亟待解决的问题。蓝藻细胞虽然能产生一系列的生物毒素,但是其营养成分丰富,营养价值较高。天然蓝藻中有机质达65%以上,藻泥的蛋白质含量达40%,与大豆的蛋白质含量相当,同时具有丰富的氨基酸和维生素,营养价值极高(丁艳华,2008;许玲等,2010;杨苏等,2006),是优质的饲料蛋白源和饲料添加剂。
已有研究表明,MCs能过诱导细胞产生氧化胁迫,并进一步造成细胞损伤,这可能是 MCs的致毒机理的一个重要方面(朱枫等,2010)。为抵抗氧化损伤,机体内会有一个抗氧化系统,这个系统会利用酶或非酶机制来对抗氧化压力。这个抗氧化系统的酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)等,而非酶物质主要包括维生素E、维生素E、维生素A、谷胱甘肽(GSH)等(Ming et al.,2012;Prieto et al.,2008)。
然而,目前关于 MCs对动物体的氧化胁迫方面的研究主要集中在鱼类和哺乳动物(Li et al.,2010;Li et al.,2003;Mclellan et al.,2017),MCs对家禽毒性效应的研究基本上是一片空白,仅王春雨(2010)在其硕士论文中初步开展了 MCs对鸭的急性和亚慢性毒性研究以及张晓波等(2011)研究了MCs对鸭胚的毒性和半致死剂量。
肾脏是动物体重要的排泄器官,在MCs的清除过程中起着非常重要的作用。本文采用腹腔注射的方式研究MC-LR对崇仁麻鸡肾脏氧化损伤的影响,为蓝藻在家禽养殖中的饲料化利用提供理论依据。
1 材料与方法
1.1 试剂与仪器
试剂:MC-LR(纯度≥95%,HPLC)购自ZEN-U Biotechnology公司(台湾),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽—S转移酶(GST)、谷胱甘肽(GSH)、考马斯亮兰总蛋白和标准蛋白均由南京建成生物工程研究所提供。
仪器:U-3900紫外-可见分光光度计(HITACHI公司,日本);SH-1000酶标仪(CORONA公司,日本),组织匀浆机;恒温水浴锅;CR22N低温冷冻高速离心机(HITACHI公司,日本);DW-HL218-86 ℃超低温冰箱(中科美菱,中国)。
1.2 试验动物
健康成年崇仁麻鸡,由江西省农业科学院畜牧兽医研究所提供,平均体质量1.15 kg。
1.3 腹腔注射毒性试验
选取124日龄的健康崇仁麻鸡60只,平均体质量为1.15 kg,平均分为4组,每组15只鸡。试验设置3个MC-LR染毒剂量组以及1个对照组。每个 MC-LR染毒剂量组一次性注射不同剂量的MC-LR。注射剂量的选择根据本试验获得的 LD50值进行设定,分别为20(高剂量组,HD),10(中剂量组,MD),和 5 μg·kg-1bm(低剂量组,LD),注射体积为1 mL左右。对照组(Control)每只鸡注射1 mL生理盐水。试验期间未发现鸡的死亡。
1.4 鸡组织取样
鸡经腹腔注射后,分别于1、3、12、24、48 h进行取样。每个时间点从对照组和3个染毒组各取出3只鸡,解剖取出完整的肾脏,生理盐水漂洗,除去血液,用滤纸擦干后,称重,用锡箔纸包裹后现场放入液氮中保存,24 h后放入-80 ℃的超低温冰箱中冷冻保存。
1.5 肾脏系数的测定
根据称量鸡只体质量和肾脏质量,计算肾脏系数(KI)。计算公式如下:

式中:KI为肾脏系数,%;kb为肾脏湿质量,kg;bm为鸡只体质量,kg。
1.6 分析方法
按照不同酶试剂盒上的方法对肾脏组织进行匀浆以及处理,CAT、GST和GPX采用紫外-可见分光光度计进行测定,SOD、GSH均采用酶标仪进行测定,并用考马斯亮兰总蛋白试剂盒和标准蛋白测定组织的蛋白质含量,测试方法为比色法。CAT、SOD、GPX和GST酶活性单位为U·mg-1,GSH的酶活性单位为 μmol·g-1。
1.7 数据处理
运用SPSS 13.0软件对数据进行统计处理,采用t检验分析处理组与对照组之间的差异显著性。
2 结果与分析
2.1 MC-LR对肾脏系数的影响
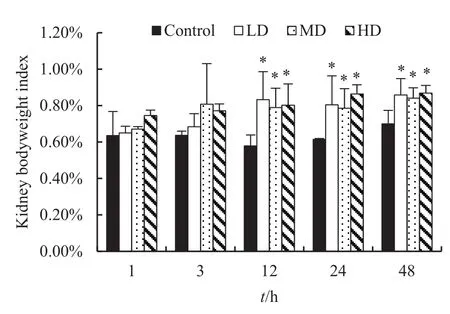
图1 腹腔注射不同剂量的MC-LR后鸡肾脏系数的变化趋势Fig. 1 Changes of kidney body weight index in chicken injected intraperitoneally with different dose of MC-LR
腹腔注射MC-LR后,鸡肾脏系数的变化情况如图1所示。与对照组相比,试验组的鸡肾脏系数从1 h后就开始呈现上升趋势。在1 h和3h时,对照组鸡肾脏系数为(0.64%±0.13%)和(0.64%±0.02%),低剂量组、中剂量组和高剂量组分别为(0.65%±0.04%)和(0.68%±0.07%)、(0.67%±0.01%)和(0.81%±0.22%)、(0.75%±0.03%)和(0.77%±0.04%),各试验组与对照组的肾脏系数之间并无统计学上的差异(t=-1.111--0.151;P=0.348-0.903);从12 h开始直至试验结束(48 h),MC-LR染毒组的肾脏系数较对照组显著上升。12 h时,对照组、低、中和高剂量组肾脏系 数 分 别 为 (0.58%±0.06%)、 (0.83%±0.15%)、(0.79%±0.11%)和(0.80%±0.12%);24 h时,各组肾脏系 数 分 别 为 (0.61%±0.01%)、 (0.80%±0.16%)、(0.79%±0.11%)和(0.86%±0.05%);48 h,各组肾脏系数分别为(0.70%±0.07%)、(0.86%±0.09%)、(0.84%±0.06%)和(0.87%±0.04%);3个时间点各染毒组的肾脏系数均显著高于对照组(t=-6.687--3.495;P=0.018-0.036)。
2.2 谷胱甘肽(GSH)含量变化
不同注射剂量下鸡肾脏中谷胱甘肽(GSH)的含量随时间变化如图2所示。与对照组相比,鸡肾脏中GSH含量在1 h时,染毒组有下降趋势(对照组、低、中和高剂量组GSH含量分别为(6.06±1.11)、(5.05±0.50)、(5.65±0.85)和(5.19±1.21) μmol·g-1),然后从3 h开始出现不同程度的上升(对照组、低、中和高剂量组 GSH 含量分别为(6.49±1.03)、(6.38±0.82)、(6.85±2.81)、(7.18±1.73) μmol·g-1),到48 h时,染毒组略低于对照组(对照组、低、中和 高 剂 量 组 GSH 含 量 分 别 为(8.83±1.06)、(7.10±0.52)、(7.46±3.22)、(8.33±2.29) μmol·g-1),但各染毒组和对照组之间的差异均未达到统计学水平(t=-3.192-1.854;P=0.069-0.921)。
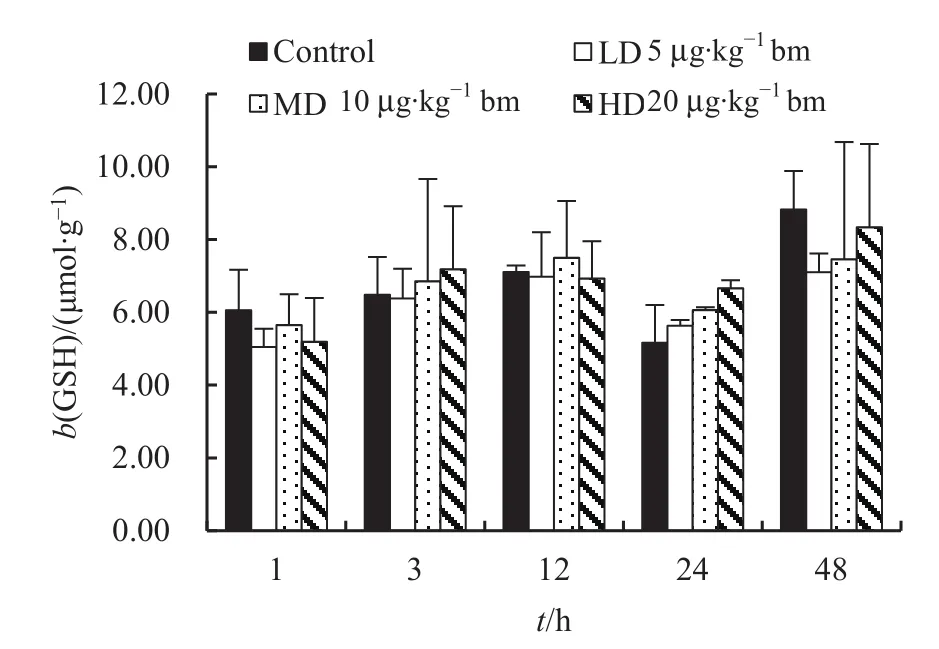
图2 不同注射剂量下鸡肾脏中GSH含量随时间的变化Fig. 2 Temporal changes of GSH concentrations in kidney of chicken injected intraperitoneally with different dose of MC-LR
2.3 谷胱甘肽转移酶(GST)活性变化
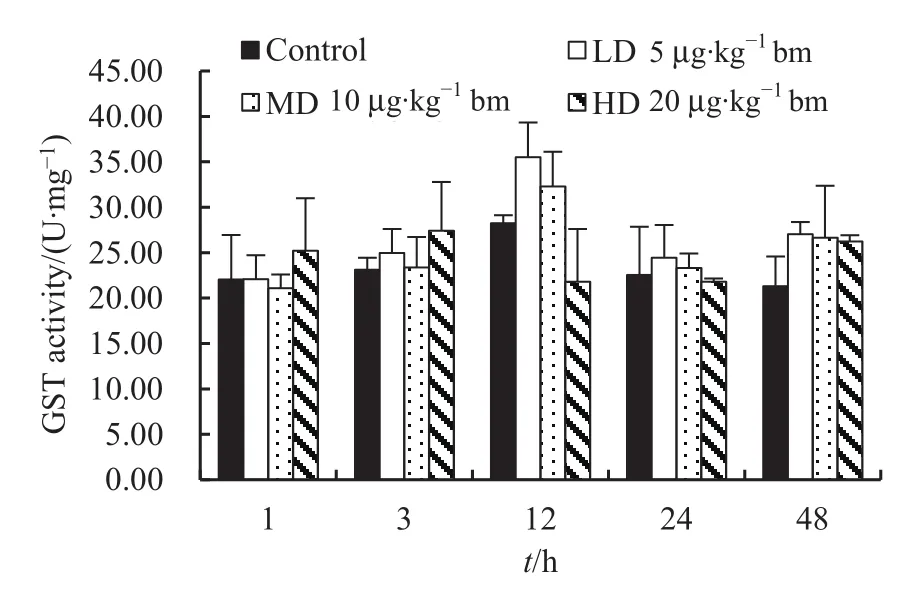
图3 不同注射剂量下鸡肾脏中GST酶活性随时间的变化Fig. 3 Temporal variations of GST activity in kidney of chicken injected intraperitoneally with different dose of MC-LR
鸡注射MC-LR后,与对照组相比,染毒组鸡肾脏中GST酶活性无显著变化(图3)。鸡腹腔注射MC-LR后1 h时,高剂量组GST酶活性略高于对照组(对照组和高剂量组 GST酶活性分别为(22.04±4.91)和(25.24±5.75) U·mg-1);3 h 时,3 个剂量组GST酶活性均高于对照组(对照组、低、中和高剂量组 GST酶活性分别为(23.11±1.34)、(24.97±2.64)、(23.39±3.33)和(27.44±5.35) U·mg-1),但未达到统计学上的差异(t=-0.892--0.110;P=0.363-0.927);12 h时,3个染毒组的GST酶活性呈现随着剂量增加而下降的趋势(低、中和高剂 量 组 GST 酶 活 性 分 别 为(35.51±3.82)、(32.31±3.80)和(21.81±5.78) U·mg-1),但与对照组(28.22±0.90)之间均未有显著差异(t=-2.630-2.220;P=0.113-0.361);24 h时,对照组和低、中、高3个染毒组之间的GST酶活性相当(值分别为 (22.53±5.31)、 (24.44±3.60)、 (23.34±1.56)和(21.82±0.33) U·mg-1);至 48 h,3 个染毒组 GST酶活性(低、中、高剂量组 GST酶活性分别为(27.02.±1.37)、(26.66±5.69)和(26.25±0.66) U·mg-1)高于对照组(21.30±3.27) U·mg-1,但均未达到显著水平(t=-2.342--1.171;P=0.136-0.224)。
2.4 谷胱甘肽过氧化物酶(GPX)活性变化

图4 不同注射剂量下鸡肾脏中GPX酶活性随时间的变化Fig. 4 Temporal variations of GPX activity in kidney of chicken injected intraperitoneally with different dose of MC-LR
不同注射剂量下鸡肾脏中谷胱甘肽过氧化物酶(GPX)的活性随时间变化如图4所示。1 h、3 h和 12 h时,低剂量组 GPX酶活性(值分别为(15.68±2.48)、(16.88±0.89)和(17.37±1.80) U·mg-1)与对照组(值分别为(15.33±0.16)、(17.92±0.66)和(17.99±4.91) U·mg-1)相当,24 h (21.17±3.53) U·mg-1和48 h (18.22±4.34) U·mg-1时高于对照组(分别为(16.33±0.83) U·mg-1和(17.35±0.74) U·mg-1);中剂量组GPX酶活性在1 h (15.51±1.49) U·mg-1和48 h(17.41±1.52) U·mg-1时与对照组相当,其它时间点GPX酶活性(3、12和24 h时分别为(20.40±1.94)、(21.07±1.9)5 和(18.50±1.82) U·mg-1)均高于对照组;高剂量组GPX酶活性在1 h (17.20±1.82) U·mg-1和3 h (19.88±3.37) U·mg-1时高于对照组,其它时间点GPX酶活性(12、24和48 h分别为(16.32±0.92)、(15.67±1.17)、(15.63±0.53) U·mg-1)低于对照组。除了24 h低剂量组的鸡肾脏中GPX酶活性显著高于对照组之外(t=-3.265;P=0.031),其它组别和时间点中的肾脏中 GPX酶活性与对照组之间无统计学上的差异(t=-2.156-1.810;P=0.097-0.918)。
2.5 超氧化物歧化酶(SOD)活性变化
鸡注射MC-LR后,鸡肾脏中SOD酶活性的变化情况如图5所示。SOD酶活性除了3 h时的低剂量 组 (129.94±12.28) U·mg-1和 中 剂 量 组(117.47±2.00) U·mg-1低于对照组(133.15±20.90)U·mg-1外,其它各组SOD酶活性(127.15-169.65 U·mg-1)均高于对照组(121.70-149.16 U·mg-1),但所有染毒组别肾脏中 SOD酶活性与对照组之间的差异均未达到统计学上的显著水平(t=-5.761-1.058;P=0.056-0.837)。
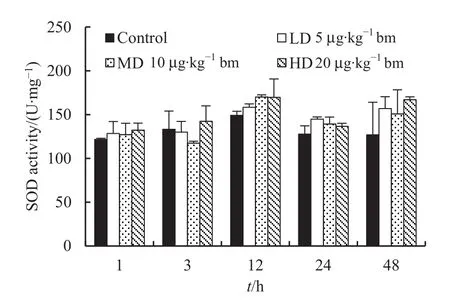
图5 不同注射剂量下鸡肾脏中SOD酶活性随时间的变化Fig. 5 Temporal variations of SOD activity in kidney of chicken injected intraperitoneally with different dose of MC-LR
2.6 过氧化氢酶(CAT)活性变化

图6 不同注射剂量下鸡肾脏中CAT酶活性随时间的变化Fig. 6 Temporal changes of CAT activity in kidney of chicken injected intraperitoneally with different dose of MC-LR
不同注射剂量下鸡肾脏中过氧化氢酶(CAT)的活性随时间变化如图6所示。除了3 h,低、中和高剂量3个染毒组肾脏中CAT酶活性(值分别为 (116.64±4.29) 、 (96.66±1.13) 、 (74.01±11.20)U·mg-1)低于对照组(123.58±11.33) U·mg-1,且中剂量和高剂量组 CAT酶活性与对照组的差异达到了显著水平(t=4.253;P=0.024和t=4.432;P=0.022)外,其它时间点,染毒组(104.70-125.70 U·mg-1)与对照组(113.55-123.58 U·mg-1)的CAT酶活性无明显差异(t=-1.777-2.950;P=0.112-0.913)。
3 讨论
3.1 MC-LR对鸡肾脏抗氧化酶系统的影响
已有的研究证实,MC-LR能促进肾脏的生理和病理的变化(Nobre et al.,2003),而肾脏也参与了机体对 MCs的清除排泄。因此,肾脏抗氧化系统的功能可能会受到 MCs的影响。生物体中的抗氧化系统包括酶和非酶物质。抗氧化物酶主要有SOD、CAT、GPX等,而非酶物质主要包括维生素E、维生素E、维生素A、GSH等(Amado et al.,2010;Lushchak,2011;Yuan et al.,2016)。
抗氧化酶系统发生作用首先是引 GSH系统的反应,GSH直接参与氧自由基(ROS)的清除及MCs的解毒(Goncalves-Soares et al.,2012),GSH与MCs在GST的催化下形成极性较强的结合产物而易于排出体外,被认为 MCs在动物体内解毒的第一步(Kondo et al.,1992;Pflugmacher et al.,1998)。在本研究中,不同染毒组鸡肾脏中 GSH含量与对照组之间无显著差异,这可能是鸡肾脏中GSH的重新合成和/或谷胱甘肽还原酶(GR)将氧化型谷胱甘肽(GSSG)还原为GSH补充了其消耗。众所周知,细胞内 GSH的合成与消耗处于一种动态平衡。首先,GSH与进入体内异物的结合或在GPX特异性的催化下与ROS的反应消耗,接着机体会从新合成GSH或GR催化将GSSG还原为GSH补充消耗,从而保持体内 GSH水平的平衡。不同动物以及同一动物不同组织中GSH对MCs的响应存在较大差异。譬如,Gehringer et al.(2004)研究发现,小鼠暴露于MCs后,会引起小鼠肝脏中GSH含量水平的上升;鲢鱼暴露于自然水体的蓝藻水华(Blaha et al.,2004)以及淡水螺(Radix swinhoei)经MC-LR染毒后(Zhang et al.,2016)也得出了相同的研究结果;而培养的鲤鱼肝细胞(Li et al.,2003)、金鱼肝脏(Malbrouck et al.,2004)、小龙虾(Yuan et al.,2016)暴露于MCs时导致了GSH含量的下降;鳙鱼腹腔注射含有 MCs的蓝藻提取物后,肝脏中 GSH含量水平在整个试验过程中保持稳定(Li et al.,2003),其它作者对丁鲷鱼(Tinca tinca)(Atencio et al.,2008)和金鱼(Carassius auratus)(Malbrouck et al.,2004)经 MCs染毒后的研究发现,肝脏中 GSH含量没有明显变化。巴西的 Brycon amazonicus 鱼腹腔注射 100 μg·kg-1的MC-LR 48 h后,肝脏中GSH含量没有显著变化,而鳃中GSH含量相对于对照组下降了43%(Martins et al.,2017)。
GST在MCs的解毒过程中起着非常重要的作用,其催化GSH与MCs结合(Pflugmacher et al.,1998),但是,不同动物试验、不同器官中 GST酶活性对MCs的响应存在较大差异(Best et al.,2002;Cazenave et al.,2006;Malbrouck et al.,2004;Martins et al.,2017;Wiegand et al.,2005;Yuan et al.,2016;Li et al.,2003)。譬如,Yuan et al.(2016)对小龙虾暴露于MC-LR的研究指出,小龙虾肝脏中GST酶活性随着暴露时间的增加呈现上升趋势,在斑马鱼早期发育期的研究中也得出了相似的研究结论(Wiegand et al.,2005);而当斑马鱼胚胎暴露于 0.5 μg·L-1的 MC-LR和蓝藻脂多糖混合物时,GST酶活性受到了抑制(Best et al.,2002),鲶鱼(Corydoras paleatus)的MC-RR暴露试验也得出了类似的研究结果(Cazenave et al.,2006);巴西的Brycon amazonicus 鱼经MC-LR染毒后,其肝脏中GST酶活性显著上升,而腮中GST酶活性显著下降(Martins et al.,2017);Li et al.(2003)等对鳙鱼的蓝藻提取物的腹腔注射试验结果显示,其肝脏中GST呈现先上升后下降的趋势;金鱼幼鱼暴露于MC-LR 96 h时,GST酶活性在整个试验期间未发生显著改变(Malbrouck et al.,2004)。在本研究中,与对照组相比,3个染毒组鸡肾脏中GST酶活性在整个试验期间无显著变化。
已有的研究结果显示,SOD、CAT和GPX等酶在机体清除过量 ROS中起着非常重要的作用(Amado et al.,2010;Lushchak,2011),但是,这3种酶活性的变化会随着MCs的种类、物种类别、剂量以及处理时间的不同而存在较大差异,其变化曲线可能是多阶段的(Li et al.,2003;Li et al.,2010;Moreno et al.,2005;Prieto et al.,2006,2007)。譬如,Li et al.(2003)研究结果显示,MC-LR处理培养的鲤鱼肝细胞后,CAT、SOD和GPX酶的活性随着处理时间的延长而逐渐升高;大鼠经腹腔注射MC-LR,其肝脏和肾脏中CAT、SOD和GPX酶的活性显著降低(Moreno et al.,2005);罗非鱼腹腔注射含MCs的蓝藻提取物后,肾脏中的CAT、SOD 和 GPX 酶的活性显著降低(Prieto et al.,2007);鳙鱼腹腔注射蓝藻粗提物后,其肝脏中SOD、CAT和GPX酶活性均呈现先上升后下降的趋势(Li et al.,2010);罗非鱼分别用 500 μg·kg-1MC-LR 和 500 μg·kg-1腹腔注射后,MC-LR 处理组肝脏、肾脏和鳃组织中的 SOD酶活性显著上升,而MC-RR处理组仅肾脏中SOD酶显著增加,而肾脏和鳃中未见明显改变;MC-LR和MC-RR处理的罗非鱼肝脏、肾脏和鳃中CAT酶活性均显著上升;肝脏和鳃中 GPX酶活性在两种毒素处理过程中均无明显变化,而MC-LR染毒引起了肾脏GPX酶活性的显著上升,MC-RR染毒未发生显著变化(Prieto et al.,2006)。在本研究中,鸡肾脏各染毒组中SOD酶活性均略高于对照组,但未达到统计学差异水平,这说明SOD酶参与了肾脏中过量ROS的清除;除3 h时,中、高剂量组鸡肾脏中CAT酶活性明显下降,其它时间点,染毒组与对照组 CAT酶活性无明显差异,这说明鸡肾脏中CAT酶活性在3 h时受到了抑制,同时也参与 ROS的清除;鸡肾脏中GPX酶活性在整个试验期间无明显变化,对照组与染毒组之间酶活性差异不显著。
3.2 MC-LR对鸡肾脏系数的影响
脏器系数变化是毒理学试验中较为敏感的指标(Zenick et al.,1989)。在本研究中,鸡肾脏系数从 1 h就开始呈现毒素处理组高于对照组的趋势,并在12 h之后直至48 h,染毒组的肾脏系数显著高于对照组。这说明,MC-LR注射后导致了鸡肾脏充血、肿胀等生理学反应,使肾脏质量增加。这一结果与李哲等(2010)及杨黎江等(2013)对大鼠肝脏和王春雨(2010)对鸭肝脏的研究结果一致。在本研究中,肾脏抗氧化酶系统CAT、GST、SOD和 GPX酶活性以及 GSH含量存在一定程度的变化,虽然未达到统计学上的显著性水平,这说明,在MC-LR作用下,鸡肾脏产生了氧化应激现象,但其抗氧化酶系统可能难以抵御MC-LR危害。
4 结论
(1)在MC-LR作用下,肾脏系数从1 h就开始呈现毒素处理组高于对照组,并在12、24和48 h时,毒素处理组肾脏系数显著高于对照组的趋势。
(2)在 MC-LR的作用下,抗氧化酶系统中,除中剂量和高剂量组CAT在3 h时酶活性受到明显的抑制外,GSH含量和GST、SOD和GPX酶活性在整个试验期间没有明显的变化。
(3)在 MC-LR作用下,鸡肾脏产生了氧化应激现象,但是其抗氧化酶系统可能难以抵御MC-LR危害。
