芘污染土壤的根瘤菌-植物修复效应研究
2019-08-22黄河张超兰周永信谢湉廖长君
黄河 ,张超兰*,周永信,谢湉,廖长君*
1. 广西大学生命科学与技术学院,广西 南宁 530004;2. 广西博世科环保科技股份有限公司,广西 南宁 530007;3. 广西大学资源环境与材料学院,广西 南宁 530004
多环芳烃(Polycyclic Aromatic Hydrocarbon,PAHs)是由两个或者两个以上的苯环构成的疏水性有机污染物,环境中普遍存在的具有“三致”毒性的持久性有机污染物(POPs),容易吸附于沉积物上,覆于水中悬浮颗粒物中,且优先向非水相体系转移,土壤是其最主要的环境介质之一(Zhang et al.,2015;Adeleye et al.,2016)。PAHs能在土壤中不断累积,破坏土壤环境质量,进而影响土壤的正常功能。环境中的PAHs主要来源包括:化石燃料燃烧、石化产品生产、化肥农药施用等。PAHs能够通过食物链进入人体,干扰人体内分泌活动的正常进行,危害人体健康(Hawliczek et al.,2012;Mahanty et al.,2010)。目前,PAHs已被欧盟和美国环保局列为优先控制污染物,并把其中的 16种作为环境污染的监测参数(Wise et al.,2015)。
生物修复技术是目前修复治理PAHs污染土壤的重要手段之一,其包括了植物修复、微生物修复和植物-微生物联合修复。植物修复是指植物通过吸收累积、改善土壤理化性质以及提高土壤微生物的活性等作用来降低土壤污染物的浓度(Kuppusamy et al.,2017)。已有研究表明植物修复能降低土壤中PAHs的浓度(Petrova et al.,2017;Tejeda-Agredano et al.,2013;Somtrakoon et al.,2014),但是单纯的植物修复对PAHs污染土壤的修复效率不高。微生物的分解与代谢,是土壤中PAHs降解的主要途径之一,但是土壤理化性质复杂,在不同的土壤中,降解菌的存活差异巨大,进而导致微生物修复效率的不稳定。植物-微生物联合修复结合了植物修复和微生物修复的优点,能够强化土壤污染物的降解作用。一方面,植物发达的根系为微生物提供适宜的生长条件,促进其活性;另一方面,微生物能够降解有机污染物,减轻污染物对植物的毒害,提高植物的耐受性,同时为植物带来生长必需的各类营养元素,并提高植物对污染物的吸收积累和转化效率。研究表明紫花苜蓿接种木霉后促进了植物的生长,并且提高了土壤中的PAHs的降解率(姚伦芳等,2014;Tripathi et al.,2013);紫花苜蓿与菌株(Fusarium sp. strain ZH-H2)联用加快了土壤中PAHs的降解(Shi et al.,2018)。目前用于修复PAHs污染土壤的植物主要有玉米、黑麦草和紫花苜蓿等,PAHs的降解菌主要包括内生细菌以及根瘤菌等(Zafra et al.,2015;Ren et al.,2017)。
本文以芘(Pyrene)作为目标污染物,一种土壤中常见的 PAHs,是一种四环芳烃。并以绿豆根瘤菌(Rhizobium leguminosarum),紫花苜蓿根瘤菌(Rhizobium meliloti)为供试菌株,选用绿豆(Vigna radiata L.)、花生(Arachis hypogaea L.)和紫花苜蓿(Medicago sativa L.)这3种能够和根瘤菌共生且可用以肥田的植物作为研究对象。并以黑麦草(Lolium perenne L.)作为对比,黑麦草不能和供试根瘤菌共生,作为参考作用,用以考察根瘤菌在不形成根瘤的时候会否对修复效果产生影响。采用盆栽实验研究接种根瘤菌对4种植物修复芘污染土壤的效果,为今后利用植物微生物修复芘污染土壤提供理论基础和技术支撑。
1 材料与方法
1.1 供试材料
供试土壤为水稻土,采自广东省增城市,采样深度为0-20 cm,土壤经自然风干,剔除杂物后过2 mm的筛网,置于干燥处密封保存,备用(Sun et al.,2010)。土壤理化性质的测定参照《土壤农化分析》(鲍士旦,2008),其中,土壤 pH值 4.50,有机质16.3 g·kg-1,总氮 86 mg·kg-1,总磷 52 mg·kg-1,总钾 448 mg·kg-1,总有效磷 35 mg·kg-1,速效钾 26 mg·kg-1,未在土壤中检测出芘。
芘购自sigma公司,纯度>98%。绿豆品种为绿珍珠,种子购自驻马店泌阳鑫丰科技有限公司。紫花苜蓿,黑麦草,花生种子购自武汉华中农业大学。绿豆根瘤菌,紫花苜蓿根瘤菌购自宁夏诺德曼生物技术有限公司。
1.2 实验设计
1.2.1 人工污染土壤
称取5.4 kg供试土壤,逐渐加入溶解了5.4 g芘的二氯甲烷溶液,多次搅拌混匀,将处理过的土壤置于通风橱中24 h,待二氯甲烷挥发后过2 mm筛网3次,再次混匀。然后,将其分少量多次加入48.6 kg供试土壤中,搅拌,过2 mm筛网3次,使土壤尽量混匀,最终使土壤中芘的浓度达到 100 mg·kg-1。整个过程在密闭箱子中操作,尽量减少扬尘,避免污染物转移,造成污染。
1.2.2 盆栽实验
每种植物设置4个处理:CN-污染土壤、CV-污染土壤+根瘤菌、NN-清洁土壤、NV-清洁土壤+根瘤菌。同时设置无植物对照组,用于考察在无植物条件下,污染土壤中芘的自然降解率。每个处理设置3个重复。具体操作为:称取2 kg对应土壤于具底盖塑料花盆(d=18 cm,h=16 cm)中,加蒸馏水至田间持水量的60%,稳定10 d后测定土壤中芘的浓度作为本底值(经过陈化后土壤中芘的起始浓度为90.32 mg·kg-1)。选取饱满大小一致的4种植物的种子,经离子水清洗后用3%的H2O2浸泡20 min,然后用去离子水清洗3次。待其表面风干后,CV和NN处理组直接播种,CV和NV处理组按菌剂说明进行接种,黑麦草同时接种绿豆根瘤菌和苜蓿根瘤菌,由于根瘤菌具有专一性,黑麦草不能和供试根瘤菌共生,本实验中作为参考作用,用以考察根瘤菌在不形成根瘤的时候是否对修复效果产生影响。每盘播种 20颗种子,播种后一周间苗,选留生长状态相似的植株,其中绿豆和花生各留4株,黑麦草和紫花苜蓿各留10株。将盆栽置于玻璃网室中培养 60 d,培养期间日平均温度为35 ℃,每天傍晚利用重量法从盆底浇水,使土壤保持在田间持水量的60%,并每隔两天随机改变花盆位置一次。培养结束后,于室内通风阴暗处进行采样,采样时将土整盆倒出,小心分离根和土壤,统计每盆植株根系上的根瘤个数。植物地上部分用自来水清洗后再用去离子水充分淋洗,地下部分先用超声波清洗仪清洗再用去离子水淋洗,用滤纸蘸干表面水分后放入密封袋。将暂时无法处理的样品放入-20 ℃的冰箱中储存,备用。土壤样品采集后,充分混匀,过 20目筛,测定土壤中芘的含量以及脱氢酶活性。
1.3 分析检测方法
采用电位法测定土壤的pH值(水土质量比为1∶2.5)。采用TTC分光光度法测定土壤脱氢酶活性(Masto et al.,2011)。采用HPLC/UV分析土壤芘含量,具体为取2.00 g土样于30 mL玻璃离心管中,加入10 mL二氯甲烷,超声(添加冰块使水温不超过 40 ℃)萃取 1 h后于4000 r·min-1下离心20 min;取3 mL上清液过2 g硅胶柱;再用1∶1的二氯甲烷和正己烷溶液洗脱。鸡心瓶收集洗脱液后,在40 ℃下浓缩至接近干;用甲醇定容,过0.22 μm有机相滤膜后,用HPLC/UV分析。液相色谱的条件:紫外检测器,d=4.6 mm、l=150 mm C18反相色谱柱,柱温 30 ℃,流动相为甲醇-水 83∶17,流速 1.0 mL·min-1(Gao et al.,2004;宋玉芳等,1995)。
1.4 数据处理
采用Excel 2007整理数据,SPSS 19.0进行统计学分析,利用Origin 8.0进行绘图。土壤pH、脱氢酶活性、芘降解率和植物生物量等指标采用单因子方程分析(ANOVA)进行显著性差异分析。
2 结果与分析
2.1 根瘤菌适应性
如图1所示,无论在污染土壤(CN)还是清洁土壤(NN)中,紫花苜蓿均未成功接种上根瘤菌,而黑麦草根际则没有根瘤生成。在不接种根瘤菌的污染土壤和清洁土壤中,绿豆和花生根瘤数没有显著差异。接种根瘤菌后,绿豆和花生根系上的根瘤数要显著多于比无接种的对照组,同时绿豆的根瘤数要显著多于花生,在污染土壤中绿豆根瘤数是花生的2.16倍,在清洁土壤中则为1.54倍。对于绿豆来说,芘对根瘤数没有明显的抑制作用;而芘对花生根系根瘤的数目有一定的抑制作用,对比清洁土壤,根瘤数下降了28.17%。
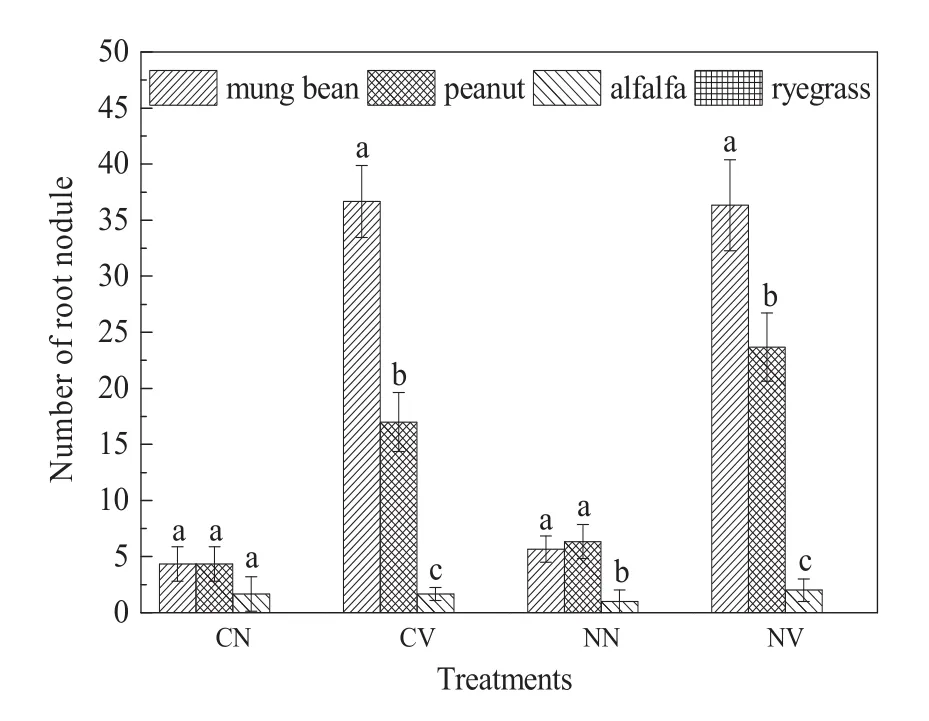
图1 根瘤菌在不同植物根系的生长情况Fig. 1 Growth of Rhizobium in roots of different plants
2.2 不同处理对土壤pH的影响
土壤pH值如图2所示,无论在污染土壤(CN)还是清洁土壤(NN)中,绿豆、花生和黑麦草处理的土壤 pH均有所增加,其中绿豆处理对于 pH的提升效果最好,然后依次为花生和黑麦草。

图2 土壤pH值变化Fig. 2 The changes of soil pH in different treatments
在污染土壤中,无植物处理组的土壤 pH为4.44,绿豆、花生、黑麦草和紫花苜蓿处理土壤pH较无植物处理分别提高了 15.92%、6.46%、4.88%和1.43%。而在清洁土壤中,种植植物后,绿豆、花生和黑麦草处理土壤 pH较原土分别增加了15.26%、5.63%和 3.93%,而种植紫花苜蓿后土壤pH降低了0.67%。接种根瘤菌后,在污染土壤中,种植绿豆、花生和黑麦草的土壤的pH值均有略微提高,分别提高了0.52%、0.42%和0.93%;紫花苜蓿接种根瘤后使土壤pH值降低了1.33%。而在清洁土壤中,植物接种根瘤菌后,土壤pH与不接种根瘤菌组无明显差异。
2.3 不同处理对植物生物量的影响

图3 不同植物地上部生物量Fig. 3 Shoot biomass of different plant in different treatments
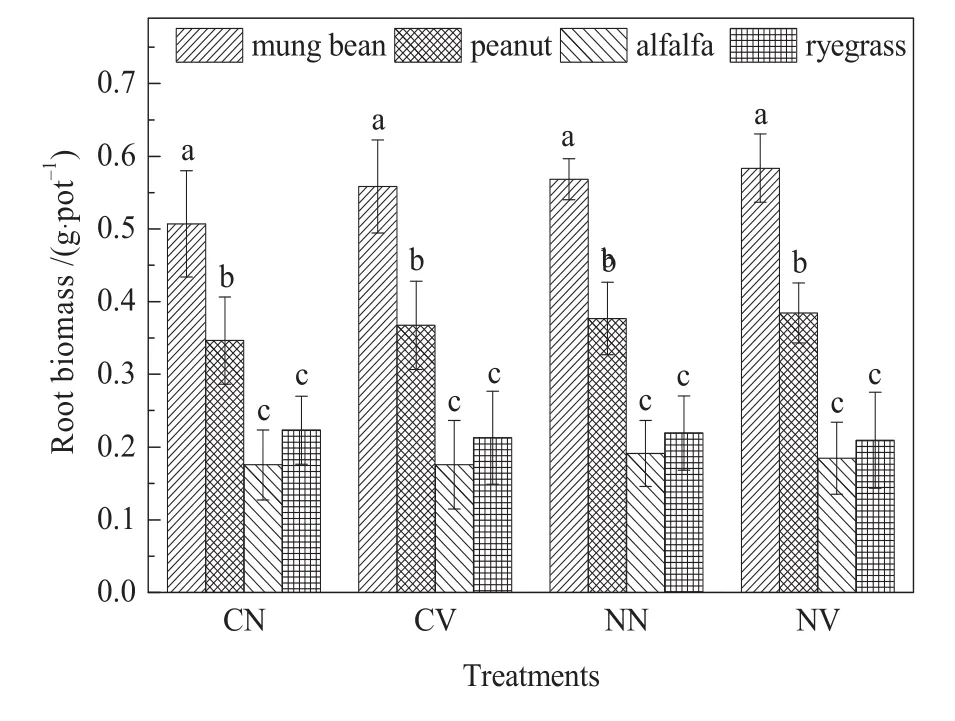
图4 不同植物根系生物量Fig. 4 Root biomass of different plant in different treatments
培养60 d后,绿豆、花生、紫花苜蓿和黑麦草在不同处理中的茎叶生物量干重及根部生物量干重如图3和图4所示。由图3可以看出4种植物的茎叶生物量顺序分别为:绿豆>花生>黑麦草>紫花苜蓿。绿豆和花生的茎叶生物量要显著大于紫花苜蓿和黑麦草,绿豆的茎叶生物量相当于紫花苜蓿的6倍。各植物根系生物量的顺序与茎叶一致。在芘污染土壤中,4种植物的生物量均有一定幅度的下降,对于地上部来说,绿豆、花生、紫花苜蓿和黑麦草的生物量分别下降了 6.07%、5.47%、10.22%和0.48%。对于地下部来说,绿豆、花生、的生物量则分别降低了10.79%、7.96%和8.36%,而黑麦草则上升了1.82%。这表明芘对4种有一定的毒害作用,其中黑麦草受到的影响最小。对于绿豆和花生来说,接种根瘤菌能有效的缓解这种毒害作用,接种根瘤菌后绿豆地上部和地下部的生物量分别提高了 3.18%和 10.12%,花生则提高了 4.96%和6.06%,接种根瘤菌缓解了芘对绿豆和花生的毒害作用。
2.4 不同处理对土壤脱氢酶活性的影响
由图5可以看出,经过60 d的培养,4种植物均提高了土壤脱氢酶的活性。种植绿豆的污染土壤的脱氢酶活性最高,其次是花生,但两者之间没有显著差异。接种根瘤菌提高这两种植物土壤中的脱氢酶活性,但这种差异并不明显,其中绿豆处理组中提高了9.70%,花生处理组中提高了2.05%。而种植紫花苜蓿和黑麦草的污染土中脱氢酶活性要低于绿豆和花生。

图5 各处理土壤脱氢酶活性的变化Fig. 5 Soil Dehydrogenase activity in different treatments
2.5 不同处理对不同植物去除芘的影响
由图6可知,在无植物的情况下,土壤中芘的去除率为56.82%。种植4种植物均提高了土壤中芘的去除率,其中对芘的去除效果最好的是绿豆,对比无植物处理,去除率由56.82%上升到90.52%,增加了33.70%。其后依次为:花生、黑麦草和紫花苜蓿,相应处理中土壤芘的去除率分别为78.45%、67.37%和 64.54%,对比无植物对照组分别提高了21.63%、10.55%和7.72%。接种根瘤菌后绿豆和花生对芘的去除率有一定的提高,接种根瘤菌使绿豆和花生对芘的去除率分别提高了4.10%和2.02%。而紫花苜蓿和黑麦草接种根瘤菌后,土壤芘的去除率几乎没有改变。

图6 植物对土壤芘的去除效果Fig. 6 Pyrene removal in soils under different treatments
3 讨论
植物修复是土壤有机污染修复的重要组成部分,豆科植物和黑麦草对土壤中PAHs均有不同程度降解效果(沈源源等,2011)。本研究的结果表明,绿豆、花生、紫花苜蓿和黑麦草在芘污染土壤中的长势良好,种植植物的处理组中土壤芘的含量均要显著低于未种植植物的处理组,这说明4种植物对芘有着较好的耐受性,并且提高了土壤中芘的去除率。植物能够通过吸附和累积的形式去除土壤中的有机污染物,而且期根系分泌物能够与有机污染物发生络合和降解作用,而根系释放到土壤中酶也促进了污染物的降解(张娟等,2016)。潘声旺等(2009)的研究表明,植物累积对于土壤中PAHs的去除率贡献值比较低,而植物主要是增强了土著微生物对土壤PAHs的降解作用(戴青松等,2014)。植物修复中植物通过改变土壤微生物的生存环境来影响微生物的活动,包括改变含水量,pH以及释放有机物,为根际微生物输送更多的营养物质等(董洪梅等,2011)。土壤pH是影响PAHs降解的一个重要因素,研究表明当土壤pH范围在5.0-9.0时,有利于PAHs的降解,中性环境中生物降解作用更强(Chang et al.,2008)。豆科绿肥植物可以作来调节土壤酸度(Yan et al.,2000),在污染土壤中,种植4种供试植物均提高了土壤的pH值,其中绿豆处理组的pH值为5.15,处于有利于PAHs降解的区间,因此该处理中PAHs的降解速率也最快。此外,土壤pH还会影响土壤酶参与的生化反应速度,有的酶促反应对pH变化很敏感,只能在较窄的pH范围内才能进行,合适的pH也为土壤酶提供根适宜的环境。脱氢酶是一种氧化还原酶,在环状化合物的分解转化过程中起着重要的作用(刘世亮等,2007),本课题组在前期研究中发现土壤的脱氢酶活性对芘污染颇为敏感(张慧等,2010;宫璇等,2004),相关研究也表明土壤脱氢酶和土壤中芘的去除率成正相关的关系(张慧等,2010;范淑秀等,2007)。种植植物使土壤脱氢酶的活性明显提高,从而促进了芘的降解。此外,种植植物后,土壤中芘的去除率的提高幅度与植物生物量的变化趋势一致,表明植物的生物量是影响土壤芘降解速率的重要因素。总的来说,绿豆有着较大的生物量,对土壤酸化有着较好缓冲效果,使pH值维持在稳定的范围,有利于土壤保持较高的脱氢酶活性,从而提高芘的降解率。在植物修复的过程中,接种特定的微生物有助于促进土壤中 PAHs的降解,提高植物修复的效率。沈源源(2010)研究发现不同品种紫花苜蓿与根瘤菌联合修复后,紫花苜蓿-根瘤菌能显著促进土壤中各组分PAHs的去除,比单种植物提高了大约 20%的去除率。在本研究中,根瘤菌剂并没能使紫花苜蓿成功的接种上根瘤菌,这可能是该根瘤菌剂所包含的微生物并不能实验所处的温度环境。实验进行的时间刚好是夏天,日平均温度在 30 ℃以上,日最高气温 45 ℃,而花盆的土量相对较少,对环境温度的缓冲能力较小,植物的根温很容易达到环境温度,这可能导致根瘤菌在紫花苜蓿发芽前还没入侵紫花苜蓿根系就已经灭活,或者一直处于休眠的状态。接种根瘤菌后,绿豆和花生处理组中土壤芘的去除率有一定的提高,一方面,接种根瘤菌使绿豆和花生的根部的生物量有所增加;另一方面,接种根瘤菌使种植绿豆和花生的芘污染土壤的脱氢酶活性有所提高;这都将有利于芘的降解。但这种差异并不明显,这可能是由于供试土壤氮元素含量较多,无需通过根瘤菌获取额外氮源(蔺蕊等,2004),不接种根瘤菌的绿豆根系生物量依旧较大,能够为根际微生物提供同等类似的条件,且与根瘤菌共生的根系面积毕竟只是占了土壤总量的少数,而本实验中的土壤样品采集的是总体的土壤样品并非根际土壤,这可能也是添加根瘤菌对土壤修复效果的影响不明显的原因。
4 结论
较其他3种植物,种植绿豆对土壤酸化具有较好的缓存效果,能使土壤的pH保持在一个比较稳定的范围,对PAHs污染土壤具有较好的修复效果,其对芘的去除率相对于无植物对照组提高了33.70%,此外还提高了土壤的脱氢酶活性。接种根瘤菌提高了绿豆和花生对土壤中 PAHs的去除能力,其中根瘤菌接种绿豆对土壤芘的去除率达到94.63%。绿豆能够适应本实验所处的高温环境,具有较大的生物量,根系发达,这能为土著微生物提供更多的碳源,使土壤微生物生长更加旺盛;其根系能与根瘤菌结合的更好,说明绿豆根瘤菌具有很好的适应性,这使绿豆具有培肥土壤的潜力。
