气相色谱内标法测定鱼油保健品中的EPA和DHA含量
2019-08-22朱丽君王鲁霞赵宝义范美霞姜祎頔
朱丽君,王鲁霞,武 玲,赵宝义,范美霞,姜祎頔
(1.菏泽市行政审批服务局,山东 菏泽 274000; 2.菏泽市食品药品检验检测研究院,山东 菏泽 274000)
二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)是深海鱼油中的特征脂肪酸,属Ω-3多不饱和脂肪酸,是人体重要的营养成分。科学研究发现,EPA和DHA不仅具有抑制血小板凝聚、舒张血管、调节血脂、健脑明目、免疫调节、促进婴儿视网膜发育等功能,可以防治心脑血管疾病、炎症、肾病等[1-4],而且其具有通过抑制肿瘤生长、转移和侵袭[5]从而防治癌症的功效,因此鱼油产品为专家所推崇。目前,高品质或经深加工的鱼油主要用于食品、保健品以及药品[6],其中以保健品最多。当前市场上鱼油保健品质量参差不齐[7],普通鱼油类产品中EPA和DHA的含量远逊于深海鱼油类产品[8],容易误导消费者。因此,检测鱼油保健品中EPA和DHA的含量成为辨别其质量的重要方法。针对国标GB 5009.168—2016中试样前处理方法中静置分离较慢及程序升温时间较长的问题,本文参考相关文献[10-12],在保证分离度的前提下,对前处理和程序升温方法进行优化,同时进行了方法验证,依据优化方法对市场上10个厂家生产的不同批次鱼油保健品进行EPA和DHA含量的测定,为鱼油保健品的辨别提供科学依据。
1 材料与方法
1.1 实验材料
二十二碳六烯酸甲酯、二十碳五烯酸甲酯、十一烷酸甲酯和十一烷酸甘油三酯对照品,购自上海安谱实验科技股份有限公司,批号分别为US170803-21、P0470020、Q3890020和K1850200,含量均大于等于99%;甲醇、正庚烷、异辛烷为色谱纯;其余试剂均为分析纯;水为一级水;鱼油保健品,来自10个不同厂家。
安捷伦7890B气相色谱仪,梅特勒XS-105微量分析天平。
1.2 实验方法
1.2.1 溶液的制备
1.2.1.1 对照品溶液的制备
将二十二碳六烯酸甲酯、二十碳五烯酸甲酯和十一烷酸甲酯对照品分别用正庚烷配制成质量浓度为0.695、0.557 mg/mL和0.974 5 mg/mL的对照品储备液,贮存于-10℃以下冰箱。将十一烷酸甘油三酯对照品用甲醇配制成质量浓度为4.028 4 mg/mL 的对照品储备液,在冰箱中冷藏。
1.2.1.2 供试品溶液的制备(酯交换法)
称取均匀试样60.0 mg至具塞试管中,精确至0.1 mg。准确加入2.0 mL质量浓度为4.028 4 mg/mL的十一烷酸甘油三酯内标溶液。加入4 mL异辛烷,微热使试样溶解后加入200 μL氢氧化钾甲醇溶液,盖上玻璃塞猛烈振摇30 s后静置至澄清。加入1 g硫酸氢钠,猛烈振摇,中和氢氧化钾。离心[11],取上清液移至上机瓶中,待测。
1.2.2 色谱条件的选择及测定
色谱条件:采用安捷伦HP-88色谱柱(100 m×0.25 mm×0.2 μm),进样口温度270℃,FID温度280℃,载气为氮气,柱流量1 mL/min,以程序升温速率及不同分流比筛选,要求得到的色谱条件应满足理论塔板数(n)至少2 000/m,分离度(R)至少1.25。
测定方法:分别精密吸取对照品系列使用液与供试品溶液1.0 μL,注入气相色谱仪测定。以保留时间定性,以色谱峰峰面积定量。
1.2.3 线性关系考察
将二十二碳六烯酸甲酯、二十碳五烯酸甲酯和十一烷酸甲酯对照品储备液分别用正庚烷稀释制备系列使用液,二十碳五烯酸甲酯和二十二碳六烯酸甲酯对应质量浓度分别为5.57、11.14、27.85、55.70、278.50 μg/mL和6.95、13.90、34.75、69.50、347.50 μg/mL,十一烷酸甲酯质量浓度均为97.45 μg/mL,混匀后备用。精密吸取各使用液1.0 μL,注入气相色谱仪测定。
1.2.4 精密度实验
精密吸取二十二碳六烯酸甲酯、二十碳五烯酸甲酯和十一烷酸甲酯质量浓度分别为55.70、69.50 μg/mL和97.45 μg/mL的对照品使用液,连续进样6次,每次1.0 μL,记录目标物峰面积及内标峰面积,计算响应因子(Fi)。
1.2.5 重复性和稳定性实验
取同一批样品6份,按1.2.1.2方法处理。进样量1.0 μL,计算EPA和DHA的含量及相对标准偏差(RSD);取同一批样品分别在0、2、4、8、16、24 h进样,计算EPA和DHA的含量及RSD。
1.2.6 加标回收实验
准确称取同一批样品9份,分别加入对照品使用液,每个水平3份,按1.2.1.2方法处理。分别进样1.0 μL,计算EPA和DHA的含量和回收率。
1.2.7 样品含量测定
以建立的方法测定10个不同厂家鱼油保健品,按内标法计算EPA和DHA的含量。
2 结果与讨论
2.1 样品处理方法的优化
GB 5009.168—2016未提出均匀取样的具体要求,由于实验需要称取的样品质量较少,一般取1~2粒软胶囊即能满足要求。样品胶囊间的个体差异会导致测定含量的不同。针对这个问题,本文采用取20粒胶囊混匀后再准确称量的方法,经实验验证,所得结果精密度较高[12]。
供试品溶液的制备过程中,后期静置分离过程较慢,并随静置时间不同分离效果不同,本文改为5 000 r/min离心7 min,分离效果较好,上清液较静置效果更清澈,取样测定,结果更精准,并有效去除了部分杂质,减少了杂峰数量。对照品和样品图谱分别见图1和图2。
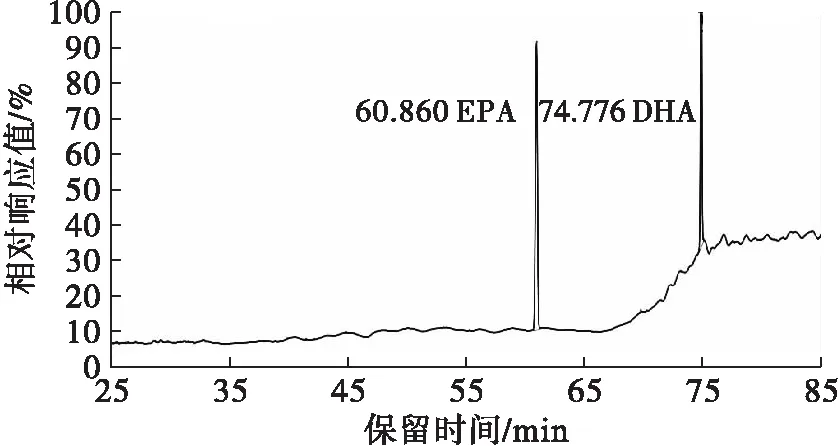
图1 EPA甲酯和DHA甲酯对照品图谱

图2 样品图谱
2.2 色谱条件的优化
国标GB 5009.168—2016中的程序升温方法针对37种脂肪酸的测定,出峰时间较长。本文分流比优化为20∶ 1。将程序升温条件优化为:100℃保持3 min,以10℃/min的速率升温至200℃,保持20 min,再以4℃/min的速率升温至240℃,保持10.5 min。优化后样品图谱见图3。由图2和图3对比可知,EPA和DHA样品峰保留时间分别提前了约21 min和28 min,而其分离度分别为6.13和5.07,符合国标中分离度至少1.25的要求。
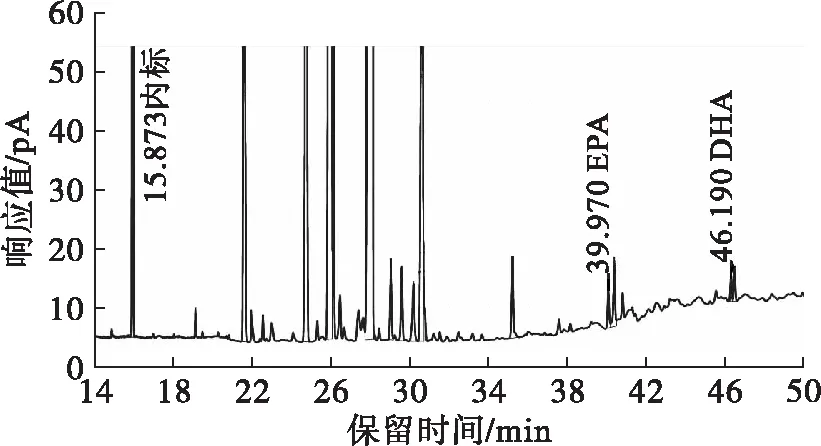
图3 优化条件后样品图谱
2.3 线性关系考察
取系列对照品使用液各1.0 μL,注入气相色谱仪,记录目标物峰面积(Ai)及内标峰面积(A11),计算Y=Ai/A11和X=ρi/ρ11,根据Y与X绘制线性回归曲线,计算平均响应因子Fi=X/Y,结果见表1。由表1可知,EPA和DHA分别在5.57~278.50 μg/mL 和6.97~248.50 μg/mL质量浓度范围内线性关系良好,相关系数均大于0.999。
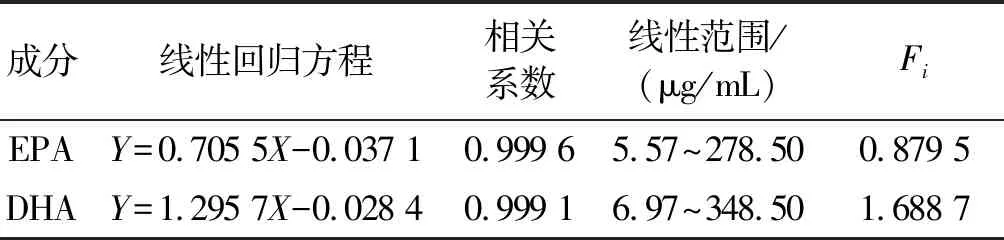
表1 EPA和DHA线性关系考察结果
2.4 精密度实验
测得目标物峰面积及内标峰面积,计算EPA和DHA平均响应因子分别为0.883 5和1.682 6,相对标准偏差(RSD)分别为0.43%和1.05%,表明本方法精密度良好[13-14]。
2.5 重复性和稳定性实验
按1.2.1.2方法处理样品,平行处理6份,计算EPA和DHA的含量,其相对标准偏差(RSD)分别为1.04%和1.62%,说明色谱系统重复性良好。取同一批次样品分别在0、2、4、8、16、24 h进样分析,计算EPA和DHA的含量,其相对标准偏差(RSD)分别为1.48%和1.27%,说明供试品溶液稳定性良好[13-14]。
2.6 加标回收实验
EPA和DHA加标回收实验结果见表2。

表2 EPA和DHA加标回收实验结果
由表2可知,EPA和DHA加标样品平均回收率分别为100.47%和101.43%,其相对标准偏差(RSD)分别为1.03%和1.19%,均小于2%,符合含量测定的准确性要求[13-14]。
2.7 样品含量测定
对市售的鱼油保健品进行测定,结果见表3。

表3 样品中EPA和DHA的测定含量与标示含量对比 g/100 g
由表3可知,市售的10种鱼油保健品中,EPA和DHA的含量高低不等,其与标签标示值相比也有高有低,其中不乏以次充好的产品(如样品9)。而鱼油中EPA和DHA的配比不同,对人体产生的保健作用也不尽相同[15]。因此,如何购买到质量好又适合自己的鱼油保健品,需要有效的测定方法提供科学依据。
3 结 论
本文以GB 5009.168—2016为依据,对国标方法中的样品前处理方法和色谱条件进行了优化,通过线性关系考察、精密度、重复性和稳定性、加标回收等方式对已建立的方法进行了验证。结果表明:EPA和DHA分别在5.57~278.50 μg/mL和6.97~348.50 μg/mL质量浓度范围内与峰面积有良好的线性关系,精密度、重复性、稳定性和准确性良好。利用已建立的检测方法对市售10个厂家生产的不同批次鱼油保健品进行EPA和DHA的含量测定,揭示了市场上鱼油保健品质量参差不齐的现状,为鱼油保健品质量规范的建立提供一定的科学依据。
