大豆溶血磷脂的制备及其生物安全性分析
2019-08-22伊艳杰王佳奇王子朝张慧茹谷克仁
樊 坤,伊艳杰,刘 阳,李 明,王佳奇,王子朝,张慧茹,谷克仁
(1.河南工业大学 生物工程学院,郑州 450001; 2.河南工业大学 化学化工与环境学院,郑州 450001)

磷脂酶A1可以水解大豆磷脂α位的酰基,产生Sn-1溶血磷脂和脂肪酸,其β位的酰基易转移到α位,最终得到稳定的Sn-2溶血磷脂,最大限度保留磷脂的营养成分,同时增加磷脂的亲水亲油平衡值[6]。李招等[7]提出溶血磷脂的乳化性可改变油脂性状,作为食品添加剂用于食品可增加起酥性,延长贮存期。溶血磷脂通过形成直链淀粉-脂质复合物影响水稻淀粉糊化和热性质,促进淀粉酶水解[8]。Kim等[9]发现溶血磷脂可以提高动物脂肪代谢,改善猪的平均日增重和料肉比。Melero等[10]研究证实了溶血磷脂促进COPII囊泡形成。大豆溶血磷脂还能增加细胞膜的通透性,在一定程度上加快细胞的新陈代谢[11-12]。王恒飞等[13]研究证实低浓度的溶血磷脂通过与海马神经元表面的受体结合,介导促进海马神经元凋亡。鄢黎妮等[14]研究也发现,低剂量溶血磷脂对小胶质细胞有激活增殖作用,而高剂量的溶血磷脂反而有诱导凋亡作用。因此,本试验对制备的大豆溶血磷脂进行生物安全性检测,探究溶血磷脂对细胞及动物的安全使用浓度,为溶血磷脂的安全应用提供科学依据。
1 材料与方法
1.1 试验材料
大豆磷脂:广州倚德生物科技有限公司浓缩大豆磷脂产品,经丙酮萃取、冷冻干燥获得。磷脂酶A1:丹麦NOVO公司。CCK-8试剂盒:日本同仁化学研究所。Caco-2细胞:美国模式培养物集存库(American Type Culture Collection,ATCC,HTB037),细胞在40~60代之间。鸡血细胞:取自市售五华鸡的静脉血制备。
1.2 试验方法
1.2.1 大豆溶血磷脂的制备和纯化
分别称取60、40、20 g大豆磷脂,置于烧杯中,分别加入200 U/g磷脂酶A1和40、60、80 mL蒸馏水混匀,将烧杯置于60℃水浴9 h,期间不断搅拌,反应结束后置于90℃水浴中30 min灭酶活。然后于-40℃真空冷冻干燥72 h,获得粗大豆溶血磷脂。
将3种不同体系获得的大豆溶血磷脂A(60%大豆磷脂-水)、B(40%大豆磷脂-水)和C(20%大豆磷脂-水)分别置于烧杯中,加入300 mL三氯甲烷-甲醇(体积比2∶1)混合溶液溶解,3 500 r/min离心10 min,去除不溶物,所得溶液55℃真空旋转蒸发至高浓度,再用丙酮萃取,所得沉淀-40℃真空冷冻干燥24 h后,-20℃保存,得到纯化大豆溶血磷脂。
1.2.2 水解率测定
分别称取4 g 1.2.1水浴处理后的产物大豆溶血磷脂和对照按1.2.1不加酶水浴处理后的大豆磷脂,加入pH为5.0的0.5%聚乙烯醇10 mL,磁力搅拌10 min溶解,用KOH标准液进行滴定,记录消耗的KOH标准液的体积。计算酶解产物和大豆磷脂的酸价,计算水解率。
X=(C-D)M/(56.1×1 000)×100%
式中:X为酶解反应的水解率,%;C为酶解产物酸价(KOH),mg/g;D为对照大豆磷脂酸价(KOH),mg/g;M为大豆磷脂的平均相对分子质量;56.1是KOH的相对分子质量。
1.2.3 红外光谱检测
在两个碾磨器中分别加1 mg大豆溶血磷脂和大豆磷脂,再加200 mg KBr,室温下碾磨均匀压片,采用傅里叶红外光谱仪分析官能团的变化。
1.2.4 溶血性检测
将鸡血加入抗凝管,上下轻轻混匀,加生理盐水,2 500 r/min离心10 min,弃去上清及白细胞层,再用生理盐水冲洗红细胞,重复离心洗涤3~5次,弃去上清,用移液枪准确吸取100 μL底部沉积的鸡红细胞于生理盐水中,倒置混匀,配成5 mL体积分数2%的红细胞溶液。
吸取100 μL红细胞溶液于蒸馏水中,室温下振荡30 min,使其全部溶血,配成10 mL体积分数1%全溶血对照溶液。
称取大豆溶血磷脂、大豆磷脂各180 mg,分别加入丙三醇1 mL,60℃水浴120 min,每15 min搅拌一次,加生理盐水配成大豆溶血磷脂和大豆磷脂1 mg/mL(丙三醇体积分数0.56%)溶液,再依次稀释成大豆溶血磷脂和大豆磷脂质量浓度分别为500、200、100、50 μg/mL的溶液。
分别吸取各浓度梯度的溶液100 μL置于96孔酶标板中,体积分数0.56%的丙三醇-生理盐水溶液100 μL作为空白对照,每孔加入2%的红细胞溶液100 μL,以200 μL全溶血溶液作为全溶血对照,每个梯度3个重复,轻轻振荡酶标板,室温下静置3 h。对应吸取上清溶液100 μL至新的酶标板中,575 nm下测溶液吸光度,按下式计算溶血率。
溶血率=(测试溶液吸光度-空白对照吸光度)/全溶血对照吸光度×100%
1.2.5 细胞毒性的检测
取10 mL胎牛血清、3 mL青链霉素混合液、1 mL 非必需氨基酸溶于85.4 mL DMEM(dulbecco’s modified eagle medium)高糖培养基,0.22 μm滤膜过滤除菌,配制为基础细胞培养液。在基础细胞培养液中加入灭菌丙三醇配制成体积分数0.56%的丙三醇细胞培养液。
取紫外消毒的大豆溶血磷脂和大豆磷脂各180 mg,用1 mL无菌丙三醇溶解,加入1 mL无菌0.56%丙三醇细胞培养液混合均匀,吸取100 μL混合液至基础细胞培养液中配成9 mL质量浓度1 mg/mL的大豆溶血磷脂和大豆磷脂溶液。然后分别吸取200、150、100、50、20 μL至1 mL离心管中,添加0.56%丙三醇细胞培养液至200 μL,再添加基础培养液至1 mL,配成溶血磷脂和大豆磷脂质量浓度分别为200、150、100、50、20 μg/mL的细胞培养液(丙三醇体积分数为0.11%)。
把生长密度在70%~80%的Caco-2细胞消化离心,细胞计数法计数,在96孔细胞培养板中每孔接种1.0×104个Caco-2细胞。培养24 h后,吸弃培养液,PBS缓冲液冲洗细胞2次,分别加入大豆溶血磷脂和大豆磷脂质量浓度为200、150、100、50、20 μg/mL的细胞培养液200 μL。每个梯度设3个重复,用0.11%丙三醇基础细胞培养液作为对照。培养48 h后,吸出原培养液,添加基础细胞培养液,同时加入10 μL CCK-8溶液,培养1 h后,450 nm下测吸光度,按下式计算细胞成活率。
细胞存活率=试验组吸光度/对照组吸光度×100%
1.2.6 统计与分析
试验数据经Excel 2007整理后,用SPSS软件Anova进行显著性检验,并采用Duncan法进行多重比较,分析各组之间的差异性。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 大豆溶血磷脂的性状
采用磷脂酶A1在60%大豆磷脂-水相体系中制得A溶血磷脂样品、40%大豆磷脂-水相体系中制得B溶血磷脂样品、20%大豆磷脂-水相体系中制得C溶血磷脂样品,经过丙酮萃取,真空冷冻干燥后,所获得的大豆溶血磷脂颜色呈棕色,凝结成块状,无明显豆腥味。3种不同体系制备的大豆溶血磷脂肉眼观察无明显差别。
大豆磷脂是黄色、具有明显豆腥味的粉末状物质,经磷脂酶A1改性,大豆溶血磷脂在色泽、状态和气味上都与大豆磷脂有明显区别,与Hirai等[15]在水相体系中制备的大豆溶血磷脂在状态和色泽上类似。
2.2 大豆溶血磷脂水解率(见表1)

表1 大豆溶血磷脂的水解率 %
由表1可知,在3种酶解体系中,40%大豆磷脂- 水体系制得B样品的水解率最高,酶解效果最好。因此,以40%大豆磷脂-水体系制备大豆溶血磷脂。40%大豆磷脂-水体系的水解率为101.6%,推测可能是在酶解过程中,产生的Sn-1溶血磷脂不稳定,极少数Sn-2位的脂肪酸发生了酰基移位,也产生少量脂肪酸,使得水解率大于100%。陈斌斌[16]在水相体系中对大豆磷脂改性的水解率为111.8%,也明显高于100%。
2.3 大豆溶血磷脂的红外光谱
大豆溶血磷脂红外光谱分析结果如图1所示。

图1 大豆溶血磷脂的红外光谱图

2.4 大豆溶血磷脂的溶血性
按1.2.4检测大豆溶血磷脂和大豆磷脂的溶血率,结果见表2。

表2 大豆溶血磷脂的溶血率
注:同列数据不同肩标大写字母表示P<0.01,小写字母表示P<0.05。下同。
由表2可以看出,大豆溶血磷脂和大豆磷脂溶液都有溶血现象。随着大豆磷脂质量浓度的降低,溶血率急剧下降,1 000 μg/mL大豆磷脂的溶血率为12.3%,而在50 μg/mL时溶血率为0.2%;大豆溶血磷脂也表现出相同的趋势,大豆溶血磷脂在1 000 μg/mL时,溶血率为40.9%,而在50 μg/mL时溶血率为1.1%。
虽然大豆溶血磷脂和大豆磷脂都有溶血现象出现,相比较而言,大豆溶血磷脂在相同质量浓度下的溶血现象均明显高于大豆磷脂,证实大豆磷脂改性后形成的溶血磷脂增加了溶血性。从溶血率来看,除了大豆磷脂1 000、500 μg/mL的溶血率为12.3%和5.7%,大豆溶血磷脂1 000、500 μg/mL的溶血率为40.9%和9.3%以外,其余各组溶血率均低于5%。根据国标规定,低于5%的溶血率视为生物安全[17],建议采用低于200 μg/mL磷脂进行细胞和动物试验,是属于生物安全的。蔡伟惠等[18]采用兔血制备体积分数2%的红细胞液检测丙泊酚纳米注射液中溶血磷脂的溶血率,3批样品溶血磷脂含量分别为0.313、0.273、0.318 mg/mL,而溶血率分别为2.70%、3.37%、3.04%,证实丙泊酚纳米注射液中溶血磷脂的溶血率均小于5%,产品符合国标要求。
2.5 大豆溶血磷脂的细胞毒性(见表3)
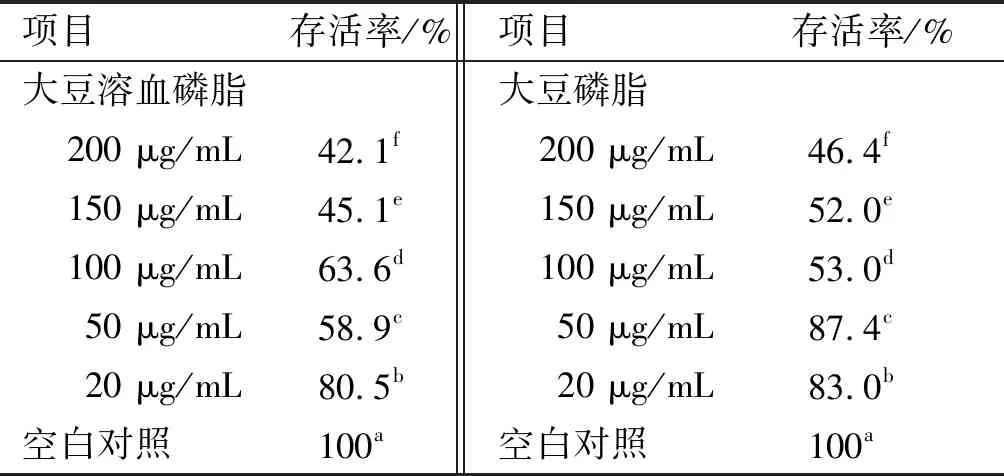
表3 大豆溶血磷脂的细胞存活率
用CCK-8试剂盒检测大豆溶血磷脂对Caco-2细胞的毒性。Caco-2细胞是肠道细胞系,口服溶血磷脂首先接触肠道细胞,故以Caco-2肠道细胞来检验其细胞毒性。由表3可知,随着大豆磷脂质量浓度的降低,Caco-2细胞存活率逐渐升高。在含200 μg/mL大豆磷脂的培养液中,细胞存活率只有46.4%,当大豆磷脂的质量浓度为50 μg/mL时,细胞存活率达87.4%。随着大豆磷脂质量浓度的降低细胞存活率升高,说明大豆磷脂对细胞有一定的损伤。
大豆溶血磷脂也表现出相同的趋势。在200 μg/mL时,Caco-2细胞存活率为42.1%,而20 μg/mL时,Caco-2细胞存活率为80.5%。相比较同质量浓度的大豆磷脂而言,大豆溶血磷脂的细胞存活率略低,说明大豆溶血磷脂对细胞的损伤略高。
3 结 论
试验通过磷脂酶A1在60℃、40%大豆磷脂-水体系改性大豆磷脂得到一种水溶性好、抗氧化性强的大豆溶血磷脂,并且对大豆溶血磷脂的生物安全性进行探究。试验结果显示:大豆溶血磷脂和大豆磷脂均有溶血现象,且二者在200 μg/mL质量浓度以下溶血率均低于5%,可视为生物安全;大豆磷脂低于50 μg/mL以下和大豆溶血磷脂低于20 μg/mL以下使用,Caco-2细胞的存活率均大于80%,但相关的机制还有待深入研究。
